磁共振波谱成像联合fPSA/tPSA、PSAD 对PSA灰区前列腺癌的诊断价值
舒泽华,张克勤,王 毅
(第三军医大学大坪医院野战外科研究所:1.泌尿外科;2.放射科,重庆400042)
前列腺特异性抗原(PSA)是目前筛查前列腺癌(PCa)最常用的免疫指标,PSA 的问世及临床应用对前列腺癌的早发现、早治疗具有重要意义。然而,当PSA 值为4~10ng/mL时,即所谓的“PSA 灰区”,其诊断前列腺癌特异性及敏感性较低[1]。需进一步行前列腺穿刺活检明确诊断,增加了过度穿刺的机会。为提高灰区前列腺癌诊断准确性,临床上已经报道了多种诊断前列腺癌的指标:前列腺特异性抗原比值(fPSA/tPSA)、前列腺特异性抗原密度(PSAD),前列腺特异性抗原前体(p2PSA)、前列腺健康指数(PHI)、前列腺癌基因3(PCA3)、前列腺磁共振波谱成像(MRS)、扩散加权成像(DMI)、动态增强磁共振(DCE-MRI)等[2-3],但单一指标诊断前列腺癌的效果有限,为提高PSA 灰区前列腺癌诊断准确性,现探讨联合MRS、fPSA/tPSA 和PSAD 对PSA 灰区前列腺癌的诊断价值。
1 资料与方法
1.1 一般资料 回顾分析2013年8月至2014年8月本院血清PSA 值为4~10ng/mL的患者60例。纳入标准:(1)男性,年龄大于45岁;(2)血清tPSA 为4~10ng/mL;(3)前列腺穿刺活检或经尿道前列腺电切术后病理为良性前列腺增生或前列腺癌。排除标准:(1)既往有前列腺穿刺活检、前列腺手术史;(2)口服5-α还原酶抑制剂患者;(3)合并尿路感染、3个月内的急性前列腺炎的患者;(4)有多次输血及凝血障碍的患者。
1.2 tPSA、fPSA、fPSA/tPSA、PSAD 测量 PSA 检测标本为血清,采集前2周无直肠指检、前列腺B 超、膀胱镜检查、留置尿管、前列腺按摩等影响血清PSA 水平的外界刺激因素。用化学发光法检测tPSA、fPSA,根据检查结果计算fPSA/tPSA及PSAD。PSAD=tPSA/前列腺体积(cm3)。前列腺体积通过MRI测定获得,计算公式:前列腺体积=前后径(cm)×左右径(cm)×上下径(cm)×0.52。
1.3 MRI、MRS检查及数据测量 患者PSA 检查后3d内采用德国西门子公司Magnetom Verio 3.0T MRI扫描仪行前列腺MRI+MRS检查。将所得的数据传入工作站进行处理,分析各MIR 检查信号异常区域及外周怀疑有病变的区域前列腺代谢产物胆碱(Cho)、肌酸(Cre)和枸橼酸盐(Cit)的波峰谱线,计算(Cho+Cre)/Cit比值。
1.4 采集病理标本 患者完善上述检查后,签署相应知情同意书后行B超引导下经直肠前列腺穿刺活检或经尿道前列腺电切术(TURP)获取病理标本。采用“十二针法”对前列腺进行系统穿刺(术前直肠指检、B超发现结节,或MRI及MRS异常区域等情况下增加穿刺针数)。行TURP患者,取材为电切术后腺体标本,术中发现与正常前列腺组织明显不同处重点取样,送病理科诊断。
1.5 统计学处理 数据用SPSS19.0统计软件进行分析(其中符合正态分布和方差齐性的参数用独立样本t检验法,偏态分布的参数用Mann Whitney非参数检验法进行分析);不同诊断指标的ROC 曲线绘制及曲线下面积比较用MedCalc 软件(DeLong 法)完成。根据ROC 曲线获取不同检查方法最佳临界值,并计算该临界值下灵敏度、特异度、准确度。P<0.05为差异有统计学意义。
2 结 果
2.1 人口统计学资料和临床数据分析 入组60例患者,其中前列腺增生组(BPH 组)36例,PCa组24例。BPH 组和PCa组患者的年龄及tPSA 值差异无统计学意义(P>0.05);fPSA、fPSA/tPSA、前列腺体积、PSAD、(Cho+Cre)/Cit值差异均有统计学意义(P<0.05),见表1。

表1 人口统计学资料和临床数据分析
2.2 最佳临界值条件下MRS、fPSA/tPSA、PSAD 诊断PCa的灵敏度、特异度和准确度 三者ROC 曲线比较差异无统计学意义(P>0.05)。MRS、PSAD 和fPSA/tPSA 的诊断效果相似(表2、图1)。
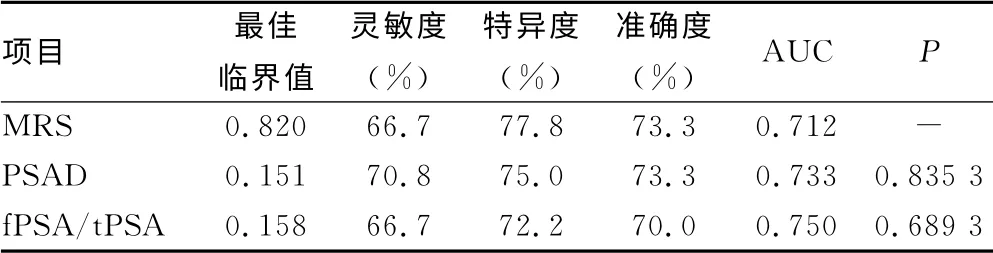
表2 最佳临界值条件下MRS、fPSA/tPSA、PSAD 诊断 PCa的灵敏度、特异度和准确度
2.3 MRS、MRS+PSAD、MRS+fPSA/tPSA、MRS+PSAD+fPSA/tPSA 的ROC曲线比较 用Logistic回归法,将疾病状态(前列腺癌或前列腺增生)选为因变量,诊断指标选为独立变量,保存预测概率值,以预测概率值做ROC 曲线,大于最佳临界概率值则被诊断为前列腺癌[4]。MRS、PSAD、fPSA/tPSA 3项指标联合以后的ROC曲线比较见表3和图2。结果显示:与MRS相比,MRS+PSAD 及MRS+fPSA/tPSA 的AUC有一定程度升高,但组间差异均无统计学意义(P>0.05),MRS+PSAD+fPSA/tPSA 3 项指标联合以后,AUC 显著升高,差异有统计学意义(P=0.020)。
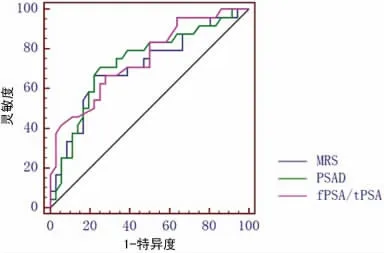
图1 MRS、PSAD 和fPSA/tPSA 的ROC曲线比较
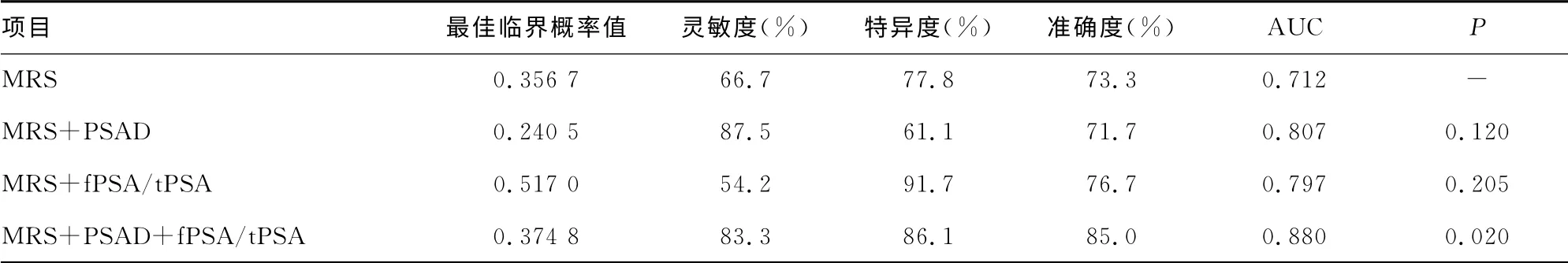
表3 MRS与MRS+PSAD、MRS+fPSA/tPSA、MRS+PSAD+fPSA/tPSA 联合后灵敏度、特异度、准确度及ROC曲线比较
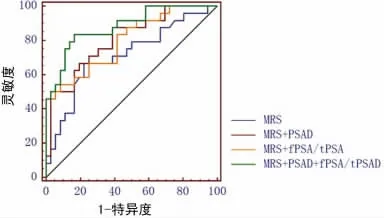
图2 MRS、PSAD 和fPSA/tPSA 3项指标联合的ROC曲线比较
3 讨 论
前列腺癌是目前男性面临最重要的医学问题,发病率在男性恶性肿瘤位居第二位[5],前列腺癌早期诊断成为临床关注热点。为提高灰区前列腺癌诊断准确性,临床上常用的两项指标为PSAD 及fPSA/tPSA,本研究通过ROC 曲线确定PSAD 及fPSA/tPSA 最佳临界值为:0.151ng·mL-1·cm-3及0.158,与国内指南报道的PSAD 及fPSA/tPSA 临界值[6]相似,在最佳阈值条件下,二者对前列腺癌诊断灵敏度及特异度均提高到60%~70%,同国外关于PSAD 及fPSA/tPSA 的临床研究结果一致[7-8]。PSAD、fPSA/tPSA 与PSA 相比提高了诊断灰区前列腺癌特异性及准确性,但其灵敏度及特异度仍较低,且PSAD 测定容易受前列腺体积测定准确性影响,限制其临床应用。
MRS是一种无创前列腺癌诊断方法,通过测定前列腺组织内的Cit、Cho和Cre 3种代谢物质量,计算(Cho+Cre)/Cit值判断前列腺疾病性质。MRS在前列腺癌的诊断、分期、判断治疗后复发等方面发挥着重要作用[9]。本研究确定(Cho+Cre)/Cit最佳临界值为0.82与国外研究结果相似[10],低于国内报道[11],结果波动可能与选择的人群较为特定有关(患者PSA 值位于灰区)。MRS已广泛应用于早期前列腺癌诊断,国外最近一项研究中提出;当(Cho+Cre)/Cit临界值为0.86时,MRS能明显提高PSA 位于2.5~10ng/mL 前列腺癌患者诊断灵敏度、特异度、准确度[12]。
fPSA/tPSA、PSAD、磁共振波谱分析对灰区前列腺癌诊断均有一定应用价值,但单一检查指标诊断效果通常有限,因而临床实践中常通过联合多项指标的方法来提高灰区前列腺癌诊断准确率。国外一项研究将p2PSA 及其衍生物、PHI与fPSA、fPSA/TPSA 等常用诊断指标结合后能明显提高灰区前列腺癌诊断准确性,减少PSA 灰区患者不必要的前列腺穿刺活检[2],但实验指标不能对肿瘤提供定位诊断,对前列腺穿刺活检无定位价值。最近Jambor等提出联合前列腺磁共振T2加权成像、DWI、MRS、DCE-MRI能明显提高PSA 大于4ng/mL患者诊断前列腺癌灵敏度、特异度、准确度,但多项检查增加患者费用,且操作流程复杂。本研究将前列腺癌实验室检查及影像学检查结合构成一临床模型,研究其对前列腺癌诊断价值,建立该模型简单,费用较低,可行性较高。研究结果显示当MRS、PSAD 和fPSA/tPSA 三者联合后对灰区前列腺癌诊断灵敏度、特异度、准确度较单一检查有明显提高,能显著提高PSA 灰区患者前列腺癌诊断准确性,为下一步前列腺穿刺确诊提供准确临床证据;同时穿刺前行MRS检查可为肿瘤提供定位诊断,了解肿瘤周围侵犯情况,根据MRS提供感兴区(肿瘤可疑病变区)进行靶向穿刺,能明显提高前列腺穿刺活检阳性率及减少穿刺活检针数[13],这也可能成为将来研究热点。
综上所述,血清PSA 对灰区前列腺癌患者的诊断价值不明显;MRS、fPSA/tPSA、PSAD 对灰区前列腺癌诊断有一定应用价值,但单一指标诊断效果有限;MRS联合PSAD 及fPSA/tPSA 有助于提高灰区前列腺癌诊断的准确性及进行前列腺癌定位诊断,对PSA 灰区前列腺癌诊断有较高应用价值。
[1] Schroder FH,Roobol MJ.Defining the optimal prostatespecific antigen threshold for the diagnosis of prostate cancer[J].Curr Opin Urol,2009,19(3):227-231.
[2] Lazzeri M,Haese A,de la Taille A,et al.Serum isoform proPSA derivatives significantly improve prediction of prostate cancer at initial biopsy in a total PSA range of 2-10ng/mL:a multicentric European study[J].Eur Urol,2013,63(6):986-994.
[3] Ferro M,Bruzzese D,Perdona S,et al.Prostate Health Index(Phi)and Prostate Cancer Antigen 3(PCA3)significantly improve prostate cancer detection at initial biopsy in a total PSA range of 2-10ng/mL[J].PLoS One,2013,8(7):e67687.
[4] 刘润幸.使用SPSS 作多变量观察值的ROC 曲线分析[J].中国公共卫生,2003(9):133-134.
[5] Center MM,Jemal A,Lortet-Tieulent J,et al.International variation in prostate cancer incidence and mortality rates[J].Eur Urol,2012,61(6):1079-1092.
[6] 那彦群.中国泌尿外科疾病诊断治疗指南[M].北京:人民卫生出版社,2013:62-63.
[7] Murray NP,Reyes E,Orellana N,et al.A comparative performance analysis of total PSA,percentage free PSA,PSA velocity,and PSA density versus the detection of primary circulating prostate cells in predicting initial prostate biopsy findings in Chilean men[J].Biomed Res Int,2014:676572.
[8] Weckermann D,Maassen C,Wawroschek F,et al.Improved discrimination of prostate cancer and benign prostatic hyperplasia by means of the quotient of free and total PSA[J].Int Urol Nephrol,1999,31(3):351-359.
[9] Sciarra A,Panebianco V,Salciccia S,et al.Modern role of magnetic resonance and spectroscopy in the imaging of prostate cancer[J].Urol Oncol,2011,29(1):12-20.
[10] Kurhanewicz J,Vigneron DB,Hricak H,et al.Three-dimensional H-1 MR spectroscopic imaging of the in situ human prostate with high spatial resolution[J].Radiology,1996,198(3):795-805.
[11] 王霄英,周良平,蒋学祥.前列腺三维磁共振波谱成像的初步研究[J].中国医学影像技术,2002(11):1154-1157.
[12] Petrillo A,Fusco R,Setola SV,et al.Multiparametric MRI for prostate cancer detection:performance in patients with prostate-specific antigen values between 2.5 and 10ng/mL[J].J Magn Reson Imaging,2014,39(5):1206-1212.
[13] Javali TD,Dwivedi DK,Kumar R,et al.Magnetic resonance spectroscopy imaging-directed transrectal ultrasound biopsy increases prostate cancer detection in men with prostate-specific antigen between 4-10ng/mL and normal digital rectal examination[J].Int J Urol,2014,21(3):257-262.

