乳酸与凝血功能障碍对危重患儿预后的影响
邱春兰,雷嫏嬛,王兴勇
(重庆医科大学附属儿童医院特需病房/儿童发育疾病研究教育部重点实验室/儿科学重庆市重点实验室/重庆市儿童发育重大疾病诊治与预防国际科技合作基地,重庆400014)
重症脓毒症及多器官功能障碍综合征(MODS)是当前危重患儿主要的死亡原因,虽然目前抗感染药物治疗、专科清除病灶技术,以及危重病监护支持治疗取得了较大的发展,但重症脓毒症的发病率、病死率仍然居高不下。因此,如何对重症脓毒症进行积极有效的治疗及对疾病的预后进行准确判断一直是当代重症医学研究的热点。过去40年大量针对危重患儿的研究表明,血乳酸(LA)与循环低灌注和组织低氧供有关,是一项单独的死亡预测指标[1-2]。凝血功能障碍可导致机体组织器官衰竭,在炎性反应的过程中,许多凝血因子作为炎症介质,激活其他炎症介质,同时也被其他炎症介质所激活[3-4]。本研究拟通过对危重患儿病例进行回顾性分析,探索高乳酸血症、凝血功能障碍与预后之间的关系。
1 资料与方法
1.1 一般资料 收集2012年8月至2013年12月入住重庆医科大学附属儿童医院重症监护室,同时诊断为高乳酸血症及凝血功能障碍的80例危重患儿的临床资料。其中男48例、女32例,年龄1个月至14岁。原发病中先天性心脏病23例,中毒16例,重症肺炎12 例,肠梗阻及腹腔感染8 例,脑创伤6例,腹泻病4例,脓毒症3例,癫痫及颅内感染3例,其他危重病例5例。
1.2 观察指标 (1)危重病评分(PCIS):按中华医学会儿科急救学组拟定的小儿危重病例评分法,以入儿童重症监护室(PICU)24h内的资料计算评分,按所得评分分为3组,①A 组为非危重组(PCIS>80分,n=18);②B组为危重组(PCIS 80~71分,n=30);③C 组为极危重组(PCIS≤70 分,n=32)。(2)动脉血LA 测定:所有患儿采用美国Nova Stat Profile M型血气生化分析仪(电极法)测定动脉血气,LA 正常值为1.0~1.5mmol/L,>2.0mmol/L为高乳酸血症。按乳酸2~10mmol/L、>10mmol/L分为两组。(3)凝血功能测定:所有患儿测定凝血功能,包括血浆凝血酶原时间(PT)、活化部分凝血激酶时间(APTT)、凝血酶时间(TT)、D-二聚体(DD)及纤维蛋白原(FBG)。排除既往有血液系统疾病、肝病及服用抗凝药物的患儿。
1.3 统计学处理 采用SPSS19.0 软件对数据进行统计学分析,计量资料用±s表示,两组之间的比较使用t检验,3组之间的比较使用ANOVA 检验(组间两两比较使用LSD 法)。计数资料用率表示,二者间比较使用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同危重程度患儿预后比较 不同危重程度患儿年龄、性别组成差异没有统计学意义(P>0.05)。B组与A 组相比,休克、MODS发生率明显升高,差异有统计学意义(P<0.05),虽住院病死率有上升趋势,但差异没有统计学意义(P>0.05)。C组与B组相比,休克、MODS发生率、住院病死率均明显升高,差异有统计学意义(P<0.01)。表明PCIS与预后密切相关,见表1。
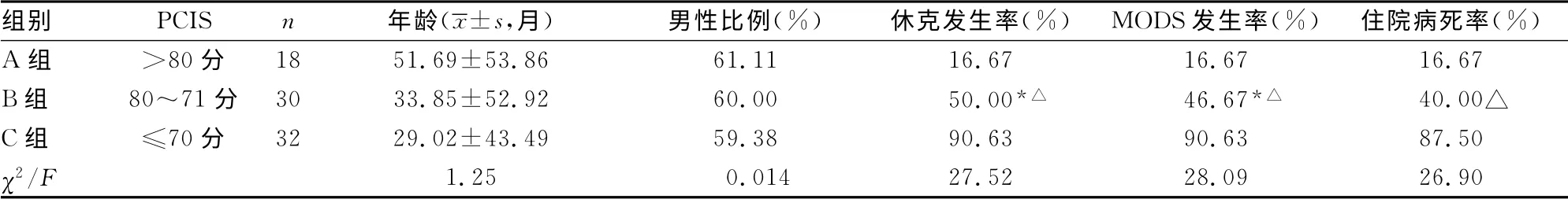
表1 不同危重程度患儿年龄、性别及预后比较
2.2 不同危重程度患儿血乳酸水平比较 B组与A 组相比,入PICU 乳酸值、乳酸峰值均明显升高,差异有统计学意义(P<0.01)。C组与B组相比,入PICU 乳酸值、乳酸峰值也均明显升高,差异有统计学意义(P<0.05),见表2。入PICU 乳酸值、乳酸峰值均与PCIS呈显著的负相关(P<0.01),乳酸峰值与PCIS相关性更强,见图1、2。
表2 不同危重程度患儿血乳酸比较(±s,mmol/L)

表2 不同危重程度患儿血乳酸比较(±s,mmol/L)
*:P<0.05,与A 组比较;△:P<0.05,与C组比较。
组别 PCIS n 入ICU 乳酸值 乳酸峰值A 组 >80分18 5.42±2.73 6.11±2.54 B组 80~71分 30 9.13±2.91*△ 9.30±2.13*△C组 ≤70分 32 10.86±3.11 12.46±1.52 χ2/F 19.60 59.11
2.3 不同危重程度患儿凝血功能障碍比较 B 组患儿与A组相比,PT、APTT、TT 明显升高,FBG 明显下降,差异有统计学意义(P<0.05),DD 有上升趋势,但差异没有统计学意义(P>0.05)。C与B组相比,PT、APTT、TT 明显升高,FBG 明显下降,差异有统计学意义(P<0.05),DD 有上升趋势,但差异没有统计学意义(P>0.05),见表3。PT、APTT、TT、FBG 与PCIS均有显著的线性相关关系(P<0.01)。

图1 入PICU 乳酸值与PCIS的线性关系(r=-0.602)

图2 乳酸峰值与PCIS的线性关系(r=-0.779)
表3 不同危重程度患儿凝血功能比较(±s)

表3 不同危重程度患儿凝血功能比较(±s)
*:P<0.05,与A 组比较;△:P<0.05,与C组比较。
组别 PCIS n PT(s) APTT(s) TT(s) FBG(g/L) DD(μg/L) PLT(×109/L)A 组 >80分 18 41.25±36.37 55.61±28.53 32.19±15.29 1.83±0.51 363.94±214.86 244.28±97.42 B组 80~71分 30 78.63±29.85*△76.22±35.49*△55.42±23.59*△ 1.22±0.58*△1029.27±1991.34 212.63±142.39△C组 ≤70分 32 118.72±45.48 119.33±49.35 72.11±22.76 0.79±0.70 2995.06±6562.03 97.88±47.10 F 24.63 16.64 19.64 16.62 2.63 15.01
2.4 不同乳酸水平患儿组间凝血功能比较 不同乳酸组间在年龄、性别构成方面差异无统计学意义(P>0.05)。随着乳酸水平升高,PT、APTT、TT 明显升高,FBG 明显下降,差异有统计学意义(P<0.05),DD 也有上升趋势,但差异没有统计学意义(P>0.05),见表4。PT、APTT、TT、FBG 与LA 有显著的线性相关关系(P<0.01)。
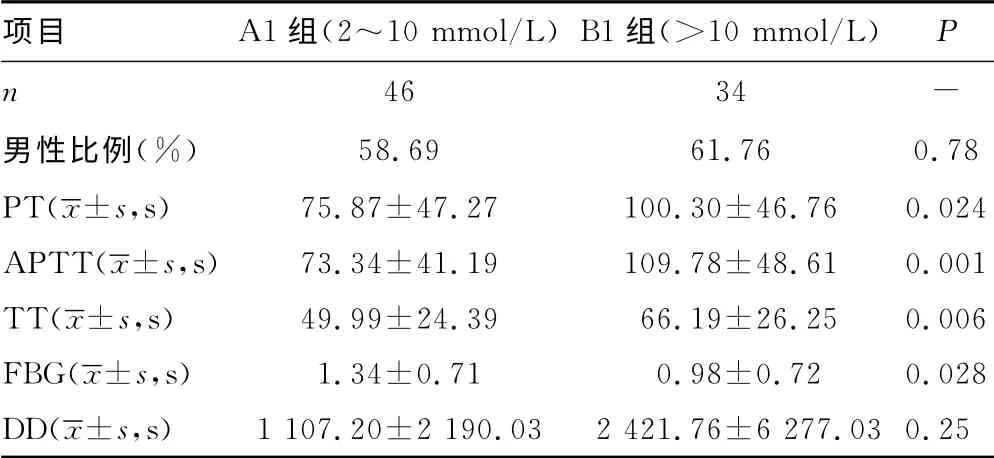
表4 不同乳酸水平患儿凝血功能比较
2.5 凝血指标和乳酸预计危重病例评分的回归方程 PCIS=89.582-0.043PT-0.061APTT-0.078TT+2.551 FBG-0.679LA。PT、APTT、TT、FIB 及LA 的回归系数都具有统计学意义(P<0.05),与PCIS存在显著相关性,见表5。

表5 凝血指标、乳酸与PCIS多元线性回归分析
3 讨 论
小儿PCIS于1995年发表,包括10项生理参数,其简单、方便、易于实施,在我国的危重患儿病情危重程度评价中得到广泛应用。PCIS经过大量临床验证,不仅可以评价疾病危重程度和预后,且PCIS 分值越低,疾病就越危重,死亡发生率越高。
血乳酸反映机体组织细胞氧供与氧耗之间关系,其测量值升高原因主要是机体组织器官缺血和缺氧。本研究在设定纳入标准时,筛除了对血乳酸有干扰的影响因素:如血液系统疾病、肝病及服用抗凝药物的危重患儿。研究表明,PCIS结合血乳酸水平可能对早期评价危重患儿疾病的危重程度及预后判断有重要的价值,在危重症早期,对血乳酸进行动态监测,其临床意义远大于生理参数[5-6]。本研究表明,随着危重患儿PCIS的分值降低,其血乳酸水平也明显升高,并且入PICU 乳酸值、乳酸峰值均与PCIS评分有显著的线性关系。即随着危重患儿的病情加重,血乳酸水平随之升高,因此,血乳酸水平在评估病情危重程度及预后方面,与PCIS 一样有着重要的临床意义。
早期动态监测危重患儿血乳酸水平变化显得尤为重要,应在危重患儿入住PICU 的早期进行乳酸水平监测,在危重疾病的初期,及时纠正组织器官缺氧,改善血乳酸水平的升高,是针对原发病因的支持疗法,当病情得以缓解时,血乳酸水平降低常提示治疗有效[7-9]。如果血乳酸水平升高未得到改善甚至继续上升,应及时寻找其他原因,如血糖增高、肝功能异常、组织缺氧依然未得到纠正、心功能不全等因素[10]。
危重症时将通过血管内皮细胞损伤、组织因子释放、细胞因子作用、磷脂酰氨基酸作用、生理性抗凝抑制、纤溶活性紊乱等方式来激活内外源性凝血途径。相关研究证实,发生弥散性血管内凝血(DIC)的概率与PCIS显著相关[11]。本研究也表明,随着PCIS分值的下降,危重患儿的凝血功能也发生显著相关变化,且PT、APTT、TT、FBG 都与PCIS评分表现出良好的线性相关关系。因此应随时监测患儿的病情进展,动态监测凝血指标,及时纠正凝血功能障碍,防止疾病恶化。
外周循环低灌注,组织器官缺血缺氧,糖酵解活动加强,导致过量乳酸生成;危重患儿普遍存在组织缺血缺氧,由于凝血功能障碍,导致产生大量血栓,造成外周循环低灌注,使得缺氧和酸中毒进一步加重;缺氧、酸中毒等致病因子可损害血管内皮细胞,同时促进外源性凝血途径的发生,三者互相影响,共同作用,加重病情。研究表明,凝血酶的产生与机体内环境有密切关系,如酸中毒可抑制其生成,当机体同时存在低体温时,那么其抑制作用显著增强。一项以208例遭受创伤的患者为研究样本,发现在危重症初期,凝血功能障碍仅发生于组织低灌注者,若仅仅是遭受重创而并未合并外周循环障碍者,大部分不存在凝血功能障碍[12]。研究显示,DIC 可能在危重患者乳酸产生的发病机制中发挥着重要的作用,凝血激活可能通过与内皮及炎性反应相互作用在微循环障碍中发挥作用[13]。
本研究显示,动脉血乳酸水平越高,PT、APTT、TT 明显延长,FBG 明显下降,在相关性分析中发现,乳酸与凝血指标之间有良好的相关性,二者相互影响、共同作用。APTT 延长、PT 延长分别提示了机体内、外源性凝血途径的激活。由此表明,危重患儿存在内源性和外源性凝血功能紊乱,早期即可有高凝状态及多种原因所致的血小板减少,危重患儿机体组织低灌注严重程度与凝血功能障碍发生的概率呈正相关。
本研究显示:随着PCIS 分值下降,疾病危重程度增加,PCIS 与PT、APTT、TT、LA 呈负相关,和FBG 呈正相关;凝血指标和血乳酸对PCIS都有显著影响;乳酸与凝血指标二者有相关性,二者相互作用,共同加重病情。
组织器官缺血缺氧导致机体凝血功能障碍,机体凝血功能障碍反过来使组织细胞缺血缺氧加重,二者相互影响,共同作用,加重病情[14]。由此可见,危重患儿内环境的稳态及组织器官的正常运作对疾病的恢复尤为重要,所以需动态监测患儿各项生命体征,及时完善PCIS,早期定期监测血乳酸、凝血功能,积极改善组织缺氧,纠正凝血功能障碍将有利于改善危重患儿的预后,降低病死率。
[1] Arnold RC,Shapiro NI,Jones AE,et al.Multi center study of early lactate clearance as a determinant of survival in patients with presumed sepsis[J].Shock,2009,32(1):35-39.
[2] Bruno L,Laure OS,Anne MG,et al.Evolution of lactate/pyruvatend arterial ketone boby rations in the early course of catecholamine-treated septic shock[J].Crit Care Med,2000,28(1):114-119.
[3] Levi ML,Schultz M,van der Poll T.Sepsis and thrombosis[J].Semin Thromb Hemost,2013,39(5):559-566.
[4] Coletta C,Szabo C.Potential role of hydrogen sulfide in the pathogenesis of vascular dysfunction in septic shock[J].Curr Vasc Pharmacol,2013,11(2):208-221.
[5] Martha VF,Garcia PCR,Piva JP,et al.Comparison of two prognostic scores(PRISM and PIM)at a pediatric intensive care unit[J].J Pediatr(Rio J),2005,81(3):259-264.
[6] Nichol AD,Egi M,Pettila V,et al.Relative hyperlactatemia and hospital mortality in critically ill patients:a retrospective multicentre study[J].Crit Care,2010,14(1):25.
[7] Jansen TC,van Bommel J,BakkerJ.Blood lactate monitoring in critically ill patients:a systematic health technology assessment[J]Crit Care Med,2009,37(10):2827-2839.
[8] Levy B,Gibot S,Franck P,et al.Relation between muscle Na-K-ATPase activity and raised lactate concentrations in septic shock:aprospective study[J].Lancet,2005,365(9462):871-875.
[9] Robergs RA,Ghiasvand F,Parker D.Biochemistry of exerciseinduced metabolic acidosis[J].Am J Physiol Regul Integr Comp Physiol,2004,287(3):R502-516.
[10] Bakker J,Jansen TC.Don′t take vitals take a lactate[J].Intensive Care Med,2007,33(11):1863-1865.
[11] Clemens F,Christian J.Effects of anticoagulant strategies on activation of inflammation and coagulation[J].Expert Opin Biol Ther,2007,7(6):855-870.
[12] Martini WZ,Pusateri AE,Uscilowicz JM,et al.Independent contributions of hypothermia and acidosis to coagulopathy in swine[J].Trauma,2005,58(5):1002-1009.
[13] Brohi K,Cohen MJ,Ganter MT,et al.Acute traumatic coagulopathy:initiated by hypoperfusion:modulated through the protein C pathway[J].Ann Surg,2007,245(5):812-818.
[14] De Backer,Donadello K,Favory R.Link between coagulation abnormalities and microcirculatory dysfunction in critically ill patients[J].Curr Opin Anaesthesiol,2009,22(2):150-154.

