固相反应法制备β″-Al2O3粉末的热力学研究
何捍卫,王 晓,潘登宇
固相反应法制备β″-Al2O3粉末的热力学研究
何捍卫,王 晓,潘登宇
(中南大学粉末冶金国家重点实验室,长沙410083)
以Na2CO3和α-Al2O3为原料,Na2CO3与α-Al2O3的物质的量比为1:6,采用固相合成法制备β″/β-Al2O3粉末。通过热力学计算原料粉末在不同温度下可能发生的化学反应的吉布斯自由能,并结合Na2CO3/α-Al2O3混合粉末的DTA曲线,研究可能发生的化学反应的温度条件。同时,用X射线衍射仪(XRD)对固相合成粉末的物相组成进行分析。结果表明,Na2CO3/α-Al2O3混合粉末在1 150 ℃左右开始发生反应生成β″/β-Al2O3;最适宜的反应温度为1 250 ℃,α-Al2O3全部转化为β/β″-Al2O3,并且β″-Al2O3含量最高;当温度升高到1 400 ℃时,β/β″-Al2O3发生分解,生成α-Al2O3和Na2O,并且随温度升高,更多的β/β″-Al2O3发生分解,而Na2O在高温下挥发会促进β/β″-Al2O3的分解。当煅烧温度超过1 500 ℃时,β″-Al2O3分解还生成微量的NaAlO2。
热力学;煅烧温度;吉布斯自由能;β″- Al2O3
β″- Al2O3是一种快速离子导电的陶瓷材料[1−2],主要用于钠硫电池的固体电解质[3−4]。β″- Al2O3是一种钠铝复合氧化物,其经验式为Na2O·5.34(Al2O3)[5−6],它还有另外一种同质异构物—β-Al2O3,其经验式为Na2O·11(Al2O3)[7]。在Na2O-Al2O3体系中可能同时存在β″-Al2O3与β-Al2O3两种晶相,FALLY等[8]研究了这2种相各自稳定存在的温度及成分范围,研究结果表明,在制备β″- Al2O3时,β和β″相总是同时存在;当温度高于1 400 ℃时β″相开始转换成β相,在1 550 ℃时此转换反应完成,此时若将温度降低,β″相并不再出现。由此可知,β″相在Na2O-Al2O3系统中为亚稳态相[9],Na2O-Al2O3系统的相图如图1示[10−11]。因此控制反应温度对于制备β″-Al2O3是非常重要的。虽然Na2O-Al2O3体系的相图已经完善,但目前还没有相关文献报道在温度上升过程中(1 100~1 550 ℃)该体系中物质之间所发生的反应,这对于优化制备β″- Al2O3的工艺参数,获取高性能β″- Al2O3粉末及陶瓷具有重要意义。固相合成法是一种常用的、简单易行的制备β″-Al2O3的方法,因此,本研究以Na2CO3和α-Al2O3为原料,采用固相合成法在不同温度下制备β″-Al2O3粉末,并结合原料粉末的DTA曲线和相关热力学数据,系统研究Na2CO3/α-Al2O3混合粉末在不同温度下可能发生的化学反应,为获取纯净的β″-Al2O3提供理论依据。

图1 Na2O-Al2O3的相图
1 实验
1.1 原料与设备
原料粉末为氧化铝(α-Al2O3,粒度0.3 μm)和碳酸钠(Na2CO3,分析纯);酒精(CH3CH2OH,分析纯)主要设备包括电子天平;球磨罐(刚玉,2只);球磨机(S0703681);箱式电阻炉(SX2-3-1)。
1.2 β″- Al2O3粉末的制备
将Na2CO3与α-Al2O3按物质的量比为1:6的比例混合,以酒精为球磨介质,在球磨机中以200 r/min的转速球磨5 h,使粉末混合均匀。将球磨后的混合粉末置于真空干燥箱中,在100 ℃温度下干燥10 h,然后在烧结炉中于不同温度下煅烧2 h,随炉冷却即得到β″-Al2O3粉末。
1.3 分析与检测
利用X射线衍射仪(XRD)对不同温度下煅烧的粉末进行物相分析,扫描范围在5°~80°。对球磨、干燥后的Na2CO3/α-Al2O3混合粉末进行差热分析,升温速率为10 ℃/min,温度范围为20~1 600 ℃,用氩气作为保护气体。
2 结果与讨论
2.1 物相分析
图2所示是Na2CO3/α-Al2O3混合粉末在不同温度下煅烧后的XRD谱。
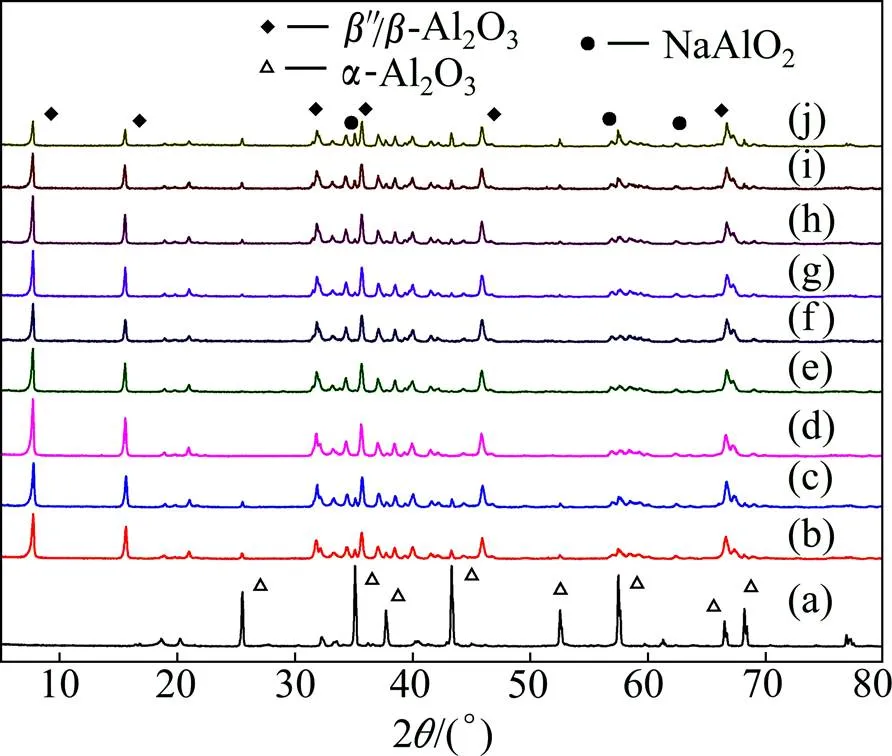
图2 Na2CO3/α-Al2O3混合粉末在不同温度下煅烧后的XRD谱
从图2可看出煅烧温度为1 100 ℃时,煅烧产物主要由α-Al2O3构成,说明在此温度下α-Al2O3没有与Na2CO3发生化学反应生成新的产物。熔点较低的Na2CO3在煅烧过程中被蒸发掉,故煅烧后的粉体中没有检测到Na2CO3;当煅烧温度升到1 150 ℃时,α- Al2O3开始与Na2CO3反应,煅烧产物主要为β″-Al2O3和β-Al2O3的混合物,仍有少量α-Al2O3存在,表明α- Al2O3在1 150 ℃温度下即与Na2CO3反应生成β″- Al2O3和β-Al2O3。煅烧温度达1 250 ℃时,α-Al2O3特征峰消失,煅烧产物为β″-Al2O3和β-Al2O3的混合物。
当煅烧温度升高到1 400 ℃时,煅烧产物中原本在1 250 ℃煅烧温度下已消失的α-Al2O3再次出现,这是由于β″-Al2O3与β-Al2O3的热稳定性较差,在较高温度下发生分解反应生成α-Al2O3。随煅烧温度进一步升高,α-Al2O3的特征峰增强,表明更多β″-Al2O3与β-Al2O3发生分解。当煅烧温度上升至1 500 ℃时,出现较弱的NaAlO2的特征峰,并且α-Al2O3特征峰的相对强度继续增加,表明此时产物中除了有β″- Al2O3和β-Al2O3以及α- Al2O3外,还有微量的NaAlO2。当煅烧温度为1 550 ℃时,粉体中α-Al2O3和NaAlO2的峰强相比于经过1 500 ℃煅烧的粉末进一步增强。
根据β″/β-Al2O3粉末的XRD检测结果,利用式(1)可计算不同煅烧温度下煅烧产物中各主要成分的含量(质量分数),结果列于表1。
从表1可看出,煅烧温度在1 250~1 350 ℃范围内煅烧产物中没有α-Al2O3残留,其中在1 250 ℃下煅烧的粉体中β″- Al2O3含量最高,因此1 250 ℃是最适宜的煅烧温度。
2.2 热力学计算
根据XRD分析结果可知混合粉末在1150~1550℃之间的煅烧过程中出现了α-Al2O3、β″-Al2O3、β-Al2O3、NaAlO2等物质,从无机热力学数据手册[14]中查阅并计算各反应物及生成物的吉布斯自由能,结果列于表2。

(1)
根据参与反应的原材料成分以及在煅烧过程中出现的物质种类,初步判断Na2CO3/α-Al2O3混合粉末煅烧过程中可能发生以下反应[15]:
Na2CO3()+5Al2O3()→Na2O∙5Al2O3()+CO2() (2)

表1 不同煅烧温度条件下粉末中各相的质量分数及其相对含量

表2 Na2CO3/α-Al2O3体系中各反应物和生成物的吉布斯自由能
Na2CO3()+11Al2O3()→Na2O∙11Al2O3()+CO2() (3)
Na2O∙5Al2O3()+6Al2O3()→Na2O∙11Al2O3() (4)
Na2O∙5Al2O3()→Na2O()+5Al2O3() (5)
Na2O∙11Al2O3()→Na2O()+11Al2O3() (6)
Na2O∙5Al2O3()→2NaAlO2()+4Al2O3() (7)
Na2O∙11Al2O3()→2NaAlO2()+9Al2O3() (8)
5Na2O∙5Al2O3()→6NaAlO2()+
2Na2O∙11Al2O3() (9)
由表2的数据计算出不同温度下各反应的吉布斯自由能变化,结果如表3所示。从表3可看出反应(4)和(8)在不同温度下的吉布斯自由能均大于零,表明这2个反应难以发生。即混合粉末中生成的β″-Al2O3不会与Al2O3反应转化成β-Al2O3;β-Al2O3也不会分解为NaAlO2和Al2O3。反应(9)在温度达到1 550 ℃时吉布斯自由能也大于零,说明在此温度下β″-Al2O3也难以分解为NaAlO2和β-Al2O3。从图2可知在煅烧温度低于1 500 ℃时,粉体中并没有出现NaAlO2,这表明当煅烧温度低于1 500 ℃时反应(9)也没有发生;当煅烧温度达到1 550 ℃时粉体中的NaAlO2含量比 1 500 ℃煅烧的粉体有所增加,而热力学计算表明反应(9)在1 550 ℃时不会发生,故粉体中的NaAlO2不是通过发生反应(9)产生的。在上述能生成NaAlO2的反应中,只有反应(7)在不同温度下的吉布斯自由能均小于零。因此,经过高温煅烧后的粉体中的NaAlO2是由β″-Al2O3分解产生的。
2.3 热力学分析
图3所示为Na2CO3与α-Al2O3物质的量比为1:6的Na2CO3/α-Al2O3混合粉末的DTA曲线。
从图中可看到,在1 150~1 170 ℃之间出现了1个放热峰(图中箭头1所示),表明Na2CO3/α-Al2O3体系在此温度区间发生化学反应,这与图1中经过1 150 ℃煅烧的粉体出现β″/β-Al2O3的结果一致。根据反应的吉布斯自由能变化可知,此时反应(2)和反应(3)的吉布斯自由能变化Δ<0,因此这2个反应均能发生,分别生成β″-Al2O3和β-Al2O3,而β″-Al2O3的含量大于β-Al2O3的含量,可能是由于β″-Al2O3的生成速率比β-Al2O3的生成速率更快。
由图3可知,煅烧温度为1 350℃和1 400 ℃的粉末,其成分的唯一差别就是经过较高温度煅烧的粉体中出现了α-Al2O3,即在1 400 ℃煅烧时发生了生成α-Al2O3的反应。从混合粉末的DTA曲线可以看出在1 350 ℃和1 400 ℃之间只出现了1个放热峰(图中箭头2所示),由此可以推断该放热峰是由于生成α-Al2O3的反应造成的。根据表3的结果可知,此时反应(5)、(6)、(7)的 Δ<0,这3个反应均有可能发生,但产物中没有发现NaAlO2,说明未发生反应(7)。而反应(5)和反应(6)在1 350~1 400 ℃之间均可能发生,生成α-Al2O3和Na2O,由于Na2O的沸点为1 275 ℃,在超过1 300 ℃的高温下很容易挥发,因此经过1 400 ℃高温煅烧的粉体中一般没有Na2O残留。从表1可知,当煅烧温度由1 350 ℃升高到1 400 ℃时,β″-Al2O3和β-Al2O3的含量都下降,这说明2种物质在此温度下均发生了分解,即反应(5)和反应(6)都发生了,且β″- Al2O3的含量相对于β-Al2O3的含量逐渐减少(如表1所示),说明高温下β″-Al2O3的热稳定性比β-Al2O3差,在高温下容易发生分解。
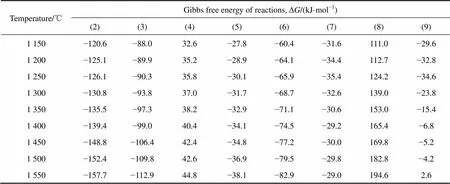
表3 Na2CO3/α-Al2O3体系中各反应的吉布斯自由能变化
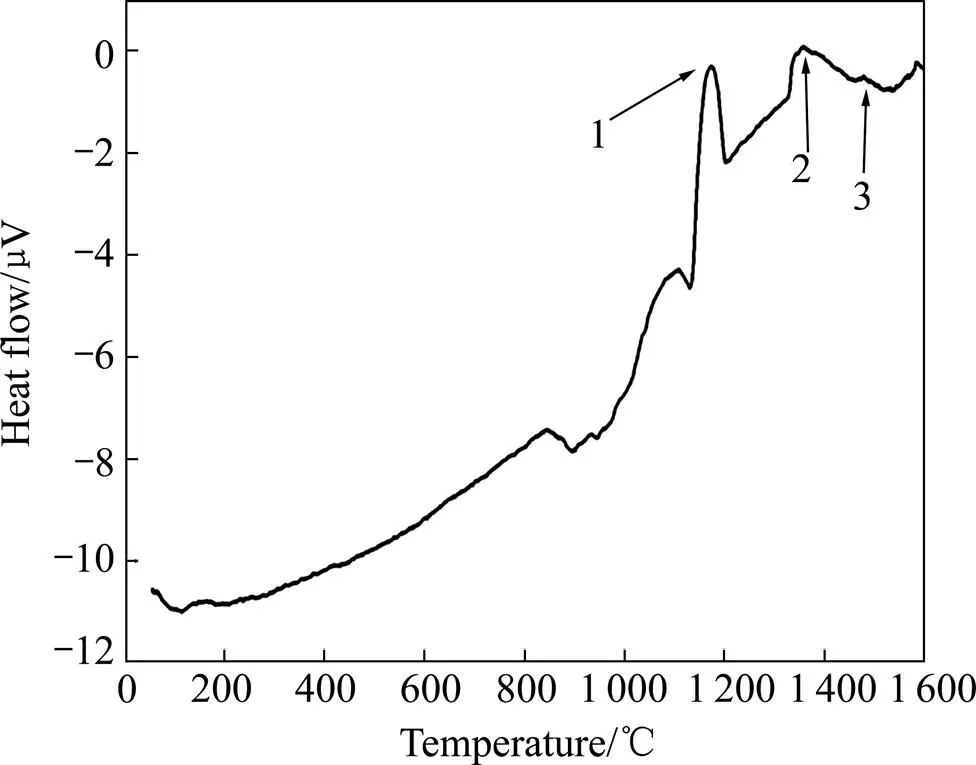
图3 Na2CO3与α-Al2O3物质的量比为1:6的混合粉末的DTA曲线
图3中在1 500 ℃时出现1个很小的放热峰(如图中箭头3所示),即在此温度下可能发生了1个微弱的化学反应,图2显示1 500 ℃煅烧的粉体中含有了微量的NaAlO2。由2.2节的讨论可知,此时生成NaAlO2的反应只有可能是反应(7),故DTA曲线上1 500 ℃处的小峰很可能是发生了微弱的反应(7)造成的。
综合以上结果与分析可知,生成β″/β-Al2O3的化学反应在1 150 ℃开始发生,1 250~1 350 ℃之间是制备β″-Al2O3较为适宜的温度范围,1 250 ℃为最佳煅烧温度,在此温度下获得的粉体中β″-Al2O3的含量 最高。
3 结论
1) 将Na2CO3与α-Al2O3按物质的量比为1:6的比例混合,采用固相合成法制备β″-Al2O3的过程中,生成β″-Al2O3和β-Al2O3的反应几乎同时在1 150 ℃左右开始发生,β″-Al2O3的生成速率比β-Al2O3更快,当温度低于1 100 ℃时,Na2CO3与α-Al2O3之间不发生化学反应。
2) 最适宜的煅烧温度为1 250 ℃,此时,α-Al2O3全部转化为β″-Al2O3,且β″-Al2O3含量最高;当煅烧温度超过1 350 ℃时,热稳定性较差的β″/β-Al2O3开始发生分解,重新转化成α-Al2O3,其中β″-Al2O3的分解速率更快。
3) 当煅烧温度超过1 500 ℃时,β″-Al2O3同时发生另一种分解反应,生成NaAlO2,但这种分解反应速率很慢,仍然以生成α-Al2O3的分解方式为主。
REFERENCES
[1] 二宫清, 杨跃先. β-氧化铝[J]. 轻金属, 1981(11): 16−18. ER Gong-qing, YANG Yue-xian. β-alumina [J]. Light Metals, 1981(11): 16−18.
[2] 李 婷. 电子陶瓷技术及其产业走向未来[J]. 现代技术陶瓷, 2012(3): 20−26. LI Ting. The future direction of electronic ceramic technology and its industry [J]. Modern technical ceramics, 2012(3): 20−26.
[3] BITO A. Overview of the sodium-sulfur battery for the IEEE stationary battery committee [C]. Power Engineering Society General Meeting, 2005: 1232−1235.
[4] 孙丙香. 钠硫电池储能应用现状研究[J]. 现代电力, 2010, 27(6): 62−65. SUN Bing-xiang. Research on the application of NaS cattery energy storage system [J]. Modern Electric Power, 2010, 27(6): 62−65.
[5] KUMMER J T. β-Alumina electrolytes [J]. Progress in Solid State Chemistry, 1972(7): 141−175.
[6] YAMAGUCHI G, SUZUKI K. On the structure of alkali polyaluminates [J]. Bulletin of the Chemical Society of Japan, 1968, 41(1): 93−98.
[7] RIDGWAY R, KLEIN A, O'LEARY W. The preparation and properties of so-called ‘beta-alumina’ [J]. Transactions of the Electrochemical Society, 1926, 70(1): 71−88.
[8] FALLY J, LASNE C, LAZNNEC Y, et al. Study of a beta-alumina electrolyte for sodium-sulfur battery [J]. Journal of the Electrochemical Society, 1973, 120(10): 1296−1298.
[9] HODGE J D. Phase relations in the system Na2O-Li2O-Al2O3[J]. Journal of American Ceramic Society, 1984, 67(3): 183−185.
[10] le CARS Y, COMES R, DESCHAMPS L, et al. Organisation des cations assurant la conduction dans l′alumine [J]. Acta Crystallographica Section A, 1974, 30(3): 305−309.
[11] le CARS Y, GRATIAS D, PORTIER R, et al. Planar defects in β-alumina [J]. Journal of Solid State Chemistry, 1975, 15(3): 218−222.
[12] de KROON A P, SCHAEFER G W, ALDINGER F. Direct synthesis of binary K-beta- and K-beta″-alumina. 1. Phase relations and influence of precursor chemistry [J]. Chemistry of Materials, 1995, 7(5): 878−887.
[13] SONG H I, KIM E S, YOON K H. Phase transformation and characteristics of beta-alumina [J]. Physica B-Condensed Matter, 1988, 150(1): 148−159.
[14] 梁英教, 车荫昌. 无机热力学数据手册[M]. 沈阳: 东北大学出版社, 1993: 249−258. LIANG Jiao-ying, CHE Yin-chang. Inorganic Thermodynamic Data Manual [M]. Shenyang: Northeastern University Press, 1993: 249−258.
[15] RAY A K, SUBBARAO E C. Synthesis of sodium β and β″ alumina [J]. Materials Research Bulletin, 1975, 10(6): 583−590.
(编辑 汤金芝)
Thermodynamics study of β″-Al2O3powders prepared by solid state method
HE Han-wei, WANG Xiao, PAN Deng-yu
(State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
β″/β-Al2O3powder was prepared by solid state method using Na2CO3and α-Al2O3as raw materials with a molar ratio of 1:6. The reaction temperature of different chemical reactions which might occur during calcination process was investigated by the calculation of Gibbs free energy and differential thermal analysis (DTA) curve of Na2CO3and α-Al2O3mixed powder. The phase composition of calcined powder was characterized by X-ray diffraction (XRD). Results show that in the mixed powder, Na2CO3begins to react with α-Al2O3to form β″/β-Al2O3at the temperature of 1 150 ℃. The optimum calcination temperature is 1 250 ℃, at which temperature all α-Al2O3can transform into β″/β-Al2O3and the content of β″- Al2O3is the most. The β″/β-Al2O3will decompose into α-Al2O3and Na2O, when calcining temperature increases to 1 400 ℃. The decomposition content of β″/β-Al2O3increases with the increasing temperature and the evaporation of Na2O under high temperature accelerates the decomposition of β″/β-Al2O3. When the calcining temperature increases to 1 500 ℃, a small amount of NaAlO2is produced by the decomposing of β″-Al2O3.
thermodynamics; calcining temperature; Gibbs free energy; β″-alumina
TQ174
A
1673-0224(2015)3-338-06
2014-05-08;
2014-12-03
何捍卫,教授,博士。电话:0731-88836311;E-mail: hehanwei@163.com

