不同促排卵方案对多囊卵巢综合征患者子宫及卵巢血流的影响*
杨丽娟,李洁,王玫,胥杜娟,李冬兰,胡发明(江西省南昌市生殖医院,江西南昌330000)
不同促排卵方案对多囊卵巢综合征患者子宫及卵巢血流的影响*
杨丽娟,李洁,王玫,胥杜娟,李冬兰,胡发明
(江西省南昌市生殖医院,江西南昌330000)
摘要:目的探讨多囊卵巢综合征(PCOS)伴不孕患者多种促排卵药物治疗前后子宫及卵巢血流动力学变化。方法对该院行供精人工授精的150例PCOS患者,在自然周期月经的第2~3、16~18和20~25天及不同促排方案[克罗米芬(CC)组、CC+人绝经期促性腺激素(HMG)组、来曲唑(LE)组、LE+HMG组、HMG 组]的人绒毛膜促性腺激素(HCG)注射日行阴道彩色多普勒超声检查,测量子宫内膜厚度、形态,内膜血流、子宫和卵巢动脉血流收缩期峰值血流速度(PSV)及阻力指数(RI)等参数,然后对不同月经时间、促排前后、不同促排方案间妊娠组与非妊娠组的相关参数进行比较。结果PCOS患者自然周期子宫、卵巢动脉血流PSV、RI值等无周期性变化;使用促排卵药物后子宫内膜厚度、子宫内膜A型率、子宫内膜A型血流率、子宫内膜下、卵巢及子宫动脉血流的PSV等明显增加,子宫内膜下、卵巢及子宫动脉血流的RI明显降低;5种促排卵方案中,LE+HMG组方案子宫内膜A型血流率、子宫内膜下血流PSV值明显高于其余4组,且该组的妊娠率最高;妊娠患者HCG注射日子宫内膜下、子宫及卵巢动脉血流PSV明显高于非妊娠患者,但RI指数则明显低于非妊娠患者。结论①PCOS患者使用促排卵药物,使患者恢复排卵的同时亦能改善子宫内膜容受性,其中以LE+ HMG方案最佳;②HCG注射日子宫内膜下、子宫及卵巢动脉血流的改善有助于提高人工授精的成功率。
关键词:多囊卵巢综合征;促排卵;子宫血流;卵巢血流;超声
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄期妇女常见的内分泌及代谢紊乱性疾病,育龄期妇女患病率约为5.61%[1],是无排卵性不孕的主要原因。使用促排卵药物联合辅助生殖技术治疗后,多数患者能排卵,但妊娠率相对较低,这可能由于PCOS除影响卵泡质量外,也会影响子宫内膜血流[2]。目前,认为阴道彩色多普勒超声检查子宫内膜血流可反映子宫内膜容受性。为提高妊娠成功率,指导临床用药,本研究对采用多种不同促排卵方案的PCOS患者,用阴道彩色多普勒超声检查子宫和卵巢的血流变化,探讨不同促排卵药物对子宫和卵巢血流变化及妊娠结局的影响。
1 资料与方法
1.1研究对象
2011年1月-2014年9月在南昌市生殖医院行供精人工授精的PCOS患者150例,行不同促排卵方案进行治疗,不同促排卵方案PCOS患者的年龄、BMI值比较,差异无统计学意义。PCOS的诊断参照2003年的鹿特丹标准[3]:①稀发排卵或无排卵;②高雄激素的临床表现或高雄激素血症;③超声表现为PCOS。符合上述3项中任何2项者,即可诊断为PCOS。所有患者子宫形态正常。输卵管造影显示,双侧输卵管通畅,男方均为无精子症患者。
1.2方法
1.2.1分组采用美国GE公司Voluson 730 ProⅤ型彩色多普勒超声诊断仪(探头频率为7 MHz,伞扩角度179°)对150例PCOS患者自然月经周期的第2~3、16~18和20~25天进行监测,本组患者再次月经第3~5天就诊,随机采用以下不同的促排卵方案:①克罗米芬(clomiphene,CC)组,月经第5~9天每日口服CC 50 mg;②CC+人绝经期促性腺激素(human menopausal gonadotropin,HMG)组,月经第5~9天每日口服CC 50 mg,第10天起每日肌内注射HMG 37.5~75.0 u;③来曲唑(letrozol,LE)组,月经第5~9天每日口服LE 2.5 mg;④LE+HMG组,月经第5~9天每日口服LE 2.5 mg,第10天起每日肌内注射HMG 37.5~75.0 u;⑤HMG组,月经第5天起每日肌内注射HMG 37.5~75.0 u。5组方案用药后二维超声监测卵泡,直至卵泡≥18 mm,黄体生成素(luteinizing hormone,LH)峰值>10 u/ml时,为人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)肌内注射日,再次使用彩色多普勒超声诊断仪进行监测,注射HCG后的24~36 h,即预计排卵前和排卵后12 h内给予宫腔内人工授精,14 d后抽血查β-HCG>25 mIU/ml,确诊为生化妊娠,生化妊娠者4周后B超检查,于宫腔内见到妊娠囊,并见原始心管搏动者确诊为临床妊娠,未妊娠者于接下来的周期重新开始促排卵治疗。
1.2.2检查方法及监测指标测量PCOS患者自然周期的第2~3、16~18和20~25天及促排卵周期HCG注射日的子宫内膜厚度、形态、卵巢动脉、子宫动脉和内膜血流参数。血流参数包括血流的阻力指数(resistance index,RI)及收缩期的峰值血流速度(peak systolic blood flow velocity,PSV),以上监测时间安排在每天上午10∶00~12∶00,同一医师操作,患者B超前需排空膀胱,取截石位,将阴道探头套上避孕套并涂少量耦合剂后,放入阴道内进行检查。
子宫内膜形态分型采用GONEN等[4]的分型标准:①A型,三线型或多层子宫内膜,低回声的为内层,强回声的为外层和中部,宫腔中线回声比较明显;②B型,中部为孤立回声,如同子宫肌层图像,但宫腔中线回声不明显;③C型,宫腔中线没有回声,全为均质的强回声。子宫内膜的血流分型采用CHIEN等[5]的分型标准:①A型,可同时监测到内膜下及内膜内血流;②B型,只能监测到内膜下的血流;③C型,内膜内和内膜下的血流均监测不到。
1.3统计学方法
采用SPSS 13.0统计软件进行数据分析,计量资料用均数±标准差(±s)表示,用t检验或方差分析;计数资料用率表示,用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1一般情况
150例PCOS患者,促排卵205个周期,5组不同促排卵方案患者的年龄、体重指数比较,差异无统计学意义(P>0.05)。见表1。
2.2促排卵前不同月经时期子宫内膜厚度、形态、血流、子宫及卵巢动脉参数比较
自然周期150例PCOS患者中,子宫内膜形态为A型的患者63例(42%),可测到内膜内线状血流的患者33例(22%)。月经周期不同时间段的子宫内膜厚度、子宫内膜下、子宫及卵巢动脉血流参数PSV,RI比较,差异无统计学意义(P>0.05)。见表2。
2.3不同促排卵方案与自然周期PCOS患者的妊娠率、内膜厚度、形态及血流比较
5组不同促排卵方案分别与自然周期PCOS患者在子宫内膜厚度、子宫内膜A型率、子宫内膜A型血流测出率进行比较,差异有统计学意义(P<0.01);对5组的妊娠率、子宫内膜厚度、子宫内膜A型率、子宫内膜A型血流比率进行比较,LE+HMG组妊娠率高于其他组,差异有统计学意义(P<0.05),其余各组妊娠率比较差异无统计学意义;CC组内膜厚度低于其余4组,差异有统计学意义(P<0.05),其余各组内膜厚度比较差异无统计学意义;LE+HMG组的子宫内膜A型血流比率高于其余4组,差异有统计学意义(P<0.01),其余各组子宫内膜A型血流比率比较差异无统计学意义。见表3。
表1 不同促排卵方案患者的年龄、体重指数比较(n=30±s)
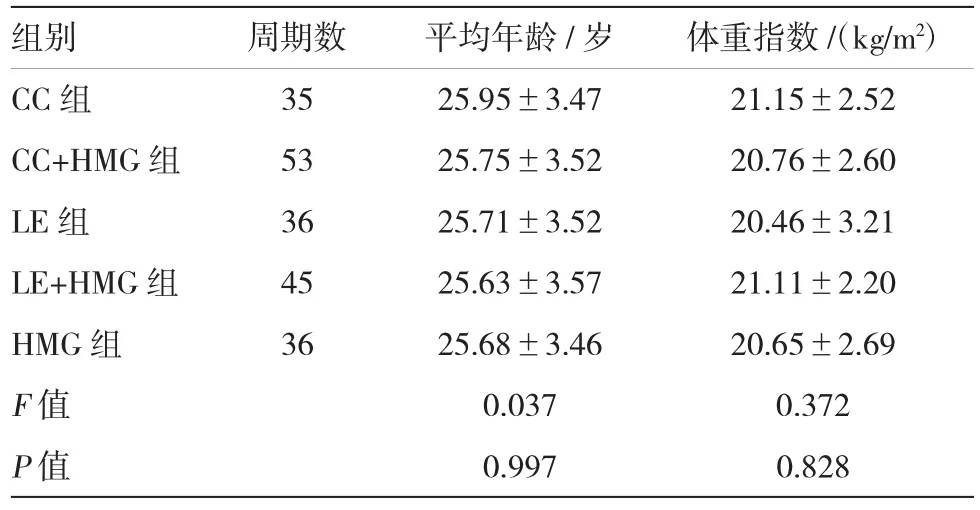
表1 不同促排卵方案患者的年龄、体重指数比较(n=30±s)
组别 周期数 平均年龄/岁 体重指数/(kg/m2)CC组 35 25.95±3.47 21.15±2.52 CC+HMG组 53 25.75±3.52 20.76±2.60 LE组 36 25.71±3.52 20.46±3.21 LE+HMG组 45 25.63±3.57 21.11±2.20 HMG组 36 25.68±3.46 20.65±2.69 F值 0.037 0.372 P值 0.997 0.828
2.4不同促排卵方案与自然周期PCOS患者的内膜下血流、子宫及卵巢动脉参数比较
表2 150例PCOS患者自然周期的子宫内膜厚度、子宫内膜下、子宫及卵巢动脉血流参数(±s)
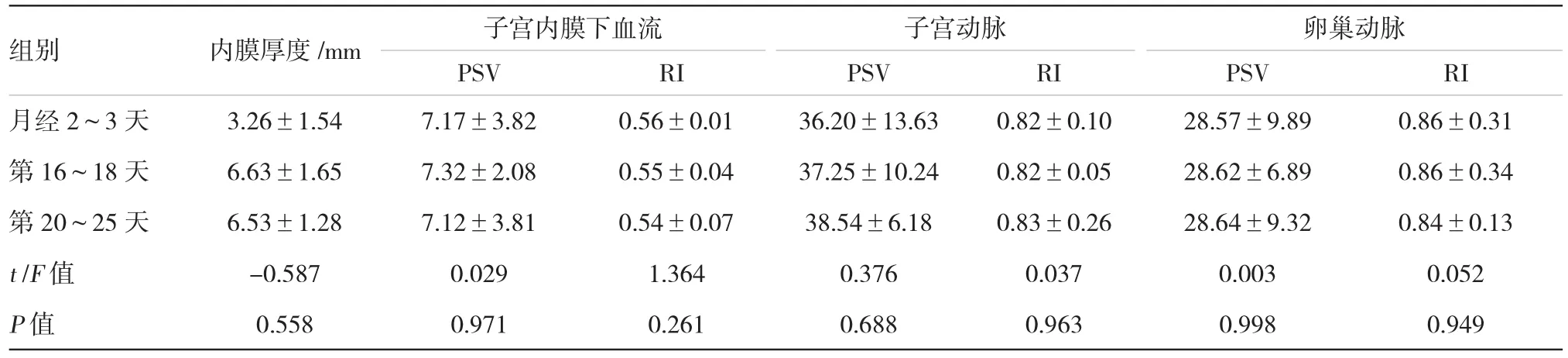
表2 150例PCOS患者自然周期的子宫内膜厚度、子宫内膜下、子宫及卵巢动脉血流参数(±s)
组别 内膜厚度/mm 子宫内膜下血流 子宫动脉 卵巢动脉PSV PSV PSV RI月经2~3天 3.26±1.54 7.17±3.82 0.56±0.01 36.20±13.63 0.82±0.10 28.57±9.89 0.86±0.31 第16~18天 6.63±1.65 7.32±2.08 0.55±0.04 37.25±10.24 0.82±0.05 28.62±6.89 0.86±0.34 第20~25天 6.53±1.28 7.12±3.81 0.54±0.07 38.54±6.18 0.83±0.26 28.64±9.32 0.84±0.13 t/F值 -0.587 0.029 1.364 0.376 0.037 0.003 0.052 P值 0.558 0.971 0.261 0.688 0.963 0.998 0.949 RI RI

表3 5组促排卵方案PCOS患者HCG注射日的子宫内膜厚度、形态及子宫内膜血流参数
5组不同促排卵方案分别与自然周期PCOS患者在子宫内膜下、子宫及卵巢动脉血流PSV、RI值进行比较,差异有统计学意义(P<0.05);对5组间的子宫内膜下、子宫及卵巢动脉血流PSV、RI值进行比较,仅LE+HMG组与其它4组的子宫内膜下血流PSV值比较,差异有统计学意义(P<0.01),各组间其他指标比较,差异无统计学意义(P>0.05)。见表4。
2.5妊娠组与非妊娠组的子宫内膜下血流、子宫及卵巢动脉参数比较
对妊娠组与未妊娠组HCG注射日的子宫内膜下、子宫及卵巢动脉血流参数PSV、RI值进行比较,差异有统计学意义(P=0.000)。见表5。
表4 促排卵周期PCOS患者HCG注射日子宫内膜下、子宫及卵巢动脉的血流参数(±s)
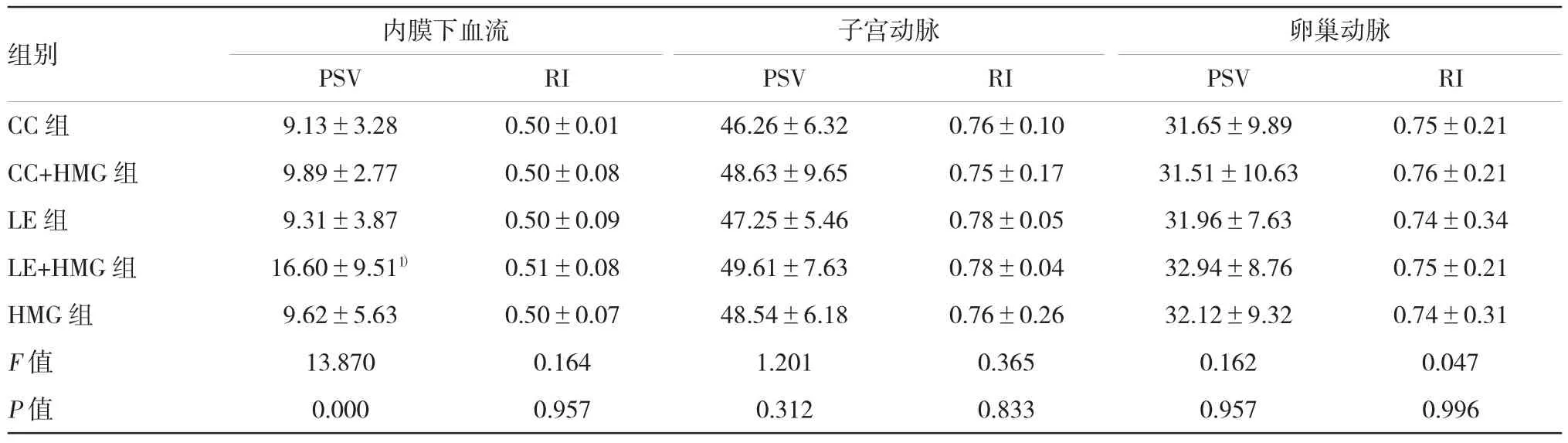
表4 促排卵周期PCOS患者HCG注射日子宫内膜下、子宫及卵巢动脉的血流参数(±s)
注:1)与其他组比较,P<0.01;与CC组比较,t=4.441,P=0.000
组别 内膜下血流 子宫动脉 卵巢动脉PSV PSV PSV RI CC组 9.13±3.28 0.50±0.01 46.26±6.32 0.76±0.10 31.65±9.89 0.75±0.21 CC+HMG组 9.89±2.77 0.50±0.08 48.63±9.65 0.75±0.17 31.51±10.63 0.76±0.21 LE组 9.31±3.87 0.50±0.09 47.25±5.46 0.78±0.05 31.96±7.63 0.74±0.34 LE+HMG组 16.60±9.511) 0.51±0.08 49.61±7.63 0.78±0.04 32.94±8.76 0.75±0.21 HMG组 9.62±5.63 0.50±0.07 48.54±6.18 0.76±0.26 32.12±9.32 0.74±0.31 F值 13.870 0.164 1.201 0.365 0.162 0.047 P值 0.000 0.957 0.312 0.833 0.957 0.996 RIRI
表5 妊娠组与未妊娠组HCG注射日的子宫内膜下、子宫及卵巢动脉血流参数(±s)
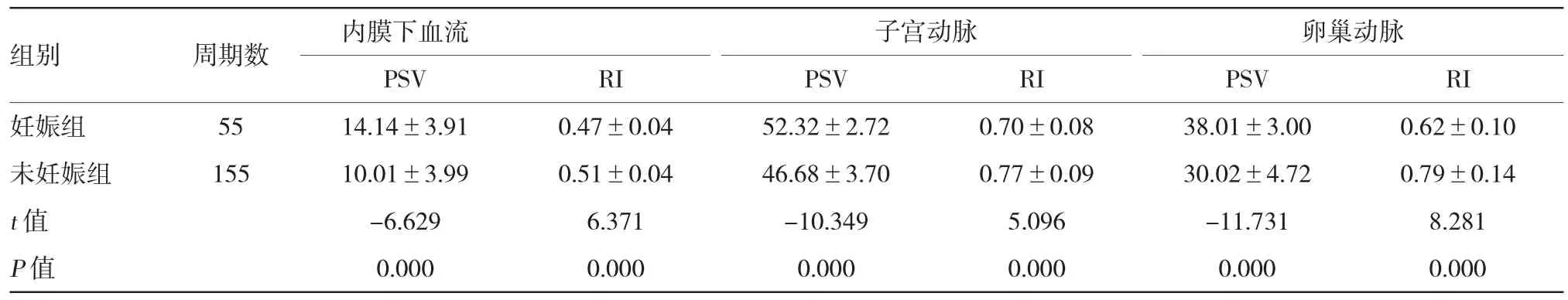
表5 妊娠组与未妊娠组HCG注射日的子宫内膜下、子宫及卵巢动脉血流参数(±s)
组别 周期数 内膜下血流 子宫动脉 卵巢动脉PSV PSV PSV RI妊娠组 55 14.14±3.91 0.47±0.04 52.32±2.72 0.70±0.08 38.01±3.00 0.62±0.10未妊娠组 155 10.01±3.99 0.51±0.04 46.68±3.70 0.77±0.09 30.02±4.72 0.79±0.14 t值 -6.629 6.371 -10.349 5.096 -11.731 8.281 P值 0.000 0.000 0.000 0.000 0.000 0.000 RI RI
3 讨论
胚胎的成功着床取决于胚胎质量和子宫内膜容受性,近年来有文献表明,子宫内膜血流可预测子宫内膜容受性,而阴道彩色超声多普勒监测子宫内膜厚度、形态,血流分布已成为评估子宫内膜容受性的优选方法,在越来越多的辅助生殖技术中采用[6-7]。
人体正常月经周期子宫内膜厚度、形态、子宫及卵巢动脉血流均随体内激素水平变化而发生改变,如子宫内膜增殖期,子宫和卵巢动脉血流阻力偏大,RI增大;分泌期子宫和卵巢动脉血流阻力减小,RI降低,呈周期性改变[8-9]。本研究结果表明,PCOS患者在未使用促排卵药物前,月经第2~3、16~18和20~25天的子宫内膜厚度、子宫内膜下、卵巢及子宫动脉血流参数无变化,监测不到子宫内膜内血流,这与乐桂容[10]和JONES等[11]的研究结果一致,提示PCOS患者激素分泌紊乱,子宫内膜无增殖,分泌周期性改变,子宫内膜容受性降低。而使用促排药物后,子宫内膜厚度、子宫内膜A型率、子宫内膜A型血流比率、子宫内膜下、子宫及卵巢动脉收缩期血流流速较治疗前明显增加,血流阻力减弱,RI降低。提示任何一种促排卵药物不仅能改善卵巢血流,促进PCOS患者恢复排卵,也使子宫内膜血流灌注量增大,内膜增厚,为孕卵着床做好准备。
曲庆兰等[12]的研究表明,在HCG日监测子宫内膜血流可很好地评价子宫内膜容受性,预测体外受精联合胚胎移植技术的种植率。而卵巢血流则可以很好的评估卵泡的发育、成熟及排卵,且HCG注射日卵巢血流搏动指数可预测获卵数及胚胎的质量[13]。本研究结果表明,妊娠组的HCG注射日子宫内膜下、子宫及卵巢动脉血流PSV显著高于非妊娠组,而RI值则明显低于非妊娠组,表明HCG日子宫内膜下血流、子宫动脉、卵巢动脉血供的改善有助于提高妊娠率,这与曲庆兰等[12]的结果一致,表明子宫内膜下血流改善可增加子宫内膜的容受性,有利于胚胎着床,而卵巢动脉血供改善则可提高卵泡的质量,进而间接提高胚胎的质量,从而影响妊娠率。
PCOS患者存在排卵障碍性不孕,往往成为患者就诊的主要原因,其治疗的关键是诱导排卵,目前PCOS促排卵药物主要有CC、HMG及LE。其中CC一直是PCOS促排卵治疗的一线药物,其促排卵机制是通过与内源性雌激素竞争下丘脑部位的雌激素受体,阻断雌激素对下丘脑的负反馈作用,促使垂体分泌促性腺激素,促进卵泡发育。而LE是一种芳香化酶抑制剂,通过阻碍雄激素向雌激素转化而降低体内雌激素水平,解除雌激素对下丘脑或垂体的负反馈,促进促性腺激素的分泌,促进卵泡发育。近几年研究表明,对于CC抵抗的PCOS患者,使用LE后可显著提高排卵率[14-15],对于CC抵抗的PCOS患者也可使用HMG,但HMG因其较强的药理作用易导致多胎和卵巢过度刺激综合征,限制其在PCOS中的应用,因此寻找最适合PCOS的促排方案迫在眉睫。
本研究结果表明,5组促排卵方案中,CC组HCG日的内膜最薄,其余各组内膜比较差异无统计学意义,这与许咏乐[16]和GOMEZ等[17]的研究结果一致,可能原因如下:①CC使用过程中拮抗雌激素而对子宫内膜产生不良影响,而HMG的添加则可促进卵泡发育,增加雌激素水平,从而改善内膜的厚度;②LE或HMG本身无拮抗雌激素作用,LE多在卵泡发育的早期服用,其半衰期仅有2~4 d,到卵泡发育后期,其降低雌激素水平作用基本消失,故不会影响子宫内膜的厚度。
有研究[7]对182例体外受精联合胚胎移植技术患者在HCG注射日进行子宫内膜血流检测,子宫内膜内血流缺乏者(C型血流)无1例临床妊娠,检测到子宫内膜血流者(A型血流)显示良好的妊娠率(62.2%)和胚胎种植率(32.2%)。本研究中,LE+HMG组的A型内膜血流比例最高,子宫的内膜下血流PSV明显升高,表明该促排卵方案可明显改善HCG日子宫内膜血流,从而改善子宫内膜的容受性,提高妊娠率。
MOUSTASA等[18]通过比较不明原因的不孕妇女采用LE和CC治疗后阴超下子宫内膜血流的变化,结果显示,LE组子宫内膜下血流的搏动指数及血流阻力指数明显低于CC组。而本研究结果表明5组促排卵方案的子宫内膜下血流RI值、子宫动脉血流、卵巢动脉血流PSV、RI值比较差异无统计学意义,可能由于研究例数少,尚未显示出各组指标间的差异。
叶艳娜等[19]比较自然周期组、CC组、LE组、HMG组、CC+HMG组和LE+HMG组宫腔内人工授精的妊娠结局,其中LE+HMG组临床妊娠率为29%(9/ 31),显著高于其余4组。本研究5组促排卵方案的周期妊娠率为LE+HMG组(46.67%)>CC+HMG组(22.64%)>HMG组(22.22%)>CC组(20.00%)>LE组(19.44%),组间比较结果显示,LE+HMG组的妊娠率最高,其余各组差异无统计学意义,这与叶艳娜等[19]的结果一致,表明单独使用LE或CC促排卵妊娠率较低,而添加HMG则可改善成功率,可能由于:①HMG可纠正CC的抗雌激素作用;②HMG可直接促进卵泡发育,增加雌激素水平,从而增加子宫内膜厚度,改善子宫内膜下血流,改善子宫内膜容受性,进而改善成功率;③纠正过低的LH峰值及异常LH峰值分泌,改善黄体的发育和维持[18]。
以上结果表明:①HCG注射日子宫内膜下、子宫及卵巢动脉血流改善有助于提高人工受精的成功率;②对于PCOS患者的促排卵治疗,LE+HMG组子宫内膜血流PSV明显增高,子宫内膜A型血流者明显多于其他4组,子宫内膜容受性最好,妊娠率最高,加上LE口服方便,肌注HMG天数较少,一方面减少患者经济压力,节约患者时间,另一方面也降低因单独使用HMG导致的多胎和卵巢过度刺激综合征的风险,是PCOS非体外受精胚胎移植技术中较好的一个促排卵方案。
本研究结果有助于临床治疗多囊卵巢综合症伴不孕的患者选择合适的促排卵药物,提高卵子质量和子宫内膜容受性,提高供精人工授精的妊娠成功率和不孕症治疗的成功率。
参考文献:
[1] LI R, ZHANG Q, YANG D, et al. Prevalence of polycystic ovary syndrome in women in China: a large community-based study[J]. Hum Reprod, 2013, 28(9): 2562-2569.
[2] SHULMAN LP. The state of hormonal contraception today: benefits and risks of hormonal contraceptives: combined estrogen and progestin contraceptives[J]. Am J Obstet Gynecol, 2011, 205(4): 9-13.
[3] Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome [J]. Fertility Sterility, 2004, 81(1): 19-25.
[4] GONEN Y, CASPER RF. Prediction of implantation by thesonographic appearance of the endometrium during controlled ovarian stimulation for in vitro fertilization[J]. In Vitro Fert Embryo Trand, 1990, 7(3): 146-152.
[5] CHIEN LW, AU HK, CHEN PL, et al. Assessnent of uterine receptivity by the endometrial-subendometrial blood flow distribution pattern in women undergoing in vitro fertilization embryo transrer[J]. Fertil Steril, 2002, 78(2): 245-251.
[6] KIM A, HAN JE, YOON TK, et al. Relationship between endometrial and subendometrial blood flow measured by three-dimensional power doppler ultrasound and pregnancy after intrauterine insemination[J]. Fertility and Sterility, 2010, 94(2): 747-752.
[7] WANG LN, QIAO J, LI R, et al. Role of endometrial blood flow assessment with color doppler energy in predicting pregnancy outcome of IVF-ET cycles [J]. Reproductive Biology and Endocrinology, 2010, 10(8): 122.
[8] HARRISON CL, STEPTO NK, HUTCHISON SK, et al. The impact of intensified exercise training on insulin resistance and fitness in overweight and obese women with and without polycystic ovary syndrome[J]. Clinical Endocrinology, 2012, 76(3): 351-357.
[9]张晓颖,成建萍.多囊卵巢综合征卵巢动脉全脉动周期血流量改变的定量分析[J].第二军医大学学报, 2013, 34(12): 1312-1316.
[10]乐桂容,王迎春,朱桂金,等.经阴道彩色多普勒对多囊卵巢综合征治疗前后子宫卵巢动脉血流动力学的研究[J].同济医科大学学报, 2013, 29(6): 584.
[11] JONES MR, CHUA AK, MENGESHA EA, et al. Metabolic and cardiovascular genes in polycystic ovary syndrome: a candidate-wide association study (CWAS)[J]. Steroids, 2011, 77(4): 317-322.
[12]曲庆兰,殷伟红,王昕荣,等.彩色多普勒超声评价反复种植失败患者子宫动脉血流特点研究[J].中国实用妇科与产科杂志, 2015, 31(2): 145-148.
[13]洪名云,唐志霞,张玲,等.卵巢血流与获卵情况相关性研究[J].生殖与避孕, 2013, 33(6): 418-420.
[14] MISSO ML, WONG JL, TEEDE HJ, et al. Aromatase inhibitors for PCOS: a systematic review and meta-analysis [J]. Human Reproduction Update, 2012, 18(3): 301-312.
[15] LEGRO RS, BRZYSKI RG, DIAMOND MP, et al. Letrozole versus clomiphene for infertility in the polycystic ovary syndrome[J]. New England Journal of Medicine, 2014, 371(2): 119-129.
[16]许咏乐,陈冰,张艳.自然周期和促排卵周期宫腔内人工授精妊娠结局的比较[J].生殖医学杂志, 2013, 22: 616-619.
[17] GOMEZ R, SCHORSCH M, STEETSKAMP J. The effect of ovarian stimulation on the outcome of intrauterine insemination[J]. Archives Gynecology, 2014, 289(1): 181-185.
[18] MOUSTAFA II, MOUSTAFA RA, AZEEM AA. Letrozole versus clomiphene citrate for superovulation in egyptian women with unexplained infertility:a randomized controlled trial[J]. Archives of Gynecology, 2012, 286(6): 88-95.
[19]叶艳娜,陈宇栋,邱绮,等.不同促排卵方案对宫腔内人工授精妊娠结局的影响[J].生殖医学杂志, 2014, 23(11): 884-888.
(童颖丹编辑)
Effects of different ovulation induction schemes on uterine and ovary blood flow in patients with polycystic ovary syndrome*
Li-juan YANG, Jie LI, Mei WANG, Du-juan XU, Dong-lan LI, Fa-ming HU
(Reproductive Hospital of Nanchang, Nanchang, Jiangxi 330000, P.R. China)
Abstract:【Objective】To study the changes of uterine and ovary blood flow in patients with polycystic ovary syndrome (PCOS) before and after different ovulation induction schemes.【Methods】The endometrial thickness, types, the peak systolic blood flow velocity (PSV), resistance index (RI) and other parameters of endometrial blood flow, and uterine and ovary blood flow were measured by vaginal color doppler ultrasound in 150 patients with polycystic ovary syndrome undergoing artificial insemination with donor semen in our hospital on day 2~3, day 16~18 and day 20~25 of natural menstrual cycle and HCG injection day among different ovulation induction schemes (CC, CC+HMG, LE, LE+HMG and HMG). The related parameters were compared between different phases of menstrual cycle, before and after treatment, among different ovulation induction schemes and between pregnancy and nonpregnancy groups.【Results】There was no significant difference in PSV or RI of the uterine and ovarian blood flow in the patients with PCOS during the different periods of natural menstrual cycle. After using ovulation stimulation drugs, endometrial thickness, endometrial type A rate, endometrial blood flow type A rate, PSV of endometrial, ovarian and uterine artery blood flow increasedbook=77,ebook=83significantly while RI of endometrial, ovarian and uterine artery blood flow significantly lowered. Among the five different ovulation induction schemes, PSV of endometrial blood flow, endometrial blood flow type A rate and pregnancy rate in the LE+HMG group were significantly higher than those in other four groups. PSV of endometrial, ovarian and uterine artery blood flow in the pregnant group were significantly higher than those of the nonpregnant group, while RI was significantly lower.【Conclusions】①After using ovulation stimulation drugs, patients with polycystic ovary syndrome can restore ovulation, meanwhile the receptivity of endometrium is also improved. LE+HMG is the best among different ovulation induction schemes.②Improvement of endometrial, uterine and ovary artery blood flow on the HCG injection day can improve the success rate of artificial insemination.
Key words:polycystic ovary syndrome; ovulation stimulation; uterine blood flow; ovarian blood flow; ultrasonic
*基金项目:江西省卫生厅科技计划项目(No:20112045)
收稿日期:2015-03-30
文章编号:1005-8982(2015)23-0076-06
中图分类号:R711.6
文献标识码:B

