钙化性纳米微粒致肾结石大鼠尿液中性粒细胞明胶酶相关脂质运载蛋白、骨桥蛋白及单核细胞趋化蛋白-1的变化及其意义*
王杰,粟宏伟,刘鑫,庞宇,朱智,王春娟(泸州医学院附属医院泌尿外科,四川泸州646000)
钙化性纳米微粒致肾结石大鼠尿液中性粒细胞明胶酶相关脂质运载蛋白、骨桥蛋白及单核细胞趋化蛋白-1的变化及其意义*
王杰,粟宏伟,刘鑫,庞宇,朱智,王春娟
(泸州医学院附属医院泌尿外科,四川泸州646000)
摘要:目的在建立钙化性纳米微粒(CNPs)致大鼠肾结石模型的过程中,检测大鼠不同时间尿液中的中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、骨桥蛋白(OPN)、单核细胞趋化蛋白-1(MCP-1)的含量,初步分析CNPs致肾结石的形成机制。方法利用肾结石患者术中所得结石培养出CNPs,制成CNPs混悬液。20只SD雄性大鼠随机分为CNPs诱石组(A组)和空白对照组(B组)。通过鼠尾静脉注射CNPs感染大鼠,分别于注射后4 h、12 h、24 h、1周、2周及8周用代谢笼收集大鼠尿液,酶联免疫分析法(ELISA)检测大鼠各时间尿液中NGAL、OPN、MCP-1的含量。于注射CNPs后1、2和8周分批次处死大鼠,肾脏组织HE染色后于光镜下观察其结晶的形成及病理改变,对照分析结晶的形成与大鼠尿液中NGAL、OPN、MCP-1含量变化的关系。结果在注射CNPs后4 h,与B组比较,A组的NGAL水平显著增高(P<0.05),2周时A组的OPN、MCP-1水平开始大幅度升高(P<0.05),8周时A组的NGAL、OPN、MCP-1的含量均明显升高(P<0.05)。1周时,A组肾脏组织可见少量肾小管上皮细胞颗粒样变性,肾小管内未见钙盐晶体沉积;2周时,A组肾小管内可见少量钙盐晶体沉积,伴有少数肾小管上皮细胞空泡样变性和颗粒样变性;2周后肾小管内钙盐晶体的沉积量与NGAL、OPN、MCP-1的含量呈正相关;8周时,A组肾小管内可见大量钙盐晶体沉积,伴有广泛肾小管上皮细胞空泡样变性,肾小管上皮细胞的病理改变程度与NGAL的含量呈正相关;B组肾脏组织未见钙盐沉积和病理改变。结论大鼠感染CNPs 4 h后即肾小管上皮细胞开始受到损伤,并且损伤程度与NGAL水平呈正相关。2周后肾小管内开始出现钙盐晶体的黏附和聚集,单核-巨噬细胞和OPN参与其黏附和聚集过程,并且钙盐晶体的沉积量随损伤程度加重也相应增加。
关键词:肾结石;钙化性纳米微粒;中性粒细胞明胶酶相关脂质运载蛋白;骨桥蛋白;单核细胞趋化蛋白-1
近年来,中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase associated lipocalin,NGAL)作为一种早期肾损伤的敏感标志物,在肾损伤相关疾病中有重要的研究价值。骨桥蛋白(osteopontin,OPN)、单核细胞趋化蛋白-1(monocyte chemoat tractant protein-1,MCP-1)的表达与肾小管上皮细胞和钙盐晶体有密切的关系,从而成为肾结石形成机制相关研究领域的热点。本研究在建立钙化性纳米微粒(calcifying nanoparticles,CNPs)致大鼠肾结石模型的过程中,通过监测肾结石形成过程中的NGAL、OPN、MCP-1水平变化,对CNPs致肾结石形成机制进行初步分析。
1 材料与方法
1.1CNPs致大鼠肾结石模型的建立
1.1.1CNPs混悬液的制备术中无菌收集经皮肾镜取石术患者的结石标本,去矿物质、中和、洗涤、研磨、滤器过滤、离心取管底液,10%(体积分数)热灭活γ-FBS的1640培养基培养,置于37℃、5%二氧化碳CO2和95%氧O2条件下培养6~8周,换液30 d/次。倒置相差显微镜下形态学鉴定和Von Kossa染色鉴定,筛选出无污染的标本并制成CNPs混悬液。
1.1.2动物实验分组20只3月龄雄性SD大鼠随机分为两组,每组10只:CNPs诱石组(A组)、空白对照组(B组)。两组大鼠先适应性饲养1周。通过鼠尾静脉注射CNPs感染大鼠。
1.2实验标本的采集
分别于注射CNPs后4 h、12 h、24 h、1周、2周及8周代谢笼收集大鼠尿液,将收集的尿液3 000 r/min离心后及时密封置于-80℃的冰箱保存。于注射CNPs后1、2和8周分批次处死大鼠,切取肾脏,纵向剖开,10%(体积分数)中性甲醛溶液固定,空气注射处死大鼠。
1.3观察指标
对肾脏组织进行石蜡包埋、切片,HE染色后于普通光镜下观察结晶的形成及病理改变。利用酶联免疫分析法(ELISA)测定大鼠不同时间尿液中NGAL、OPN、MCP-1的含量,对照分析结晶的形成与大鼠尿液中NGAL、OPN、MCP-1含量变化的关系。
1.4酶联免疫分析法
①用纯化的大鼠NGAL抗体包被96T微孔板,制成固相抗体;②在酶标包被板上设置标准品孔10个(复孔),加入纯化标准NGAL,按照50%的浓度梯度进行稀释;③分别设空白孔(空白孔不加样品及酶标试剂)、待测样品孔,在酶标包被板上待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl,加样时将样品加于酶标板孔底部,尽量不要触及孔壁,轻轻晃动均匀;④用封板膜封板后置于37℃温育30 min;⑤小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干;⑥每孔加入HRP酶标试剂50μl,空白孔除外;⑦用封板膜封板后置于37℃温育30 min,然后用洗涤液再次按上述方法重复洗涤5次;⑧每孔加入TMB显色剂50μl,轻轻震荡混匀,37℃避光显色15 min;⑨每孔加终止液50μl终止反应,此时蓝色立即转变成黄色;⑩以空白孔调零,450 nm波长依序测量各孔的吸光度(OD值),测定在加终止液后15 min内进行;以标准物的浓度为横坐标,OD值为纵坐标,在坐标纸上绘出标准曲线,根据样品的OD值由标准曲线查出相应浓度,再乘以稀释倍数换算出样品实际浓度。以同样的方法测定不同时间段大鼠尿液中OPN、MCP-1的含量。
1.5统计学方法
采用SPSS 13.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,不同时间段的计量资料数据的组间分析用重复测量的方差分析,相同时间段的组间比较用One-way ANOVA方差分析,两组比较用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1大鼠不同时间段尿液的NGAL水平
与注射CNPs 4 h后大鼠尿液中NGAL水平相比,A组中NGAL水平变化随时间的增加呈上升趋势(P<0.05)。在One-way ANOVA方差分析结果中,与B组比较,A组注射CNPs后4 h的NGAL水平即开始显著增高(P<0.05),A组在其他时间段内的NGAL水平也有不同程度的提高(P<0.05)。见表1。
2.2大鼠不同时间段尿液的OPN水平
与注射CNPs后4 h大鼠尿液中OPN水平比较,2周前A组大鼠尿液中OPN水平呈缓慢升高状态,差异无统计学意义(P>0.05),2周后A组大鼠尿液中OPN水平开始大幅度升高,8周时OPN水平升至最高(P<0.05)。在One-way ANOVA方差分析结果中,与B组比较,A组在注射CNPs后2和8周内OPN水平显著升高(P<0.05)。见表2。
表1 大鼠不同时间段尿液中NGAL水平比较(n=10,±s,ng/L)
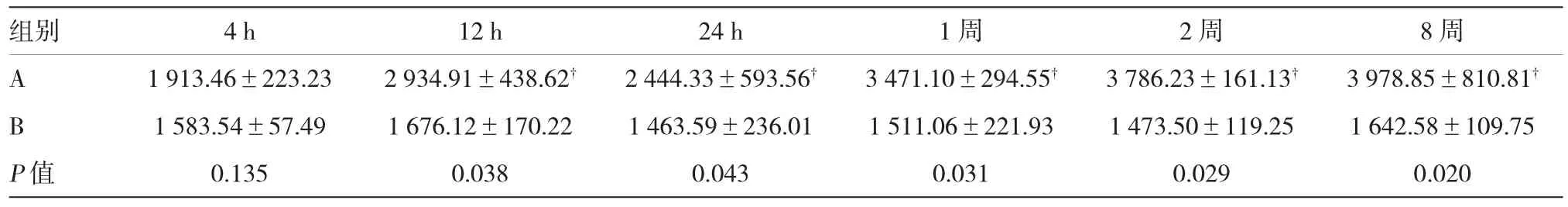
表1 大鼠不同时间段尿液中NGAL水平比较(n=10,±s,ng/L)
注:与注射CNPs后4 h比较,P<0.05
组别 4 h 12 h 24 h 1周 2周 8周A 1 913.46±223.23 2 934.91±438.62 2 444.33±593.56 3 471.10±294.55 3 786.23±161.13 3 978.85±810.81 B 1 583.54±57.49 1 676.12±170.22 1 463.59±236.01 1 511.06±221.93 1 473.50±119.25 1 642.58±109.75 P值 0.135 0.038 0.043 0.031 0.029 0.020
表2 大鼠不同时间段尿液中OPN水平比较(n=10±s,μg/L)

表2 大鼠不同时间段尿液中OPN水平比较(n=10±s,μg/L)
注:与注射CNPs后4 h比较,P<0.05
组别 4 h 12 h 24 h 1周 2周 8周A 18.99±2.22 19.40±6.67 21.86±4.98 22.90±3.53 28.00±2.69 33.35±10.93 B 15.59±2.30 16.79±3.14 14.44±3.69 17.18±4.67 16.40±1.54 18.56±2.93 P值 0.253 0.294 0.131 0.065 0.030 0.027
表3 大鼠不同时间段尿液中MCP-1水平比较(n=10±s,μg/L)
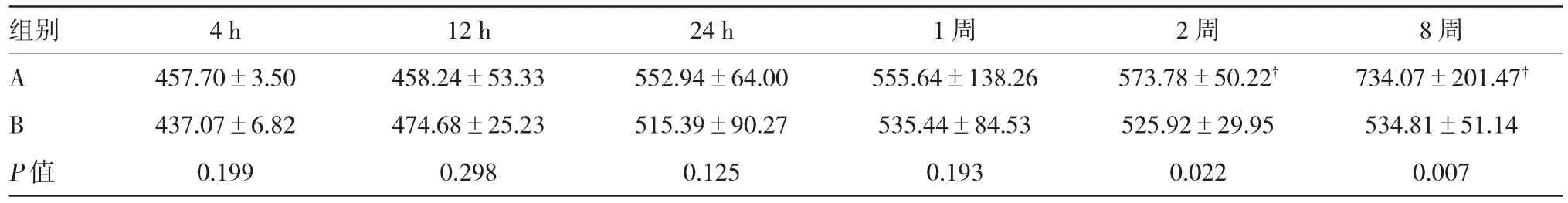
表3 大鼠不同时间段尿液中MCP-1水平比较(n=10±s,μg/L)
注:与注射CNPs后4 h比较,P<0.05
组别 4 h 12 h 24 h 1周 2周 8周A 457.70±3.50 458.24±53.33 552.94±64.00 555.64±138.26 573.78±50.22 734.07±201.47 B 437.07±6.82 474.68±25.23 515.39±90.27 535.44±84.53 525.92±29.95 534.81±51.14 P值 0.199 0.298 0.125 0.193 0.022 0.007
2.3大鼠不同时间段尿液的MCP-1水平
与注射CNPs后4 h大鼠尿液中MCP-1水平比较,2周后A组的MCP-1水平开始大幅度升高,8周时MCP-1水平升至最高(P <0.05)。在One-wayANOVA方差分析结果中,与B组比较,在注射CNPs 后2和8周内A组的MCP-1水平显著升高(P < 0.05)。见表3。
2.4不同时间段大鼠肾脏的镜检结果及其与NGAL、OPN、MCP-1含量的关系
1周时,A组肾脏组织HE染色后未见晶体沉积,可见少量肾小管上皮细胞颗粒样变性(见图1)。2周时,A组肾脏组织HE染色后可见肾小管内少量晶体沉积,伴有少数肾小管上皮细胞空泡样变性和颗粒样变性(见图2)。8周时,A组肾脏组织HE染色后可见肾小管内大量晶体沉积,伴有广泛肾小管上皮细胞空泡样变性(见图3)。B组肾脏组织未见钙盐沉积和病理改变。随肾小管上皮细胞损伤的加重,A组大鼠尿液中NGAL水平也不断升高,可见肾小管上皮细胞的损伤程度与NGAL水平呈正相关。肾小管内钙盐晶体的沉积量随时间的延长而增多(见表4),2周后肾小管内钙盐晶体的沉积量与NGAL、OPN、MCP-1水平呈正相关。
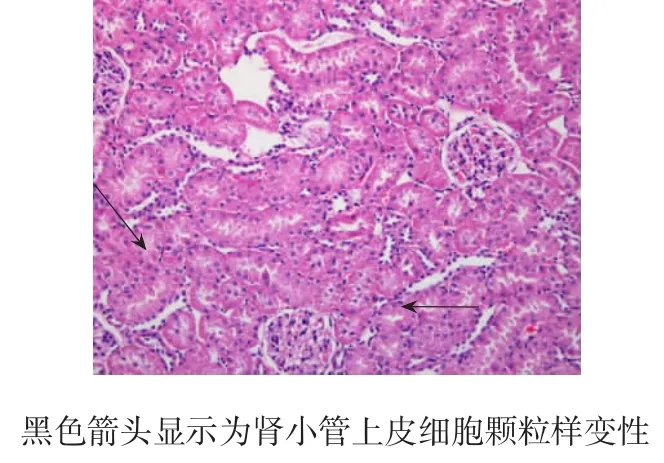
图1 注射CNPs 1周后A组大鼠肾脏组织切片(HE染色×200)
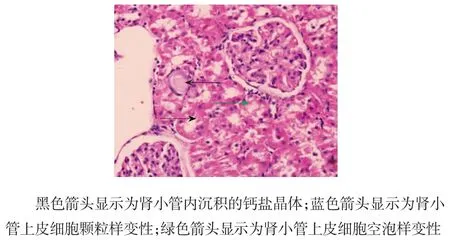
图2 注射CNPs 2周后A组大鼠肾脏组织切片(HE染色×400)
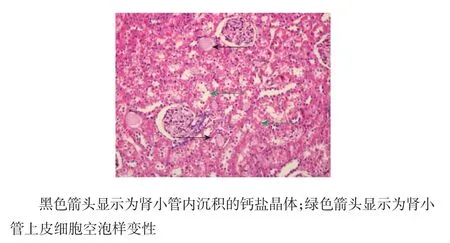
图3 注射CNPs 8周后A组大鼠肾脏组织切片(HE染色×200)
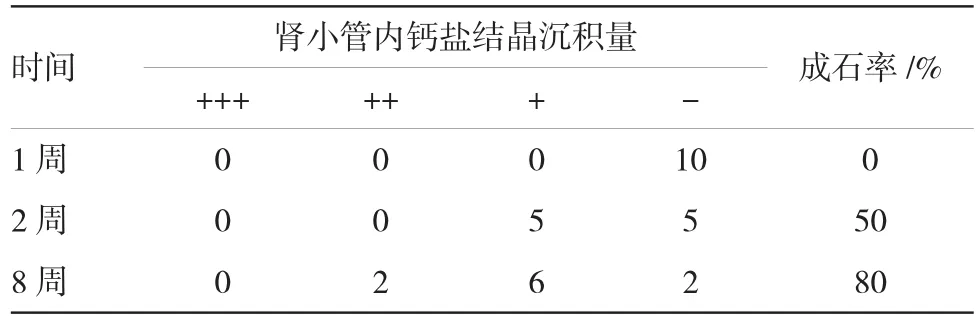
表4 A组大鼠不同时间段肾小管内钙盐结晶沉积量(n=10)
3 讨论
CNPs是一类能够自我复制的纳米级蛋白复合体,具有自我矿化的特性,与许多病理钙化性疾病都有密切联系。有实验研究已成功从肾结石患者的血液、尿液、结石中分离和培养出CNPs[1]。GARCIA 等[2]将培养出的CNPs直接经皮向肾内注射,成功建立CNPs致肾结石大鼠的动物模型。CNPs可能作为肾结石形成过程的矿化中心这一假说开始受到研究人员的广泛关注,也为阐明肾结石的形成机制提供新的探索思路。
有文献报道,受损的肾小管上皮细胞能分泌和产生多种先天性和获得性免疫炎症反应相关生物物质,其中包括NGAL[3-4]。NGAL是一种相对分子量为25 kD的蛋白,属于Lipocalin的家族成员之一。其最开始是在活化的中性粒细胞中被发现,后来在包括肾小管上皮细胞在内的其他类型细胞中也发现有NGAL的表达[5]。NGAL作为肾损伤的早期敏感标志物之一,现已成为肾脏损伤相关疾病的研究焦点。通常在发生肾损伤几天后,肾脏功能丧失近一半时,血肌酐水平才会明显升高[6-7]。而相关文献表明,在出现急性肾损伤早期,血肌酐升还未升高时,即可测得患者血清NGAL水平明显升高[8]。有学者在人类和啮齿类动物的体内实验中发现,在出现肾小管损伤时体内NGAL表达量增加1 000倍,早期即可在血清和尿液中检测到[9]。于澄钒等[10]研究发现,CNPs能损伤肾小管上皮细胞,CNPs作用HK-2细胞6 h后脂质过氧化产物丙二醛含量即开始增加,12 h后细胞出现空泡变性等病理性改变。本实验注射CNPs后4 h,A组(CNPs诱石组)大鼠尿液中的NGAL水平相比B组(空白对照组)即开始升高,且随作用时间延长而不断升高。2周后A组大鼠肾脏病理检查结果显示,少数肾小管内可见钙盐晶体沉积,肾小管上皮细胞可见少量空泡样变性和颗粒样变性。在8周时NGAL水平达到最高,A组大鼠肾脏病理检查结果显示,肾小管上皮细胞可见广泛空泡样变性,肾小管内可见大量钙盐晶体沉积;B组未见钙盐晶体沉积和病理改变。可见肾小管上皮细胞的病理改变程度与NGAL水平呈正相关,2周后肾小管内钙盐晶体沉积量随NGAL水平的升高而增加。这些大鼠体内实验结果再次证实CNPs对肾小管上皮细胞的损伤作用,并且损伤过程伴有NGAL表达水平的升高。
OPN是一种分子量为32 kD的磷酸化糖蛋白,最早在骨组织中被发现,后来在动脉血管平滑肌细胞、胆囊、肾脏等其他组织和器官的钙化部位也发现有OPN的表达。有研究发现,在肾结石大鼠的肾脏内OPN表达水平明显升高[11]。LIESKE等[12]通过猴肾小管上皮细胞和草酸钙晶体共同培养,发现OPN的基因表达明显增强。OPN与肾结石形成机制存在的密切关系使其成为广大学者的研究焦点。于澄钒等[10]发现当CNPs损伤肾小管上皮细胞后,细胞的晶体黏附能力明显增强。当OPN作为一种溶解状态的大分子物质存在于尿液中时,能够抑制草酸钙的成核,减弱其黏附力[13-14]。本实验在注射CNPs后的2周内,A组大鼠尿液的OPN水平升高不明显,肾小管内未见钙盐晶体的沉积。2周后,A组大鼠尿液的OPN水平开始出现大幅度升高,肾小管上皮细胞周围也开始出现钙盐晶体的黏附和聚集,随时间延长,肾小管内晶体沉积量也相应增加。由此提出猜想,钙盐晶体对肾小管上皮细胞的黏附作用刺激其表达OPN,生成的OPN通过与受损的肾小管上皮细胞竞争及与钙盐晶体的结合,从而削弱其对肾小管上皮细胞的黏附力,抑制钙盐晶体的成核。然而KONYA 等[15]在研究中发现,表面固化的OPN能够增强草酸钙的黏附性,促进结石的形成。由此提出假设,OPN与钙盐晶体结合以后形成的复合晶体可能对肾小管形成新的堵塞,再加上肾小管上皮细胞的进行性损伤,新形成的复合晶体无法从肾小管内排出,于是在管内堆砌、聚集,促进结石的形成。同时,增多的钙盐晶体刺激肾小管上皮细胞表达更多的OPN。可见不同蛋白构型的OPN对肾结石的形成过程可能起不同的作用。
MCP-1是属于CC趋化因子亚科的成员之一,其主要作用是发生局部炎症反应时趋化单核细胞和氧自由基进入炎症组织[16]。在正常的肾小管上皮细胞、肾小球内皮细胞内都有微量的表达。当上述细胞受损时,MCP-1的表达水平升高[17-18]。增多的MCP-1可以趋化单核-巨噬细胞进入肾脏炎症组织,通过释放更多的炎症因子来进一步损伤肾小管上皮细胞。在肾结石动物模型的研究中也有发现,钙盐晶体周围有单核-巨噬细胞的包绕[19]。UMEKAWA[20]等在研究中发现,将草酸钙和磷酸钙晶体暴露于肾小管上皮细胞的培养环境中时,能够刺激肾小管上皮细胞增加MCP-1的表达量,且自由基参与此增量调节过程。HABIBZADEGAH-TARI等[21]也通过实验证实,草酸钙晶体能够促进肾小管上皮细胞合成和分泌MCP-1,其产生过程由活性氧自由基介导调节,并且使用抗氧化剂能抑制钙盐沉积。本实验注射CNPs 2周内A组大鼠尿液的MCP-1水平并无明显升高;2周后钙盐晶体开始聚集、黏附肾小管上皮细胞,A组大鼠尿液的MCP-1水平出现大幅度升高;8周后肾小管内出现大量钙盐晶体沉积,A组大鼠尿液的MCP-1水平升至最高。大鼠体内实验证实钙盐晶体能够刺激和促进肾小管上皮细胞表达产生MCP-1,且不断增多的钙盐晶体能刺激肾小管上皮细胞表达更多的MCP-1。HABIBZADEGAH-TARI[21]在其研究结果中还提到使用抗氧化剂能够有效抑制钙盐的沉积,这可能为寻找有效治疗和预防肾结石的方法提供新的探索方向。
参考文献:
[1]粟宏伟,朱永生,邓清富,等.上尿路结石患者血清、尿液、结石中纳米细菌的检测[J].重庆医学, 2013(31): 3754-3756.
[2] GARCIA CE, OLAVI KE, CIFTCIOGLU N, et al. Nanobacteria. An experimental neo-lithogenesis model[J]. Arch Esp Urol, 2000, 53(4): 291-303.
[3] RONCO C. Biomarkers for acute kidney injury: is NGAL ready for clinical use[J]. Crit Care, 2014, 18(6): 680.
[4] KUMAR S, LIU J, MCMAHON AP. Defining the acute kidney injury and repair transcriptome[J]. Semin Nephrol, 2014, 34(4): 404-417.
[5] ZHAO C, OZAETA P, FISHPAUGH J, et al. Structural characterization of glycoprotein NGAL, an early predictive biomarker for acute kidney injury[J]. Carbohydr Res, 2010, 345(15): 2252-2261.
[6] PICKERING JW, JAMES MT, PALMER SC. Acute kidney injuryand prognosis after cardiopulmonary bypass: a meta-analysis of cohort studies[J]. Am J Kidney Dis, 2015, 65(2): 283-293.
[7] ENDRE ZH. Using biomarkers for acute kidney injury: barriers and solutions[J]. Nephron Clin Pract, 2014, 127(1/2/3/4): 180-184.
[8] ANTONUCCI E, LIPPI G, TICINESI A, et al. Neutrophil gelatinase-associated lipocalin (NGAL): a promising biomarker for the early diagnosis of acute kidney injury(AKI)[J]. Acta Biomed, 2014, 85(3): 289-294.
[9] SCHMIDT-OTT KM, MORI K, LI JY, et al. Dual action of neutrophil gelatinase-associated lipocalin[J]. J Am Soc Nephrol, 2007, 18(2): 407-413.
[10]于澄钒,黄晓波,陈亮,等.纳米细菌对肾小管上皮细胞的损伤及晶体滞留的影响[J].北京大学学报(医学版),2010,42(4):436-442.
[11] ALEX M, SAUGANTH PM, ABHILASH M, et al. Astaxanthin modulates osteopontin and transforming growth factor beta1 expression levels in a rat model of nephrolithiasis: a comparison with citrate administration[J]. BJU Int, 2014, 114(3): 458-466.
[12] LIESKE JC, HAMMES MS, HOYER JR, et al. Renal cell osteopontin production is stimulated by calcium oxalate monohydrate crystals[J]. Kidney Int, 1997, 51(3): 679-686.
[13] TSUJI H, SHIMIZU N, NOZAWA M, et al. Osteopontin knockdown in the kidneys of hyperoxaluric rats leads to reduction in renal calcium oxalate crystal deposition[J]. Urolithiasis, 2014, 42 (3): 195-202.
[14] HAMAMOTO S, YASUI T, OKADA A, et al. Crucial role of the cryptic epitope SLAYGLR within osteopontin in renal crys tal formation of mice[J]. J Bone Miner Res, 2011, 26(12): 2967-2977.
[15] KONYA E, UMEKAWA T, IGUCHI M, et al. The role of osteopontin on calcium oxalate crystal formation[J]. Eur Urol, 2003, 43(5): 564-571.
[16] YADAV A, SAINI V, ARORA S. MCP-1: chemoattractant with a role beyond immunity: a review[J]. Clin Chim Acta, 2010, 411(21/22): 1570-1579.
[17] OKAMOTO M, KOHJIMOTO Y, IBA A, et al. Calcium oxalate crystal deposition in metabolic syndrome model rat kidneys[J]. Int J Urol, 2010, 17(12): 996-1003.
[18] LIU Z, WANG T, YANG J, et al. Calcium oxalate monohydrate crystals stimulate monocyte chemoattractant protein-1 and transforming growth factor beta1 expression in human renal epithelial cells[J]. Mol Med Rep, 2012, 5(5): 1241-1244.
[19] KHAN SR. Reactive oxygen species as the molecular modulators of calcium oxalate kidney stone formation: evidence from clinical and experimental investigations[J]. J Urol, 2013, 189(3): 803-811.
[20] UMEKAWA T, CHEGINI N, KHAN SR. Increased expression of monocyte chemoattractant protein-1 (MCP-1) by renal epithelial cells in culture on exposure to calcium oxalate, phosphate and uric acid crystals[J]. Nephrol Dial Transplant, 2003, 18(4): 664-669.
[21] HABIBZADEGAH-TARI P, BYER KG, KHAN SR. Reactive oxygen species mediated calcium oxalate crystal-induced expression of MCP-1 in HK-2 cells[J]. Urol Res, 2006, 34(1): 26-36.
(申海菊编辑)
Changes in urine neutrophil gelatinase-associated lipocalin, osteopontin and monocyte chemoattractant protein-1 in rats with renal calculi induced by calcified
nanoparticles and their significance*
Jie WANG, Hong-wei SU, Xing LIU, Yu PANG, Zhi ZHU, Chun-juan WANG
(Department of Urology, the Affiliated Hospital of Luzhou Medical College, Luzhou, Sichuan 646000, P.R. China)
Abstract:【Objective】To detect the content of neutrophil gelatinase-associated lipocalin (NGAL), osteopontin (OPN) and monocyte chemoattractant protein-1 (MCP-1) in rat urine in different periods during the process of establishment of renal calculus rat model induced by calcified nanoparticles (CNPs) so as to analyzebook=2,ebook=8the mechanism of kidney stone formation induced by CNPs.【Methods】Calcified nanoparticles were extracted and cultivated from clinically diagnosed patients with nephrolithiasis. Twenty adult male SD rats were randomized into 2 groups (10 in each group): group A was given an intravenous injection of calcified nanoparticles while group B was used as normal control. Urine of rats was collected by using metabolic cages in different periods after injection of CNPs. The content of NGAL, OPN and MCP-1 in rat urine was detected using ELISA. Rats were sacrificed in different periods. The kidneys were examined for pathology.【Results】In the group A, NGAL began to increase 4 hours after injection of CNPs (P < 0.05); OPN and MCP-1 began to largely increase 2 weeks after injection of CNPs (P< 0.05); NGAL, OPN and MCP-1 rose more significantly 8 weeks after injection of CNPs (P< 0.05) compared to those in the group B. At the 1st week, histopathological studies of the renal tissue of the group A showed granular degeneration of a small amount of renal tubular epithelial cells without renal tubular crystallization. At the 2nd week, histopathological studies revealed small quantities of calcium crystals in the renal tubules accompanied with vacuolar degeneration and granular degeneration of a few renal tubular epithelial cells. After 2 weeks, the deposition of calcium crystals in the renal tubules was positively related to the levels of NGAL, OPN and MCP-1. At the 8th week, histopathological changes included a large number of calcium crystals in the renal tubules and extensive vacuolar degeneration of renal tubular epithelial cells which were positively correlated to the content of NGAL. No calcium crystal deposition or pathological changes could be seen in the renal tissue of group B.【Conclusions】Calcified nanoparticles begin to injure renal tubular epithelial cells 4 hours after injection of CNPs, and NGAL level is positively correlated with the degree of injury. The adhesion and aggregation of calcium crystals begin to appear in the renal tubules 2 weeks after injection of CNPs, and the crystals increase with the increased severity of renal tubular injury. Mononuclear macrophage and OPN are involved in the adhesion and aggregation process.
Key words:renal calculus; calcified nanoparticle; neutrophil gelatinase-associated lipocalin; osteopontin; monocyte chemoattractant protein-1
[通信作者]粟宏伟;E-mail:ximi47325@163.com
*基金项目:四川省科技厅资助项目(No:14JC0105);四川省卫生厅资助项目(No:100288)
收稿日期:2015-04-14
文章编号:1005-8982(2015)23-0001-06
中图分类号:R692.4
文献标识码:A

