晚期胃肠道神经内分泌癌患者治疗和生存的相关预测及预后因素分析*
孟曼,夏云红,黄震琪,姚荣杰,高明珠(.安徽省合肥市第二人民医院肿瘤内科,安徽合肥0046;.安徽医科大学第一附属医院血液科,安徽合肥00;.安徽医科大学第二附属医院肿瘤科,安徽合肥060)
晚期胃肠道神经内分泌癌患者治疗和生存的相关预测及预后因素分析*
孟曼1,夏云红1,黄震琪2,姚荣杰1,高明珠3
(1.安徽省合肥市第二人民医院肿瘤内科,安徽合肥230046;2.安徽医科大学第一附属医院血液科,安徽合肥230022;3.安徽医科大学第二附属医院肿瘤科,安徽合肥230601)
摘要:目的确定晚期胃肠道神经内分泌癌(GI-NEC)预测及预后标志。方法选取2003~2012年15个医疗机构数据库采集的237例GI-NEC患者临床数据,其中196例接受姑息化疗(CT),41例仅接受最佳支持治疗(BSC)。对患者年龄、性别、组织病理学、应答特征和存活率等进行回顾性分析。结果CT治疗组患者中位数生存期为10个月,而BSC治疗组仅为1个月。一线化疗的有效率为30%,且34%患者病情稳定。ROC分析结果显示,肿瘤增值指数(Ki-67)<55%是与有效率相关的最佳临界值。当Ki-67<55%时,治疗有效率(16%)较Ki-67≥55%患者低(41%),但前者生存期(15个月)高于后者(11个月),差异有统计学意义(P=0.000)。统计分析结果表明,体能状态(PS)下降、原发性结直肠癌、血小板(Plt)水平和乳酸脱氢酶(LDH)活力升高是患者生存的负性预后因素。结论PS下降、原发性结直肠癌、Plt水平和LDH活力升高是GI-NEC患者生存的重要负性预后因素。及时进行化疗可提高患者生存期。当患者Ki-67<55%时,铂化疗的有效率降低,但患者生存期延长。
关键词:胃肠道;神经内分泌癌;化疗;预测;预后
肺外神经内分泌癌(extrapulmonary neuroendocrine carcinoma,EP-NEC)是一种低分化或高级别(Ki-67>20%)的恶性肿瘤[1-2],常见于胃肠道。据报道,胃肠道神经内分泌癌(gastrointestinal neuroendocrine carcinoma,GI-NEC)占EP-NEC的35%~55%,其中30%患者无法确定其原发性部位[3-4]。由于低分化神经内分泌癌(neuroendocrine carcinoma,NEC)的异质性特征[5],GI-NEC的发病机制较为复杂,其发生、发展及治疗一直是国内外的研究重点。
GI-NEC在临床上较为罕见,如在结直肠和胰腺部位,高度分化的NEC仅占各类癌症的1%左右[6-7],限制研究中的临床样本数,同时GI-NEC在诊断时会发生转移,使得GI-NEC相关预测及预后因素一直未得到确定[8]。与其他高度分化的胃肠胰神经内分泌癌(gastro-entero pancreatic neuroendocrinetumours,GEP-NET)相比,GI-NEC预后差,生存周期短[4]。由于GI-NEC的临床表现与小细胞肺癌相似,后者对顺铂和依托泊苷敏感,因此以铂制剂为基础的化疗被广泛应用于GI-NEC[1,9]。研究该治疗对GINEC患者的影响以及对GI-NEC发生、发展相关指标的分析,对GI-NEC的治疗以及判断预后有重要的意义。本研究对晚期GI-NEC患者的临床资料进行回归分析,探讨不同治疗方法对患者生存的影响,为晚期GI-NEC的预测及预后因素提供科学参考。
1 资料与方法
1.1临床资料
选取2003~2012年15个医疗机构数据库采集的237例GI-NEC患者临床数据,年龄20~87岁,平均(59.6±11.2)岁。其中接受姑息化疗(palliative chemotherapy,CT)的患者196例,平均年龄(56.7± 9.8)岁;接受最佳支持治疗(best supportive care,BSC)的患者41例,平均年龄(71.2±13.8)岁。参照MITRY等[10]的方法,对NEC进行分类诊断,仅经诊断明确为晚期GI-NEC的病例被用于本研究分析。
对流行病学、生化、肿瘤增殖指数(Ki-67)和患者存活等统计数据进行回顾性分析。依据病理学报告,将GI-NEC从形态学上分为小细胞和非小细胞。依据放射学检查报告并参照实体瘤疗效评价标准(response evaluation criteria in solid tumours,RECIST)1.1,对CT和BSC疗效进行评估。本研究获得医学伦理委员会批准。
1.2统计学方法
采用SPSS 20.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,对类别变量用χ2检验,对连续变量进行秩和(Wilcoxon)或t检验。随机选取45例化疗病例,以ROC曲线分析反应率的Ki-67临界值,以Kaplan–Meier方法和Cox回归分析方法对化疗患者的存活状况进行分析,采用多因素逐步回归分析以确定相关预测因素,P<0.05为差异有统计学意义。
2 结果
2.1病理特征
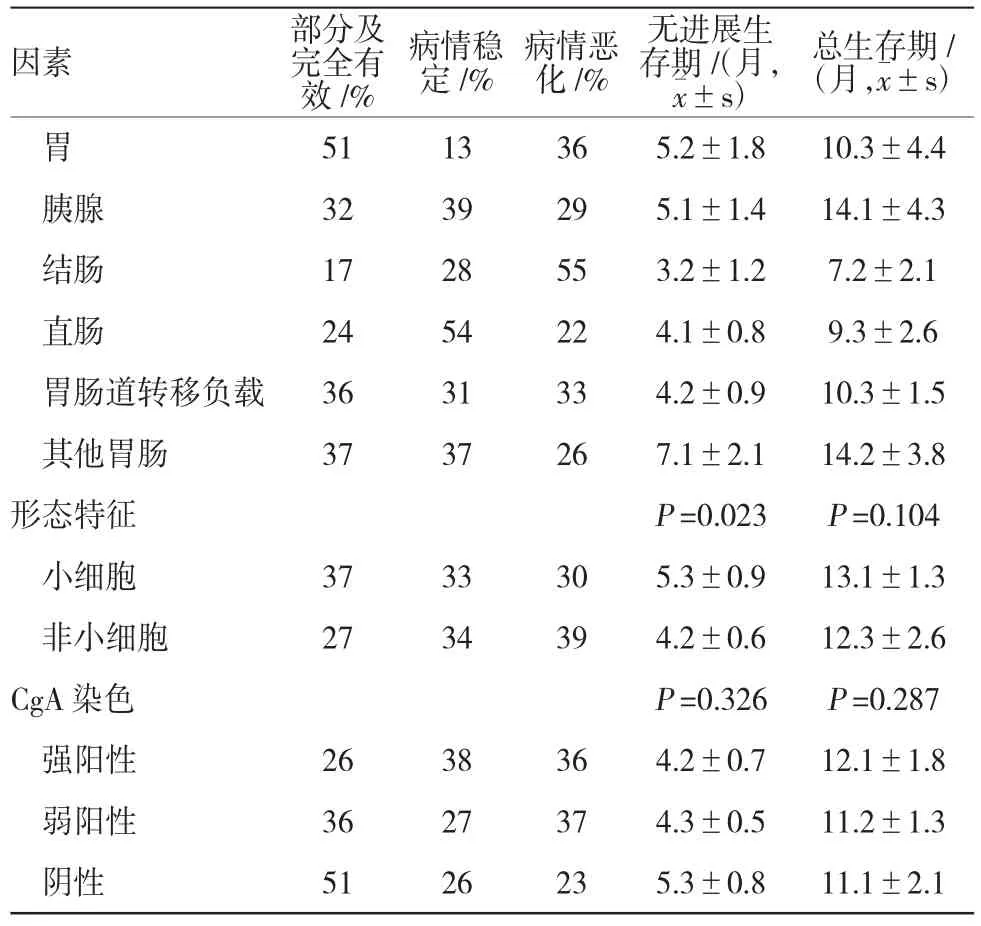
本组病例中,男女患者比例相近。不同性别的CT、BSC治疗比例比较,差异无统计学意义(P>0.05)。年龄和体能状态(performance status,PS)是影响CT 和BSC治疗选择的重要因素,差异有统计学意义(P= 0.000)。在所有病例中,196例(82.7%)接受CT治疗,41例(17.3%)接受BSC治疗。接受BSC治疗患者的年龄、白细胞计数(white blood cell,WBC)和C反应蛋白(C-reactive protein,CRP)水平高于接受CT治疗的患者,但PS和嗜铬粒蛋白A(chromogranin A,CgA)染色强度低于接受CT治疗的患者。在原发性癌中,结肠癌切除比例最高(78%),而食管癌(20%)、胃癌(28%)、胰腺癌(16%)和直肠癌(25%)比例较少。见表1。
211个患者中,小细胞NEC为112例(53.1%),非小细胞NEC为99例(46.9%),其中小细胞NEC主要发生于食管(75%)和直肠(65%),而非小细胞NEC则在结肠(70%)较常见。统计发现,食管癌(66%)、结肠癌(71%)和直肠癌(81%)中Ki-67通常>55%,仅30%肝癌中Ki-67≥55%。CT与BSC组的年龄、PS、CgA染色强度、WBC和CRP水平比较,差异有统计学意义(P<0.05)。见表1。

表1 NEC患者的病理特征

续表1
2.2患者生存预后因素分析

表2 GI-NEC患者的生存预后因素分析及一线化疗对其影响
续表2
一线化疗有效率为30%,病情稳定的比例为34%,病情恶化的比例为36%。非化疗患者的中位数生存期为1个月,而化疗患者为10个月。ROC曲线分析表明,Ki-67的最佳临界值是55%。Ki-67<55%患者的总生存期(overall surviva,OS)(15个月)长于Ki-67≥55%患者(11个月),但前者化疗有效率(16%)低于后者(41%)。PS是影响化疗效果的重要因素,当PS=2时,化疗有效率(23%)低于PS=0和1的患者,同时患者病情稳定(15%)或恶化(62%)比例升高。原发性结肠癌患者的OS最短(7个月),而胰腺癌患者最长(14个月)。组织学形态和CgA染色强度对患者生存期无显著影响,差异无统计学意义(P> 0.05)。见表2。
对患者生存相关预后因素进行Cox回归,结果表明PS、原发性肿瘤部位、血液中的血小板计数(platelet,Plt)和乳酸脱氢酶(lactate dehydrogenase,LDH)活力是患者存活的重要预后因素(P=0.000、0.005、0.000和0.004)。见表3。
2.3化疗有效率评价及患者生存期
一线治疗分为含顺铂/依托泊苷(Cisplatin/e toposide,Cis/E)100例、卡铂/依托泊苷(Carboplatin/ etoposide,Carb/E)52例、卡铂/依托泊苷/长春碱(Carboplatin/etoposide/vincristine,Carb/E/V)22例,其他药物治疗22例。化疗1~15个周期,平均4个周期,其中24%患者仅接受1、2个周期的化疗。统计分析表明,以铂为基础的不同化疗方案对患者的OS比较,差异无统计学意义(P>0.05)。化疗部分有效或病情稳定的患者平均生存期为15个月,此时一线化疗的疗效最佳;而化疗后出现病情恶化的患者平均生存期仅为6个月。见表4。
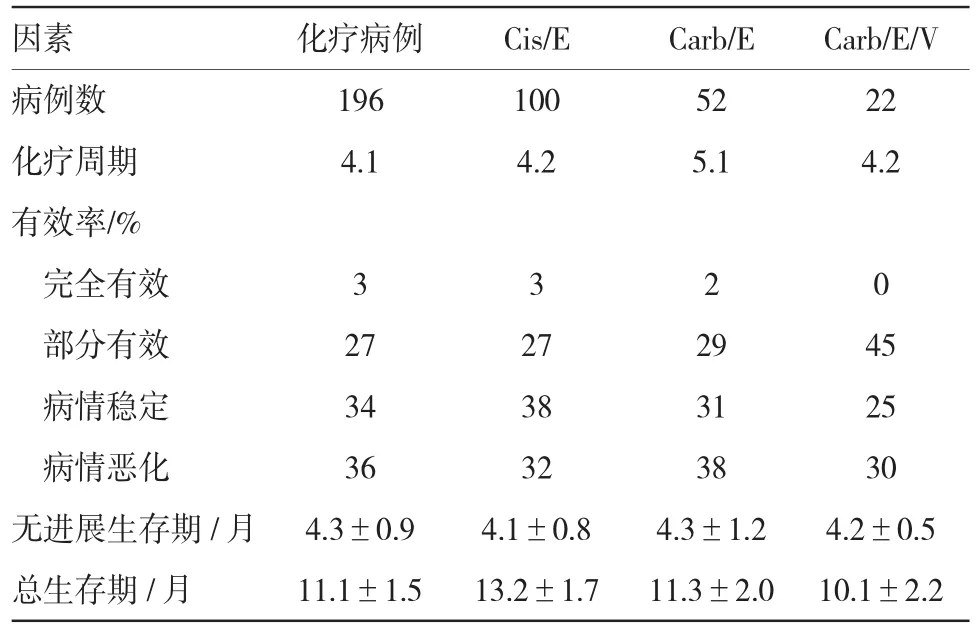
表4 不同化疗方案的一线化疗有效率及其对GI-NEC患者生存的影响
2.4GI-NEC患者化疗后生存率

Ki-67<55%的GI-NEC患者累积生存率(17%~80%)在化疗后高于Ki-67≥55%患者(3%~78%)(见附图)。随着PS值的升高,患者化疗后的生存率逐渐降低。原发性肿瘤部位是影响患者生存的重要因素,胰腺癌患者在化疗后的生存率(19%~74%)高于结肠癌(2%~63%)和直肠癌患者(2%~85%)。而以铂为基础的不同药物联合化疗后,患者生存率相近。

附图 GI-NEC患者化疗后生存率统计
3 讨论
近年来,GI-NEC发病率呈逐年增加的趋势[11-12],因为该病的发病率较低,临床样本数较少,以及GINEC的异质和转移特性,导致对GI-NEC的研究不足,不利于临床上对GI-NEC发生、发展的预测及患者生存的预后分析。本研究从数据库筛选出的有关数据,并回顾性分析GI-NEC治疗和患者生存相关因素,阐明Ki-67、PS、原发性肿瘤部位等决定因素在GI-NEC预测和预后分析中的作用,为GI-NEC治疗的临床应用及理论研究提供科学参考。
晚期GI-NEC是一种恶性疾病,可在短时间内迅速恶化[13]。因此,及时预测GI-NEC的变化对该病治疗时机的选择具有重要意义。本研究结果表明,PS是 GI-NEC患者生存的重要预后因素。当患者PS=2时,CT疗效显著降低,化疗有效率和患者病情稳定比例分别降低至23%和15%,而出现病情恶化的患者比例高达62%,远高于PS=0和1。对患者生存率分析表明,PS=2时,患者PFS和OS显著低于其他PS组,且患者生存率在化疗后12个月内即降至5%以下。可见PS是反映GI-NEC变化的重要因素,当PS=2时,GI-NEC患者并不能受益于化疗方法。
SHAYAN等[14]报道,原发性肿瘤部位是癌症转移的关键因素之一。BOISEN等[15]报道,原发性肿瘤部位能够影响贝伐单抗对转移性结直肠癌的疗效。可见,原发性肿瘤部位是癌症发生、发展及相关治疗的重要作用因素。本研究中,原发性肿瘤主要位于胰腺和肠部位。胰腺癌患者中接受CT治疗的比例最高,同时患者PFS、OS和生存率最佳,而原发性结直肠癌患者生存较差。Ki-67是进行癌症分类的重要指标,其水平被作为乳腺癌[16]、前列腺癌[17]和非小细胞肺癌等[18]疾病的重要预后因素。本研究对GINEC中Ki-67水平的分析表明,Ki-67<55%是影响GI-NEC化疗效果的最佳临界值。对Ki-67<55%的GI-NEC患者,其化疗有效率(16%)低于Ki-67≥55%的患者(41%),但前者PFS、OS和化疗后生存率高于后者,说明以铂为基础的化疗可能不是Ki-67< 55%时GI-NEC患者的最佳治疗手段,此类患者生存率较高可能与癌细胞增殖率较低有关。
化疗是癌症治疗的重要手段,其中顺铂联合依托泊苷是治疗NEC的常用方法[1]。近年来,卡铂因毒性低和对肾功能损害小,逐渐替代顺铂对上皮性卵巢癌[19]、膀胱癌[20]和非小细胞肺癌等[21]晚期癌症的治疗。本研究结果显示,GI-NEC患者平均化疗4个周期,化疗有效率为30%。与BERNICK等[22]的研究相比,本研究中患者化疗后的生存率更低。比较3种联合化疗方式,卡铂替换顺铂后的治疗效果没有显著改善,而其与长春碱联合(Carb/E/V)治疗时,化疗有效率(45%)明显提高,表明Carb/E/V可能是一种治疗NEC的较佳方法。
本研究结果显示,GI-NEC的发生、发展不仅与肿瘤特征有关,而且与机体中LDH、CRP水平变化相关。本研究中,LDH和Plt是GI-NEC预测及预后相关的重要因素。这可能与肿瘤引发机体出现炎症反应[23]和缺氧症状[24]有关。
综上所述,晚期GI-NEC的预后较差,应及早进行化疗治疗。PS下降、原发性结直肠癌、Plt和LDH水平的升高是GI-NEC患者生存的重要负性预后因素。Ki-67<55%是判断GI-NEC化疗效果的最佳临界值,在此范围内,以铂为基础的化疗效果降低,但患者生存期明显延长。研究虽然证实与GI-NEC相关多种预测及预后因素,但该因素与GI-NEC的关联机制,以及如何调控这些因素以改善化疗的治疗效果仍需进一步研究。
参考文献:
[1] FAZIO N, SPADA F, GIOVANNINI M. Chemotherapy in gastroenteropancreatic (GEP) neuroendocrine carcinomas (NEC): a critical view[J]. Cancer Treatment Reviews, 2013, 39(3): 270-274.
[2] HAN G, WANG Z, GUO X, et al. Extrapulmonary small cell neuroendocrine carcinoma of the paranasal sinuses: a case report and review of the literature [J]. Journal of Oral and Maxillofacial Surgery, 2012, 70(10): 2347-2351.
[3] KLOPPEL G, SCHERUB H. Neuroendokrine tumoren des magens [J]. Der Pathologe, 2010, 31(3): 182-187.
[4] KOUMARIANOU A, SCHATZELLI E, BOUTZIOS G, et al. Current concepts in the diagnosis and management of poorly differ entiated gastrointestinal neuroendocrine carcinomas[J]. Endokrynologia Polska, 2013, 64(1): 60-62.
[5] SORBYE H, STROSBERG J, BAUDIN E, et al. Gastroenteropancreatic high-grade neuroendocrine carcinoma[J]. Cancer, 2014, 120(18): 2814-2823.
[6] BOYAR CETINKAYA R, VATN M, AABAKKEN L, et al. Survival and prognostic factors in well-differentiated pancreatic neuroendocrine tumors[J]. Scandinavian Journal of Gastroenterology, 2014, 49(6): 734-741.
[7] SMITH JD, REIDY DL, GOODMAN KA, et al. A retrospective review of 126 high-grade neuroendocrine carcinomas of the colon and rectum[J]. Annals of Surgical Oncology, 2014, 21(9): 2956-2962.
[8] KLIMSTRA DS. Pathology reporting of neuroendocrine tumors: essential elements for accurate diagnosis, classification, and staging[J]. Seminars in Oncology, 2013, 40(1): 23-36.
[9] SMITH J, REIDY-LAGUNES D. The management of extrapulmonary poorly differentiated (high-grade) neuroendocrine carcinomas[J]. Seminars in Oncology, 2013, 40(1): 100-108.
[10] MITRY E, BAUDIN E, DUCREUX M, et al. Treatment of poorly differentiated neuroendocrine tumours with etoposide and cisplatin[J]. British Journal of Cancer, 1999, 81(8): 1351-1355.
[11] CHO MY, KIM JM, SOHN JH, et al. Current trends of the incidence and pathological diagnosis of gastroenteropancreatic neuroendocrine tumors (GEP-NETs) in Korea 2000-2009: multicenter study [J]. Cancer Research and Treatment, 2012, 44(3): 157-165.
[12] TSIKITIS VL, WERTHEIM BC, GUERRERO MA. Trends of incidence and survival of gastrointestinal neuroendocrine tumors in the United States: a seer analysis[J]. Journal of Cancer, 2012, 3: 292-302.
[13] JUNG M, KANG B, PARK JS, et al. Prognostic value of total lesion glycolysis from 18F-fluorodeoxyglucose positron emission tomography patients with gastric neuroendocrine carcinoma[J]. Cancer Research, 2014, 74(19): 4662-4662.
[14] SHAYAN R, INDER R, KARNEZIS T, et al. Tumor location and nature of lymphatic vessels are key determinants of cancer metastasis[J]. Clinical Experimental Metastasis, 2013, 30(3): 345 -356.
[15] BOISEN MK, JOHANSEN JS, DEHLENDORFF C, et al. Primary tumor location and bevacizumab effectiveness in patients with metastatic colorectal cancer[J]. Annals of Oncology, 2013, 24(10): 2554-2559.
[16] INWALD EC, KLIKHAMMER-SCHALKE M, HOFSTADTER F, et al. Ki-67 is a prognostic parameter in breast cancer patients: results of a large population-based cohort of a cancer registry[J]. Breast Cancer Research and Treatment, 2013, 139(2): 539-552.
[17] FISHER G, YANG ZH, KUDAHETTI S, et al. Prognostic value of Ki-67 for prostate cancer death in a conservatively managed cohort[J]. British Journal of Cancer, 2013, 108(2): 271-277.
[18] JAKOBSEN JN, SORENSEN JB. Clinical impact of ki-67 labeling index in non-small cell lung cancer[J]. Lung Cancer, 2013, 79(1): 1-7.
[19] MERTENS LS, MEIJER RP, KERST JM, et al. Carboplatin based induction chemotherapy for nonorgan confined bladder cancer-a reasonable alternative for cisplatin unfit patients [J]. The Journal of Urology, 2012, 188(4): 1108-1114.
[20] BAMIAS A, SOTIROPOULOU M, ZAGOURI F, et al. Prognostic evaluation of tumour type and other histopathological characteristics in advanced epithelial ovarian cancer, treated with surgery and paclitaxel/carboplatin chemotherapy: cell type is the most useful prognostic factor[J]. European Journal of Cancer, 2012, 48(10): 1476-1483.
[21] WANG L, WU S, OU G, et al. Randomized phaseⅡstudy of concurrent cisplatin/etoposide or paclitaxel/carboplatin and thoracic radiotherapy in patients with stageⅢnon-small cell lung cancer[J]. Lung Cancer, 2012, 77(1): 89-96.
[22] BERNICK PE, KLIMSTRA DS, SHIA J, et al. Neuroendocrine carcinomas of the colon and rectum[J]. Diseases of the Colon Rectum, 2004, 47(2): 163-169.
[23] MCMILLAN DC. The systemic inflammation-based glasgow prognostic score: a decade of experience in patients with cancer [J]. Cancer Treatment Reviews, 2013, 39(5): 534-540.
[24] ZHANG ZG, ZHANG QN, WANG XH, et al. Hypoxia-inducible factor 1 alpha (HIF-1α) as a prognostic indicator in patients with gastric tumors: a meta-analysis [J]. Asian Pac J Cancer Prev, 2013, 14(7): 4195-4198.
(申海菊编辑)
Predictive and prognostic factors associated with treatment and survival of patients with advanced gastrointestinal neuroendocrine carcinoma*
Man MENG1, Yun-hong XIA1, Zhen-qi HUANG2, Rong-jie YAO1, Ming-zhu GAO3
(1. Department of Oncology, the Second People's Hospital, Hefei, Anhui 230046, P.R. China; 2. Department of Hematology, the First Affiliated Hospital of Anhui Medical University, Hefei, Anhui 230022 P.R. China; 3. Department of Oncology, the Second Affiliated Hospital of Anhui Medical University, Hefei, Anhui 230601, P.R. China)
Abstract:【Objective】To determine the predictive and prognostic factors of advanced gastrointestinal neuroendocrine carcinoma (GI-NEC).【Methods】GI-NEC related data of 237 patients were collected from 15 institutional databases from2003 to 2012. Among the 237 patients, 191 patients were treated with chemotherapy (CT) and 41 patients were treated with best supportive care (BSC). Then a retrospective observational cohort multi -center study was conducted on the data such as age, gender, histopathology, response character and survival rate.【Results】The patients treated with CT had a median survival of 10 months, while that in the BSC treated patients was 1 month. The response rate to first-line CT was 30% and 34% of these patients had stable GI-NEC. According to the analysis of ROC curve, Ki-67 < 55% was considered as the best cut-off value related with the response rate. In comparison with patients with Ki-67≥55%, those with Ki-67 < 55% had a lower response rate (16% vs 41%) and a longer survival (15 months vsbook=41,ebook=4711 months) with significant differences (P< 0.001). Statistic results demonstrated that poor performance status, primary colorectal cancer and elevated levels of platelet and LDH in blood were the most important prognostic factors negatively related with survival of GI-NEC patients.【Conclusions】Poor performance status, primary colorectal cancer and elevated levels of platelet and LDH in blood are the most important negative prognostic factors related with survival of GI -NEC patients. An immediate chemotherapy is suggested for GI -NEC patients. Ki-67 < 55% could lower the response rate but prolong the survival of patients.
Key words:gastrointestinal; neuroendocrine carcinoma; chemotherapy; predictive; prognostic
[通信作者]高明珠,E-mail:gaomingzhu001@126.com
*基金项目:国家自然科学基金(No:81472331)
收稿日期:2015-03-19
文章编号:1005-8982(2015)23-0040-06
中图分类号:R735.2;R453.9
文献标识码:A

