肥胖相关微RNA的研究进展
张乃键,赵 超(综述),赵亚萍※(审校)
(1.蚌埠医学院研究生部,安徽 蚌埠 233030; 2.解放军第八二医院检验科,江苏 淮安 223001)
肥胖相关微RNA的研究进展
张乃键1,2△,赵超2(综述),赵亚萍2※(审校)
(1.蚌埠医学院研究生部,安徽 蚌埠 233030; 2.解放军第八二医院检验科,江苏 淮安 223001)
摘要:肥胖与高血压、高脂血症、心脑血管疾病、2型糖尿病以及癌症的发生、发展密切相关,严重威胁着人类的健康和生命,已成为全世界的公共卫生问题。肥胖的确切发病机制目前尚不清楚。最近越来越多的研究证实,微RNA (miRNA)参与代谢性疾病的多种生物过程。该文总结分析了脂肪细胞分化过程中miRNA表达谱的变化,miRNA在脂肪细胞分化以及肥胖相关胰岛素抵抗中所起的作用及其机制。
关键词:肥胖;脂肪细胞;胰岛素抵抗;细胞外miRNA
肥胖是世界上最常见的代谢性疾病之一,由于其与2型糖尿病、心血管疾病和某些癌症有关而被列为公共健康的一大杀手。人类对肥胖的研究历时已久,一般认为肥胖是由遗传和环境双重因素决定的,但目前为止,肥胖的确切发病机制尚不清楚。作为2002年Science杂志十大科技突破第一名的微RNA(microRNA,miRNA),通过与靶基因3′-非翻译区(3′-UTR)互补配对结合,起到降解或抑制靶信使RNA翻译的作用,进而调节生物体生长、发育、疾病发生过程相关基因的表达,在生物的发育时序调控和疾病的发生中起非常重要的作用[1]。近年来有报道证实,miRNA是脂肪分化和胰岛素敏感性的重要调控因子,在肥胖机体中表达异常[2]。因此,miRNA在成脂分化、肥胖中的作用越来越引人注目。现就肥胖相关miRNA的研究进展予以综述。
1与脂肪分化相关的miRNA
已有研究证实,在动物和人类脂肪细胞分化过程中存在大量miRNA表达的变化,miRNA通过促进和抑制脂肪细胞分化,参与肥胖的发生过程[3-4]。
1.1脂肪细胞分化过程中miRNA表达的变化2004年,Esau等[5]应用miRNA 芯片技术研究了人前体脂肪细胞和成熟脂肪细胞的miRNA表达谱,从检测到的254种miRNA中筛选出22种差异表达的miRNA。2006年,Kajimoto等[6]构建了3T3-L1前体脂肪细胞及诱导分化后第1日和第9日,3个阶段的miRNA文库,筛选出80种差异表达miRNA,结合文献报道的22种miRNA,采用Northern blot技术进行分析验证,发现miR-183、miR-224、miR-422b在成熟脂肪细胞中表达明显上调,而miR-181a、miR-182表达则显著降低;另外,13种上调的miRNA(表1)在诱导分化后的第1日即出现表达改变,提示可能仅与3T3-L1诱导分化过程中的接触抑制有关。Xie等[7]采用miRNA芯片检测3T3-L1前体脂肪细胞成脂分化过程中miRNA的表达变化,发现8个miRNA表达显著上调,4个表达下调(表1);然后,他们采用反转录-聚合酶链反应技术检测小鼠体内前体脂肪细胞和成熟脂肪细胞上述12个miRNA的表达情况,变化趋势与体外实验完全一致;另外,他们还发现miR-422b、miR-148a、miR-107、miR-103、miR-30c、miR-30a-5p、miR-143这些在成脂过程中表达上调的miRNA,在肥胖状态下的脂肪组织中表现为下调,而在成脂过程中表达下调的miR-222、miR-221也出现了相反的结果,分析可能与脂肪组织的局部慢性炎症环境有关。2010年,Qin等[8]采用miRNA基因芯片检测发现在3T3-L1前体脂肪细胞和成熟脂肪细胞中差异表达的26个miRNA中17个呈现上调结果,9个下调。综合分析上述结果显示,在Kajimoto等[6]筛选的21种3T3-L1前体脂肪细胞和Esau等[5]所检测出的22种人前体脂肪细胞诱导分化过程中差异表达的miRNA,只有miR-143在两种细胞系中同时出现变化(表1),提示与脂肪细胞分化相关的miRNA可能存在细胞系和种间差异。Xie等[7]和Qin等[8]虽同样采用miRNA基因芯片测定3T3-L1前脂肪细胞成脂分化过程miRNA的表达变化情况,但结果亦不完全一致,分析除了与不同时期的miRNA芯片容量不同有关外,细胞培养过程中培养条件的差异也可能会对miRNA的表达产生影响。尽管如此,miRNA芯片技术为细胞中检测多种miRNA 提供了理想的手段,在脂肪细胞分化相关的miRNA研究中发挥重要作用,为进一步探讨在脂肪分化过程中具有重要调控作用的miRNA提供了线索。

表1 前体脂肪细胞诱导分化过程中差异表达的miRNA
1.2miRNA参与调控脂肪细胞分化过程在脂肪细胞分化过程中,多种miRNA在分化的早期或后期通过调控其靶基因发挥促进分化或抑制分化的作用。Wang等[9]研究发现,在脂肪细胞诱导分化的第4小时和第1日,miR-17-92出现2个表达高峰,通过作用于Rb2/p130,在脂肪细胞分化早期的克隆增殖过程中发挥重要的调控作用。Kajimoto等[6]研究表明,在前体脂肪细胞中过表达miR-143后可以显著促进三酰甘油的蓄积,抑制miR-143表达后,脂肪细胞分化受到抑制。其机制可能与影响成脂分化关键基因过氧化物酶体增殖物激活受体γ和aP24的表达有关[10]。细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)5作为miR-143的直接靶标在miR-143调控脂肪细胞分化过程中可能也发挥了重要作用[5]。此外,miR-375、miR-200c/141、miR-200b/a/429、miR-642a-3p、miR-30a、miR-30d、miR-30c等,亦被证实具有促进脂肪细胞分化的作用(表2)。另有研究表明,let-7、miR-27、miR-130等miRNA具有负向调控成脂分化的作用,过表达let-7通过与靶标HMGA2基因作用延长细胞周期,抑制克隆增殖和终末分化;同时,尚可使PPARγ等基因表达下降,抑制3T3-L1前体脂肪细胞的分化[11]。miR-27a、miR-27b亦可通过作用于靶标基因PPARγ抑制脂肪细胞分化过程中的脂质积聚[12-13]。文献报道,具有抑制脂肪细胞分化作用的miRNA还有miR-130、miR-138、miR-369-5p等(表2)。
2miRNA与胰岛素抵抗
肥胖可降低胰岛素主要靶器官(肝脏)对胰岛素的敏感性,胰岛素抵抗(insulin resistance, IR)是多种肥胖相关并发症的共同病理基础。目前,已发现一些miRNAs参与肥胖相关IR发生的分子机制。
2.1miRNA与脂肪组织IR脂肪细胞是胰岛素作用的主要效应细胞,脂肪组织在肥胖相关IR的发病机制中发挥重要作用。Ling等[27]采用基因芯片技术检测发现,在发生IR的3T3-L1 脂肪细胞模型中有50个miRNA表达上调,29个表达下调,其中miR-320的表达水平是正常脂肪细胞的50倍之多;
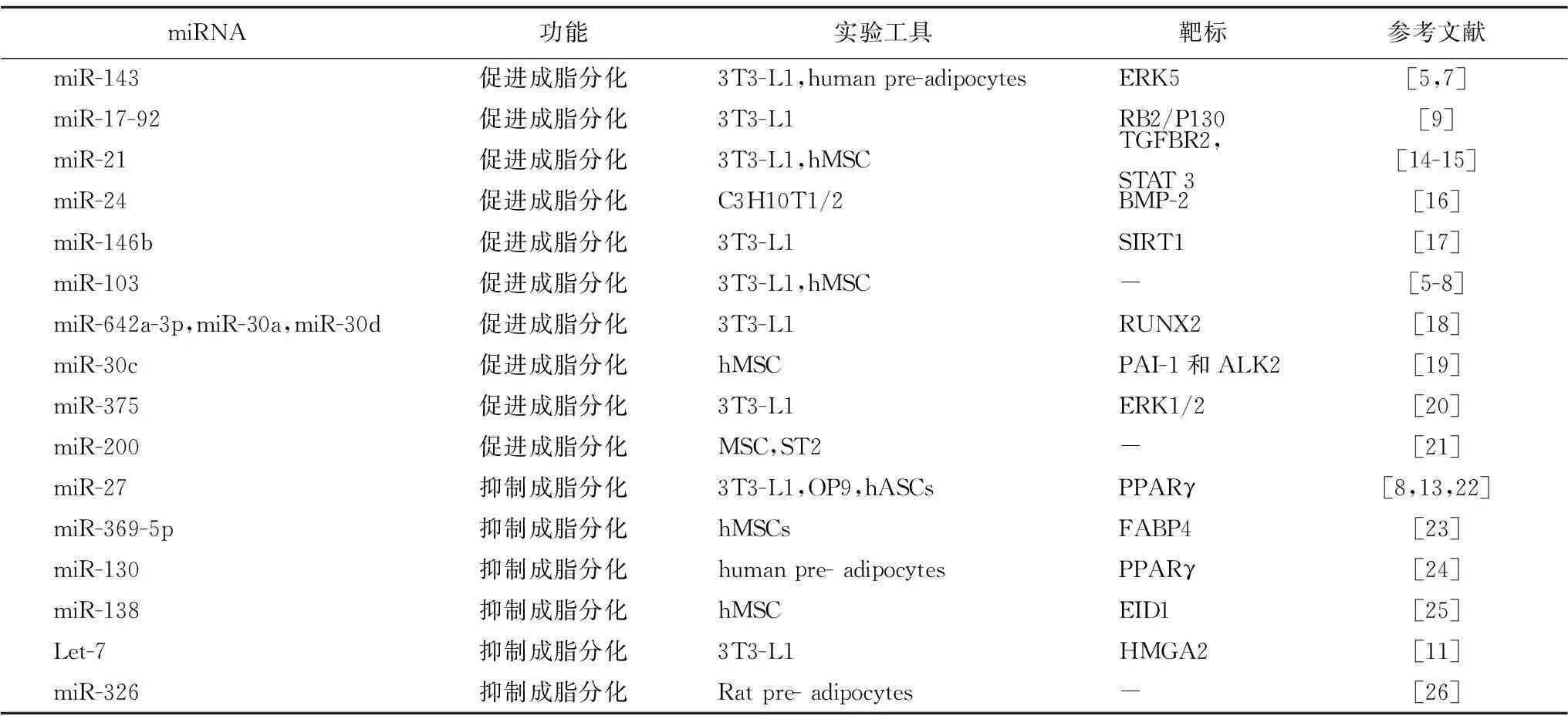
表2 脂肪分化过程中功能相关的miRNA
3T3-L1:小鼠胚胎成纤维细胞(前脂肪);hMSC:人骨髓间充质干细胞;ST2:小鼠间充质干细胞;C3H10T1/2:鼠胚胎间充质干细胞;hASCs:人体脂肪组织来源干细胞;OP9:小鼠骨髓来源的基质细胞系;“-”:文献中未显示
采用反义核苷酸技术抑制miR-320后,发现P85表达水平、蛋白激酶B(protein kinase B,AKT)丝氨酸磷酸化水平及葡萄糖转运4(glucose transporter type 4,GLUT4)蛋白水平均提高,使胰岛素诱导的葡萄糖摄取增强,表明miR-320表达沉默可显著提高IR脂肪细胞对胰岛素的敏感性,其机制可能是通过抑制脂肪细胞中胰岛素磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)-AKT信号通路起作用的。Trajkovski等[28]研究发现,ob/ob和DIO肥胖小鼠体内miR-103/107表达上调,并证实胰岛素受体重要的调控元件陷窝蛋白1是miR-103/107的直接靶基因;在脂肪细胞中沉默miR-103/107后,可诱导陷窝蛋白1的表达,促进胰岛素受体的稳定,进而激活胰岛素信号通路,使脂肪细胞体积变小,促进胰岛素诱导下葡萄糖的摄取。另外,miR-143和miR-29家族均可能通过影响AKT激活参与肥胖状态下脂肪细胞胰岛素敏感性的调节[7,29]。
2.2miRNA与肝脏IRSekine等[30]研究表明,条件性剔除新生小鼠肝脏中miRNA剪切酶Dicer,可导致肝脏特异的miRNA,miR-148a、miR-194、miR-192和miR-122的表达水平下调,小鼠肝糖原储存会受损,出现严重空腹高糖血症,提示这些miRNA与肝脏糖代谢有关。miR-122是肝脏内表达最丰富的miRNA,Esau等[31]发现,小鼠肝脏细胞中的miR-122表达抑制后,脂肪酸氧化能力显著增强,肝内脂肪酸和胆固醇的合成明显减少,血浆中胆固醇水平显著降低;miR-122抑制还可活化DIO小鼠肝脏中腺苷酸活化蛋白激酶,改善肝脏的脂肪变,提示miR-122可能参与了肥胖状态下肝脏IR的发生。已证实miR-33a、miR-33b通过与固醇调节元件结合蛋白相互作用调节胆固醇的稳态[32]。Davalos等[33]报道,在肝细胞中,miR-33a/b首先会抑制胰岛素受体底物2的表达,随后抑制胰岛素信号通路下游蛋白AKT、ERK等的活化;沉默miR-33a/b的表达,可提高肝脏脂肪酸的氧化作用及胰岛素敏感性。此外,也有研究显示,miR-126通过作用于其靶点胰岛素受体底物1,降低胰岛素受体底物1蛋白的表达,引起肝细胞线粒体功能障碍,进而诱导肝脏IR的发生[34]。
2.3miRNA与骨骼肌IRHe等[29]发现,糖尿病GK大鼠骨骼肌中miR-29a/b/c表达上调,miR-24和miR-126表达下调。Huang等[35]也发现,miR-24在GK大鼠骨骼肌中是显著下调的,并证实p38丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)是miR-24的直接靶标,而在GK大鼠骨骼肌中,p38 MAPK呈高表达,提示miR-24可能通过影响p38MAPK表达参与调控骨骼肌胰岛素敏感性。综合分析文献可以发现,miRNAs调控肥胖相关IR的机制非常复杂,不仅存在组织特异性,亦存在单个miRNAs在不同组织发挥作用;另外,多个miRNAs可以同时作用于一条信号通路中的某个分子或多个节点的分子。
3细胞外miRNA与肥胖
研究显示,在血浆、血清、尿液、唾液中也存在miRNA,这些细胞外miRNA被包裹于外核体、脂类、蛋白复合体或微囊泡,可以免受核糖核酸酶的降解,从而具有高度的稳定性[36]。细胞外miRNA由正常细胞、异常增生的组织细胞以及坏死凋亡的细胞产生,释放到体液后被识别、吸收及利用,参与细胞与细胞间的信息交流[37]。研究表明,细胞外miRNA的表达水平与疾病和有害的环境密切相关,可能成为疾病诊断的标志物[38]。迄今发现的脂肪细胞来源的细胞外miRNA已逾140种,大部分是脂肪细胞特异的,在脂肪细胞供体中大量表达[39]。Muller等[40]研究发现,在SD大鼠脂肪细胞分化期间,脂肪细胞供体中let-7b、miR-103、miR-146b和miR-148a表达上调,并在细胞来源的外来体中检测到上调一致的miRNA; miR-221是已报道过的在脂肪细胞分化期间表达下调的miRNA, 然而在脂肪细胞分泌的外来体中却没有发现miR-221 的异常表达。提示,外来体中含有的miRNA可能具有特异调节作用。另外,Heneghan等[41]发现,肥胖患者血清中miR-17-5p和miR-132水平和脂肪组织表达量均显著低于正常对照者。Zampetaki等[42]检测到性别、年龄相当的2型糖尿病患者和健康对照者血浆样本中的差异表达miRNA共13个, 其中miR-24、miR-21、miR-20b、miR-15a、miR-126、miR-191、 miR-197、miR-223、miR-320、miR-486、miR-150、miR-29b 在糖尿病患者血浆中表达下调,而miR-28-3P表达上调;并选择差异表达最显著的miR-15a、miR-28-3p、miR-126、miR-223、miR-320作为监测指标,对19例血糖正常的受试者进行了为期10年的随访研究,发现这些miRNA对预测2型糖尿病的发生和最后的诊断均具有重要价值。虽然,对于细胞外miRNA与肥胖以及相关疾病关系的研究尚处于起步阶段,但已有的研究结果足以提示,细胞外miRNA有可能成为肥胖及其相关疾病诊断的新的标志物。
4小结
miRNA通过上调和下调基因的表达,形成复杂的调控网络,参与脂肪细胞的分化过程,并在肥胖及其相关疾病中发挥重要作用。然而,miRNA作为诊断和治疗靶标应用于临床还有诸多问题需要解决。例如,不同检测方法之间的结果比对;操作过程的规范化;影响因素控制;作为治疗靶标在体内如何操纵特定靶向组织,避免脱靶风险等。尽管如此,随着miRNA 研究技术的快速发展,其应用前景必将更为广阔。
参考文献
[1]Pillai RS,Bhattacharyya SN,Filipowicz W.Repression of protein synthesis by miRNAs:How many mechanisms?[J].Trends Cell Biol,2007,17(3):118-126.
[2]Martinelli R,Nardelli C,Pilone V,etal.miR-519d overexpression is associated with human obesity[J].Obesity (Silver Spring),2010,18(11):2170-2176.
[3]Alvarez-Garcia I,Miska EA.MicroRNA functions in animal development and human disease[J].Development,2005,132(21):4653-4662.
[4]Xu P,Vernooy SY,Guo M,etal.The Drosophila microRNA miR-14 suppresses cell death and is required for normal fat metabolism[J].Curr Biol,2003,13(9):790-795.
[5]Esau C,Kang X,Peralta E,etal.MicroRNA-143 regulates adipocyte differentiation[J].J Biol Chem,2004,279(50):52361-
52365.
[6]Kajimoto K,Naraba H,Iwai N.MicroRNA and 3T3-L1 pre-adipocyte differentiation[J].RNA,2006,12(9):1626-1632.
[7]Xie H,Lim B,Lodish HF.MicroRNAs induced during adipogenesis that accelerate fat cell development are downregulated in obesity[J].Diabetes,2009,58(5):1050-1057.
[8]Qin L,Chen Y,Niu Y,etal.A deep investigation into the adipogenesis mechanism:profile of microRNAs regulating adipogenesis by modulating the canonical Wnt/beta-catenin signaling pathway[J].BMC Genomics,2010,11:320
[9]Wang Q,Li YC,Wang J,etal.miR-17-92 cluster accelerates adipocyte differentiation by negatively regulating tumor-suppressor Rb2/p130[J].Proc Natl Acad Sci U S A,2008,105(8):2889-2894.
[10]Takanabe R,Ono K,Abe Y,etal.Up-regulated expression of microRNA-143 in association with obesity in adipose tissue of mice fed high-fat diet[J].Biochem Biophys Res Commun,2008,376(4):728-732.
[11]Sun T,Fu M,Bookout AL,etal.MicroRNA let-7 regulates 3T3-L1 adipogenesis[J].Mol Endocrinol,2009,23(6):925-931.
[12]Kim SY,Kim AY,Lee HW,etal.miR-27a is a negative regulator of adipocyte differentiation via suppressing PPARgamma expres-sion[J].Biochem Biophys Res Commun,2010,392(3):323-328.
[13]Karbiener M,Fischer C,Nowitsch S,etal.microRNA miR-27b impairs human adipocyte differentiation and targets PPARgamma[J].Biochem Biophys Res Commun,2009,390(2):247-251.
[14]Kim YJ,Hwang SJ,Bae YC,etal.MiR-21 regulates adipogenic differentiation through the modulation of TGF-beta signaling in mesenchymal stem cells derived from human adipose tissue[J]. Stem Cells,2009,27(12):3093-3102.
[15]Kim YJ,Hwang SH,Cho HH,etal.MicroRNA 21 regulates the proliferation of human adipose tissue-derived mesenchymal stem cells and high-fat diet-induced obesity alters microRNA 21 expression in white adipose tissues[J].J Cell Physiol,2012,227(1):183-193.
[16]Sun F,Wang J,Pan Q,etal.Characterization of function and regulation of miR-24-1 and miR-31[J]. Biochem Biophys Res Commun,2009,380(3):660-665.
[17]Ahn J,Lee H,Jung CH,etal.MicroRNA-146b promotes adipogenesis by suppressing the SIRT1-FOXO1 cascade[J]. EMBO Mol Med,2013,5(10):1602-1612.
[18]Zaragosi LE,Wdziekonski B,Brigand KL,etal.Small RNA sequencing reveals miR-642a-3p as a novel adipocyte-specific microRNA and miR-30 as a key regulator of human adipogenesis[J].Genome Biol,2011,12(7):R64.
[19]Karbiener M,Neuhold C,Opriessnig P,etal.MicroRNA-30c promotes human adipocyte differentiation and co-represses PAI-1 and ALK2[J].RNA Biol,2011,8(5):850-860.
[20]Ling HY,Wen GB,Feng SD,etal.MicroRNA-375 promotes 3T3-L1 adipocyte differentiation through modulation of extracellular signal-regulated kinase signalling[J].Clin Exp Pharmacol Physiol,2011,38(4):239-246.
[21]Kennell JA,Gerin I,MacDougald OA,etal.The microRNA miR-8 is a conserved negative regulator of Wnt signaling[J].Proc Natl Acad Sci U S A,2008,105(40):15417-15422.
[22]Lin Q,Gao Z,Alarcon RM,etal.A role of miR-27 in the regulation of adipogenesis[J].FEBS J,2009,276(8):2348-2358.
[23]Bork S,Horn P,Castoldi M,etal.Adipogenic differentiation of human mesenchymal stromal cells is down-regulated by microRNA-369-5p and up-regulated by microRNA-371[J].J Cell Physiol,2011,226(9):2226-2234.
[24]Lee EK,Lee MJ,Abdelmohsen K,etal.miR-130 suppresses adipogenesis by inhibiting peroxisome proliferator-activated receptor gamma expression[J].Mol Cell Biol,2011,31(4):626-638.
[25]Yang Z,Bian C,Zhou H,etal.MicroRNA hsa-miR-138 inhibits adipogenic differentiation of human adipose tissue-derived mesenchymal stem cells through adenovirus EID-1[J].Stem Cells Dev,2011,20(2):259-267.
[26]Tang YF,Zhang Y,Li XY,etal.Expression of miR-31,miR-125b-5p,and miR-326 in the adipogenic differentiation process of adipose-derived stem cells[J].OMICS,2009,13(4):331-336.
[27]Ling HY,Ou HS,Feng SD,etal.CHANGES IN microRNA (miR) profile and effects of miR-320 in insulin-resistant 3T3-L1 adipocytes[J].Clin Exp Pharmacol Physiol,2009,36(9):32-39.
[28]Trajkovski M,Hausser J,Soutschek J,etal.MicroRNAs 103 and 107 regulate insulin sensitivity[J].Nature,2011,474(7353):649-653.
[29]He A,Zhu L,Gupta N,etal.Overexpression of micro ribonucleic acid 29,highly up-regulated in diabetic rats,leads to insulin resistance in 3T3-L1 adipocytes[J].Mol Endocrinol,2007,21(11):2785-2794.
[30]Sekine S,Ogawa R,Ito R,etal.Disruption of Dicer1 induces dysregulated fetal gene expression and promotes hepatocarcinogenesis[J].Gastroenterology,2009,136(7):2304-2315.
[31]Esau C,Davis S,Murray SF,etal.miR-122 regulation of lipid metabolism revealed by in vivo antisense targeting[J].Cell Metab,2006,3(2):87-98.
[32]Najafi-Shoushtari SH,Kristo F,Li Y,etal.MicroRNA-33 and the SREBP host genes cooperate to control cholesterol homeostasis[J].Science,2010,328(5985):1566-1569.
[33]Davalos A,Goedeke L,Smibert P,etal.miR-33a/b contribute to the regulation of fatty acid metabolism and insulin signaling[J].Proc Natl Acad Sci U S A,2011,108(22):9232-9237.
[34]Ryu HS,Park SY,Ma D,etal.The induction of microRNA targeting IRS-1 is involved in the development of insulin resistance under conditions of mitochondrial dysfunction in hepatocytes[J]. PLoS One,2011,6(3):e17343.
[35]Huang B,Qin W,Zhao B,etal.MicroRNA expression profiling in diabetic GK rat model[J].Acta Biochim Biophys Sin (Shanghai),2009,41(6):472-477.
[36]Mitchell PS,Parkin R,Kroh EM,etal.Circulating microRNAs as stable blood-based markers for cancer detection[J].Proc Natl Acad Sci U S A,2008,105(30):10513-10518.
[37]Muralidharan-Chari V,Clancy JW,Sedgwick A,etal.Microvesicles:mediators of extracellular communication during cancer progression[J].J Cell Sci,2010,123(Pt 10):1603-1611.
[38]Gahan PB.Circulating nucleic acids in plasma and serum:roles in diagnosis and prognosis in diabetes and cancer[J].Infect Disord Drug Targets,2008,8(2):100-108.
[39]Ogawa R,Tanaka C,Sato M,etal.Adipocyte-derived microvesicles contain RNA that is transported into macrophages and might be secreted into blood circulation[J].Biochem Biophys Res Commun,2010,398(4):723-729.
[40]Muller G,Schneider M,Biemer-Daub G,etal.Microvesicles released from rat adipocytes and harboring glycosylphosphatidylinositol-anchored proteins transfer RNA stimulating lipid syn-thesis[J].Cell Signal,2011,23(7):1207-1223.
[41]Heneghan HM,Miller N,Kerin MJ.Role of microRNAs in obesity and the metabolic syndrome[J].Obes Rev,2010,11(5):354-361.
[42]Zampetaki A,Kiechl S,Drozdov I,etal.Plasma microRNA profiling reveals loss of endothelial miR-126 and other microRNAs in type 2 diabetes[J].Circ Res,2010,107(6):810-817.
Research Progresses on Obesity-related miRNAZHANGNai-jian1,2,ZHAOChao2,ZHAOYa-ping2. (1.GraduateFaculty,BengBuMedicalCollege,Bengbu233030,China; 2.DepartmentofClinicalLaboratory,No.82HospitalofChinesePeople'sLiberationArmy,Huaian223001,China)
Abstract:Obesity,a public health problem worldwide,is closely related to hypertension, hyperlipidemia,cardiovascular disease,type 2 diabetes and certain types of cacinoma and is a serious threat to human health and life safety.However,the pathogenesis of obesity is unclear Recently,emerging studies suggest that microRNAs (miRNA) involve in many kinds of biological processes of metabolic disease.Here is to make a review of the changes of miRNA expression profiles during adipogenesis,mechanism of miRNAs and their important role in adipogenesis and obesity-related insulin resistance.
Key words:Obesity; Adipocyte; Insulin resistance; Extracellular miRNA
收稿日期:2014-07-08修回日期:2014-10-08编辑:郑雪
doi:10.3969/j.issn.1006-2084.2015.09.012
中图分类号:R318.19
文献标识码:A
文章编号:1006-2084(2015)09-1567-05

