基于纳米粒子的TR-FRET传感器用于miRNAs的无扩增检测
张毅,谭加兴,叶彦恺,姜炜,孙艳华,沈万秋,曹海燕,靳美娜,秦楠,段宏泉
(天津医科大学药学院医用化学教研究,天津市临床药物关键技术重点实验室,天津300070)
论著
基于纳米粒子的TR-FRET传感器用于miRNAs的无扩增检测
张毅,谭加兴,叶彦恺,姜炜,孙艳华,沈万秋,曹海燕,靳美娜,秦楠,段宏泉
(天津医科大学药学院医用化学教研究,天津市临床药物关键技术重点实验室,天津300070)
目的:建立一种基于纳米粒子的时间分辨(TR)荧光共振能量转移(FRET)生物传感器用于miRNAs的无扩增检测。方法:以寡核苷酸单链probe I偶联GdF3:Tb3+纳米粒子作为供体,以寡核苷酸单链probe II偶联金(Au)纳米粒子作为受体,利用供体与受体之间的FRET检测目标miRNA hsa-miR-122-5p浓度,并通过设置多功能酶标仪的检测延迟去除自发荧光背景以提高灵敏度。结果:该传感器能够高灵敏度、高特异性地检测目标分子,并且对于光照有良好的耐受性,而且能够避免自发荧光干扰。对hsa-miR-122-5p的检测线性范围为0.1 fmol/L~100 pmol/L,与同类型的RNA荧光传感器的检测限具有可比性。结论:基于纳米粒子的TR-FRET生物传感器用于miRNAs的无扩增检测具有良好的灵敏度和特异性。
镧系金属掺杂;纳米粒子;时间分辨;荧光共振能量转移;miRNA;传感器;无扩增检测
微核糖核酸(miRNAs)是一类由内源基因编码的、长度约为22个核苷酸的非编码单链RNA分子,它在细胞分化、增殖和凋亡以及肿瘤的发生和发展等病理过程中都起到非常重要的调控作用[1]。有研究表明,某些miRNAs可以介导肿瘤的扩增和扩散,与多药耐药密切相关,可以调节癌症转移过程中多个基因的表达,这些miRNAs很有可能成为预测癌症的重要指标[2-3]。目前,miRNAs的检测手段主要包括反转录聚合酶链反应[4]、微阵列[5]、电化学[6]、荧光法[7-8]等。其中,相比其他3种方法,荧光法具有成本低廉、灵敏度高、操作简单等明显优势。本文旨在报道一种基于镧系金属掺杂纳米粒子的时间分辨(TR)型荧光共振能量转移(FRET)生物传感器用于检测miRNAs。该传感器的优势在于其能够有效地避免来自体液、细胞和组织样本的散射光以及自发荧光干扰,无需扩增miRNAs,无需避光保存。
1 材料与方法
1.1 试剂及样本 所有合成RNA及DNA均购于金唯智生物科技有限公司(北京)。其他所用试剂均为分析纯,实验用水由Labconco WaterPro水系统制备。GdCl3×6H2O,TbCl3×6H2O,NH4F,聚丙烯酸(PAA,分子量~2 000),1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDC),N-羟基琥珀酰亚胺(NHS)购自上海阿拉丁试剂有限公司。盐酸,EDTA,Na2HPO4×12H2O,NaH2PO4×2H2O,NaOH,NaCl,MgCl2,柠檬酸钠购自天津光复试剂有限公司。酵母tRNA购自北京华越洋生物科技有限公司。RNA提取试剂盒购于北京百泰克生物技术有限公司。qRT-PCR试剂盒为TaqManRMicroRNA Assay,SM,货号4427975。一位健康人和一位慢性淋巴性白血病(CCL)患者血清各两份,购于中国医学科学院血液学研究所血液病医院(天津)。本工作所涉及的核苷酸序列见表1。

表1 核苷酸序列Tab 1 Sequences of RNA and DNA
1.2 仪器 Thermo Scientific Varioskan Flash光谱扫描多功能读数仪,雷勃尔LG16-A高速台式离心机,荧光定量PCR仪ABI7000。
1.3 实验方法
1.3.1 PAA-GdF3:Tb3+纳米粒子的合成 本合成参考了文献方法[9],并做了部分改动。具体步骤如下:在50 mL圆底烧瓶中,向12 mL超纯水和4.0 mL乙二醇混合溶剂中加入0.1 mmol GdCl3×6H2O、80 mg PAA、2.0 μmol TbCl3×6H2O,搅拌至均匀透明后加热至50℃。另取一支15 mL试管中加入2.0 mL乙二醇、5.0 mL超纯水和0.3 mmol NH4F,室温搅拌至均匀透明后加热至50℃,趁热将此NH4F溶液滴加入上述圆底烧瓶中,持续反应30 min后2 000 r/min离心5 min,收集固体产物,并分别用超纯水和乙醇各洗涤两遍,真空干燥过夜。最后得到PAA修饰的GdF3:Tb3+纳米粒子白色粉末状产物。
1.3.2 寡核苷酸单链probe I与PAA-GdF3:Tb3+纳米粒子偶联 寡核苷酸单链probe I的5’端带有氨基,GdF3:Tb3+纳米粒子表面有大量羧基,可以通过EDC和NHS催化于水相中实现氨基和羧基的缩合[10]。将步骤1.3.1所得粉末配制成5%w/v水溶液,取100 μL上述水溶液、5 nmol寡核苷酸单链probe I(5′-NH2-(CH2)6-TGGAGTGTG AC-3′)、30 mg EDC、5 mg NHS加入到1 mL PBS(0.1 mol/L,pH 7.4)中,混合均匀后室温下电磁搅拌反应24 h。产物以2 000 r/ min离心5 min后以PBS(0.1 mol/L,pH 7.4)洗涤2次,并于PBS(10 mmol/L,pH 7.4,100 mmol/L NaCl)中4°C储存,此溶液为偶联有寡核苷酸单链probe I的GdF3:Tb3+纳米粒子溶液。
1.3.3 制备寡核苷酸单链probeⅡ修饰的金纳米粒子 参考文献方法[11],利用柠檬酸钠还原HAuCl4制备新鲜的胶体金纳米粒子溶液并将寡核苷酸单链probeⅡ(5′-AATGGTGTTTG-(CH2)6-SH-3′)与金纳米粒子偶联,最后将其分散于PBS(10 mmol/L,pH 7.4,100 mmol/L NaCl,1 mmol/L MgCl2)的缓冲溶液中,储存于4°C备用。
1.3.4 FRET传感器构建 参考文献实验条件[12],通过核酸杂交反应偶联上述两种纳米粒子。取100 μL偶联有寡核苷酸单链probeⅠ的GdF3:Tb3+纳米粒子溶液,加入200 μL寡核苷酸单链probeⅡ修饰的金纳米粒子溶液和5 nmol probeⅢ(5′-CAAACACC ATTGTCACACTCCA-3′),37°C、3 000 r/min振荡约1 h,以荧光光度计监测543 nm处的荧光变化直至降低至不再变化。2 000 r/min离心5 min,小心弃去上清液,以PBS(10 mmol/L,pH 7.4,100 mmol/L NaCl,1 mmol/L MgCl2)洗涤,再重复两次上述离心和洗涤过程以去除未结合的probeⅢ和金纳米粒子,得到FRET传感器的PBS溶液。
1.3.5 检测原理 图1显示了本传感器的工作原理如下:以寡核苷酸单链probeⅠ偶联GdF3:Tb3+纳米粒子作为FRET供体,以寡核苷酸单链probeⅡ偶联金(Au)纳米粒子作为FRET受体,先利用probeⅢ与probeⅠ和Ⅱ的碱基互补作用将供体与受体连接并建立高效的FRET,使GdF3:Tb3+纳米粒子荧光淬灭,此混合体系即为检测混合液。以hsamiR-122-5p为模式目标分子,当向上述检测混合液中加入含有目标RNA的待测样本后,probeⅢ与目标RNA结合,原有的FRET被打破,GdF3:Tb3+纳米粒子荧光恢复,即实现off-on检测模式。通过设置多功能酶标仪的检测模式为 time-resolve spectra,延迟时间为100 μs、门时间为1 ms,去除短寿命的自发荧光背景,检测GdF3:Tb3+纳米粒子在543 nm处的荧光发射强度,利用标准曲线法和标准加入法计算样本中目标分子浓度。表1中列出了实验所涉及核酸序列,其中5p-1x、5p-1y及5p-1z均为目标miRNA hsa-miR-122-5p的单碱基差异核酸序列。

图1 基于镧系金属掺杂纳米粒子的时间分辨FRET生物传感器用于has-miR-122的无扩增检测原理示意图Fig 1 Schematic diagram of the direct non-amplification detection ofmiRNAsbytime-resolvedFRETassaybasedonlanthanidedopednanocrystals
1.3.6 样品准备 (a)用于TR-FRET检测的血清处理[13]:实验前,1.0 mL血清样本中加入100 μL 100 mg/mL酵母tRNA以保护内源miRNAs不被核酶降解。以PBS(25 mmol/L,pH 7.0,25 mmol/L NaCl)将血清样本稀释 10倍,95℃加热 15 min以释放miRNAs。在96孔板的样品孔内,加入90 μL人工合成hsa-miR-122-5p的PBS溶液或稀释血清,再加入10 μL FRET传感器,于室温下震荡孵育1 h后检测。(b)阴性对照实验:以5.1 mg/mL人血清白蛋白代替血清,后续处理同上。(c)对照方法:qRT-PCR,利用RNA提取试剂盒提取血清全部RNA,并以qRT-PCR试剂盒检测hsa-miR-122-5p。
1.3.7 光谱扫描条件 以272 nm为激发波长,扫描400~700 nm的荧光发射光谱;以543 nm作为发射波长,扫描220~400 nm的荧光激发光谱。TRFL(时间分辨荧光)分析测试:以272 nm为激发波长,测定543 nm处的荧光,延迟时间(delay time)为100 μs,检测门时间(gate time)为1 ms。
2 结果
2.1 PAA-GdF3:Tb3+纳米粒子的荧光性质 本工作通过一步溶剂热法制备了PAA-GdF3:Tb3+纳米粒子。使用分子量为2 000的PAA作为表面封端剂以控制粒子生长,并藉此赋予纳米粒子水溶性及生物相容性。本工作中所合成的PAA-GdF3:Tb3+纳米粒子易溶于水,水溶液澄清透明。该纳米粒子在水溶液、300 mmol/L NaCl溶液及pH 5.0~12.0磷酸盐缓冲液中,在室温下、空气中、不避光保存1个月,既没有发生絮凝也没有沉淀,说明此纳米粒子可以耐受多种生理条件。
图2a为PAA-GdF3:Tb3+纳米粒子水溶液的荧光激发光谱、发射光谱。该纳米粒子在272 nm处有尖锐激发线,对应Gd3+离子向的跃迁,相比之下Tb3+的激发线非常微弱。在543 nm处有最大荧光发射,对应Tb3+离子5D4向7F5的特征跃迁发射,紫外灯照射下该溶液发射绿色荧光(图2a)。上述结果说明,GdF3:Tb3+纳米粒子主体Gd3+吸收光子,并向掺杂Tb3+转移能量,进而实现掺杂元素Tb3+的荧光发射。本工作检测了PAA-GdF3:Tb3+纳米粒子水溶液在543 nm的荧光衰减曲线(图2b),经拟合该荧光衰减曲线符合双指数函数,所制备纳米粒子的平均荧光寿命为1.2 ms,此荧光寿命远大于生物样本自发荧光寿命,足以利用时间分辨技术扣除短寿命荧光背景干扰。金纳米粒子在400 nm到600 nm范围内有广泛吸收,与PAA-GdF3:Tb3+纳米粒子的发射光谱有较好的交叠,表明二者之间有实现FRET的条件。

图2 PAA-GdF3:Tb3+纳米粒子水溶液的荧光激发光谱、发射光谱以及荧光衰减曲线Fig 2 Excitation spectra,emission spectra and decay curve of the as-prepared PAA-GdF3:Tb3+nanocrystals solution
2.2 线性范围及特异性 向检测混合液中加入人工合成目标miRNA hsa-miR-122-5p,检测混合液在543 nm处的荧光发射强度发生了有规律的增加。在0.1 fmol/L~100 pmol/L浓度范围内,所加入miRNA浓度的负对数(-logCmiRNA)与检测混合液的荧光强度呈线性关系,并且相关系数r2>0.99(图3)。
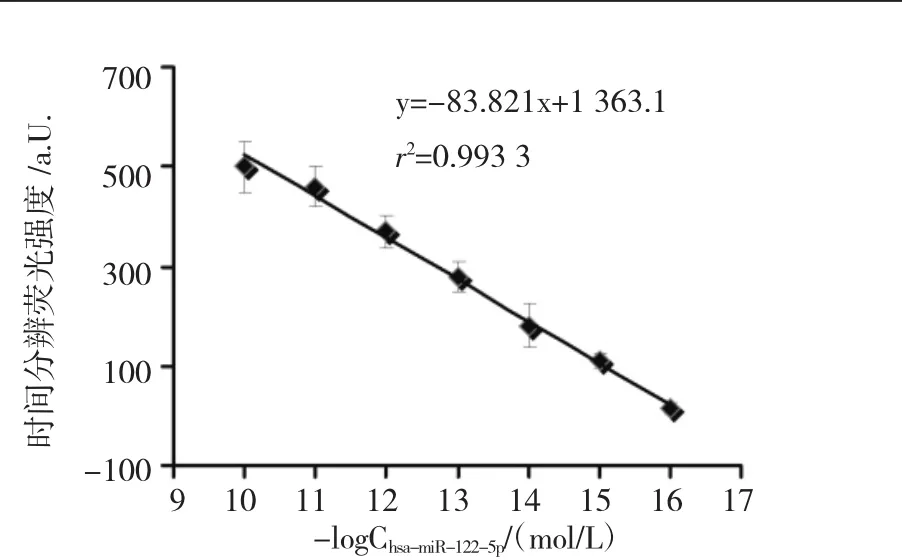
图3 目标miRNA hsa-miR-122-5p对检测混合液荧光强度(543 nm)的影响Fig 3 Effect of target miRNA hsa-miR-122-5p on the fluorescence intensity at 543 nm of detecting mixture
由于miRNA家族成员之间具有高度的序列相似性,因此,本工作还考察了检测体系的特异性,包括对单碱基差异的识别能力和前体miRNA的交叉杂交(图4a),各寡核苷酸链的碱基序列见表1。向检测混合液中分别加入目标miRNA hsa-miR-122-5p及其单碱基差异核酸序列5p-1x、5p-1y及5p-1z各200 pmol/L,检测混合液在543 nm处的荧光发射强度均有增加,但单碱基差异类似物与probeⅢ交叉杂交所引起的信号变化不足20%,其中5p-1y引起的交叉杂交最大,为18.2%。前体miRNA是一种含有成熟miRNA序列的稳定发卡结构RNA,也可能会对成熟miRNAs检测产生一定的干扰,因此,本工作中对pre-hsa-miR-122-5p的干扰做了进一步考察。200 pmol/L pre-hsa-miR-122-5p产生的信号与hsa-miR-122-5p相比为10.2%。以上结果说明本方法不仅能够区分单碱基差异序列,而且能够有效区分成熟miRNAs与其前体miRNAs。

图4 miRNA荧光传感器对不同样本的时间分辨荧光信号响应Fig 4 TR-fluorescence response of miRNA sensor to different samples
2.3 血清内源hsa-miR-122检测 将本文所开发的荧光传感器应用于人血清内源hsa-miR-122的检测。图4b显示,CCL患者血清内源hsa-miR-122稍多于健康人,与qRT-PCR分析结果一致。以上试验说明:本传感器能够从血清背景中成功检出目标miRNAs的丰度。
3 讨论
荧光共振能量转移(FRET)是在荧光供体的激发状态下由一对偶极子介导的能量从供体向受体转移的非辐射过程[14]。FRET受体和供体之间依靠生物偶联作用相结合时,彼此间距只有几个纳米,二者之间的能量转移过程可以通过扫描供体和受体的荧光光谱得以检测[15-16]。FRET效率对因目标分子浓度变化引起的受体-供体间距在纳米尺度的差异具有优越的灵敏度,因此,近年来在生物分析领域,尤其是在核酸杂交的检测中,FRET技术发挥了巨大的作用。然而,目前FRET技术普遍应用的有机小分子荧光供体光漂白严重;而且,基于稳态荧光的传统FRET分析中,当以紫外光激发时,生物样本的自发荧光干扰十分严重[15,17]。
稀土掺杂纳米粒子是一类新兴的荧光传感器材料,与有机染料和半导体量子点相比,稀土掺杂纳米粒子有很多更优越的化学和光学性质,例如:生物毒性低、有效Stokes位移大、发射峰狭窄、荧光寿命长以及耐光漂白能力强。由于稀土掺杂纳米粒子适用于时间分辨荧光检测技术,因此,有望将此材料应用于非侵袭性、无损伤的实时在体疾病监测[18-19]。
本工作以寡核苷酸单链probeⅠ偶联GdF3:Tb3+纳米粒子作为FRET供体,以寡核苷酸单链probeⅡ偶联金纳米粒子作为FRET受体,以hsa-miR-122-5p为模式目标分子,通过设置多功能酶标仪的检测延迟去除自发荧光背景,利用供体与受体之间的FRET检测样本中目标分子浓度。该传感器能够高灵敏度、高特异性地检测目标分子,并且对于光照有良好的耐受性,能够避免自发荧光干扰。对hsa-miR-122-5p的检测线性范围为0.1 fmol/L~100 pmol/L,与同类型的RNA荧光传感器的检测限具有可比性。将该传感器应用于血清内源hsa-miR-122检测时,能够有效检出样本中目标物的丰度差异。
[1] Petri A,Lindow M,Kauppinen S.MicroRNA silencing in primates:towards development of novel therapeutics[J].Cancer Res,2009,69 (2):393
[2] Lowery A J,Miller N,Mcneill R E,et al.MicroRNAs as prognostic indicators and therapeutic targets:potential effect on breast Cancermanagement[J].Clin Cancer Res,2008,14(2):360
[3] Shi W,Gerster K,Alajez N M,et al.MicroRNA-301 mediates proliferation and invasion in human breast cancer[J].Cancer Res, 2011,71(8):2926
[4] Mcdonald J S,Milosevic D,Reddi H V,et al.Analysis of circulating microRNA:preanalytical and analytical challenges[J].Clin Chem, 2011,57(6):833
[5] Qavi A J,Kindt J T,Gleeson M A,et al.Anti-DNA:RNA antibodies and Silicon photonic microring resonators:increased sensitivity for multiplexed microRNA detection[J].Anal Chem,2011,83(13):5949 [6] Poehlmann C,Sprinzl M.Electrochemical detection of microRNAs via gap hybridization assay[J].Anal Chem,2010,82(11):4434
[7]Chan H M,Chan L S,Wong R N,et al.Direct quantification of single-moleculesofmicroRNA by totalinternalreflection fluorescence microscopy[J].Anal Chem,2010,82(16):6911
[8] Broyles D,Cissell K,Kumar M,et al.Solution-phase detection of dual microRNA biomarkers in serum[J].Anal Bioanal Chem,2012, 402(1):543
[9] Ju Q,Liu Y S,Tu D T,et al.Lanthanide-Doped multicolor GdF3 nanocrystals for Time-Resolved photoluminescent biodetection[J]. Chem Eur J,2011,17(31):8549
[10]Li J S,Schachermeyer S,Wang Y,et al.Detection of microRNA by fluorescence amplification based on cation -exchange in nanocrystals[J].Anal Chem,2009,81(23):9723
[11]Tu Y Q,Wu P,Zhang H,et al.Fluorescence quenching of Gold nanoparticles integrating with a conformation-switched hairpin oligonucleotide probe for microRNA detection[J].Chem Commun, 2012,48(87):10718
[12]BakerMB,BaoG,SearlesCD.InvitroquantificationofspecificmicroRNA using molecular beacons[J].Nucleic Acids Res,2012,40(2):e13
[13]Labib M,Ghobadloo S M,Khan N,et al.Four-way junction formation promoting ultrasensitive electrochemical detection of microRNA[J].Anal Chem,2013,85(20):9422
[14]Gu J Q,Shen J,Sun L D,et al.Resonance energy transfer in steadystate and time-decay fluoro-immunoassaysforlanthanide nanoparticles based on biotin and avidin affinity[J].J Phys Chem C, 2008,112(17):6589
[15]Tu D T,Liu L Q,Ju Q,et al.Time-resolved FRET biosensor based on amine-functionalized lanthanide-doped NaYF4 nanocrystals[J]. Angew Chem Int Ed Engl,2011,50(28):6306
[16]Hu S,Yang H,Cai R X,et al.Biotin induced fluorescence enhancement in resonance energy transfer and application for bioassay[J].Talanta,2009,80(2):454
[17]Jiang L,Duan D M,Shen Y,et al.Direct microRNA detection with Universal tagged probe and time-resolved fluorescence technology [J].Biosens Bioelectron,2012,34(1):291
[18]Yang Y H,Tu D T,Zheng W,et al.Lanthanide-doped Sr2YF7 nanoparticles:controlled synthesis,opticalspectroscopy and biodetection[J].Nanoscale,2014,6(19):11098
[19]Zheng W,Zhou S Y,Chen Z,et al.Sub-10 nm lanthanide-doped CaF2 nanoprobes for time-resolved luminescent biodetection[J]. Angew Chem Int Ed Engl,2013,52(26):6671
(2015-08-06收稿)
Direct non-amplification detection of miRNAs by time-resolved FRET sensor based on lanthanide-doped
nanocrystals
ZHANG Yi,TAN Jia-xing,YE Yan-kai,JIANG Wei,SUN Yan-hua,SHEN Wan-qiu,CAO Hai-yan,JIN Mei-na,QIN Nan,DUAN Hong-quan(Department of Medical Chemistry,College of Pharmacy,Tianjin Medical University,Tianjin Key Laboratory on Technologies Enabling Development of Clinical Therapeutics and Diagnostics(Theranostics),Tianjin 300070,China)
Objective:To develop a miRNA detection method based on the time-resolved(TR)fluorescence resonance energy transfer(FRET)assay.Methods:The GdF3:Tb3+nanocrystals were coupled with nucleotide probe I as donor,and gold nanocrystals with nucleotide probeⅡas acceptor.miRNA hsa-miR-122-5p was detected by time-resolved FRET assay,and the short lived background luminescence such as auto-fluorescence was suppressed when determining the long lived fluorescence of Tb3+by setting appropriate delay time and gate time.Results:The TR-FRET based miRNA sensor was sensitive and selective to hsa-miR-122-5p with a dynamic linear range of 0.1 fmol/ L-100 pmol/L,which was compatible with that of the same type of sensors.Furthermore,the GdF3:Tb3+nanocrystals were stable to light irradiation and their lifetime was long enough to avoid autofluorescence.Conclusion:The TR-FRET miRNA sensor for non-amplification detection of hsa-miR-122-5p based on GdF3:Tb3+nanocrystals,is sensitive and selective.
lanthanide-doped;nanocrystals;time-resolved;fluorescence resonance energy transfer;miRNA;sensor;non-amplification detection
R9
A
1006-8147(2015)06-0521-04
国家自然科学基金资助项目(21305103,21373151,31200753,21205087)
张毅(1982-),女,博士,研究方向:纳米材料于生化分析的应用;通信作者:段宏泉,E-mail:duanhq@tijmu.edu.cn。

