高效液相色谱法测定高尿酸血症动物模型饲料中嘌呤的含量
崔 博,黄国伟,王 璇,赛 娜,曹德庆
(天津医科大学公共卫生学院营养与食品卫生学系,天津300070)
论著
高效液相色谱法测定高尿酸血症动物模型饲料中嘌呤的含量
崔 博,黄国伟,王 璇,赛 娜,曹德庆
(天津医科大学公共卫生学院营养与食品卫生学系,天津300070)
目的:建立饲料中嘌呤含量的高效液相色谱检测方法。方法:采用70%高氯酸在100℃水浴60 min过滤膜;Waters Atlantis T3色谱柱(4.6 mm×250 mm×5 μm);流动相为10 mmol·mL-1甲酸铵(pH3.6)-甲醇(99∶1);流速1.0 mL·min-1;检测波长:254 nm;柱温:30℃。结果:各嘌呤在0.01~20 g·mL-1的浓度范围内线性良好,平均回收率为90.82%~99.43%,相对标准偏差<4.6。结论:该方法准确可靠,适用于饲料中嘌呤含量的检测。
饲料;嘌呤;高效液相色谱法
嘌呤为有机化合物,是核酸的重要组成成分,在体内分解代谢生成尿酸排出体外。通过日常饮食中摄取的嘌呤占20%,但极少为人体利用,几乎全部转化成尿酸。体液中嘌呤和尿酸含量是代谢不平衡的标志[1],嘌呤代谢紊乱和(或)尿酸排泄减少会导致体内血尿酸水平升高而引起一系列代谢性疾病[2],如痛风。目前,高尿酸血症动物模型的复制方法多为在模型动物饲料中掺入尿酸或尿酸前体物质,以复制人高嘌呤饮食导致血尿酸增高,对于指导人类预防疾病发生有重要意义。故模型动物摄入饲料中嘌呤含量的定性及定量检测是必不可少的,食品中嘌呤含量检测最常用的方法是高效液相色谱法[3],但国内常见一种特定组分或与食品中其它成分同时检测,少见饲料中4种嘌呤含量检测的文献报道。本试验通过探讨流动相的选择及水解条件的优化,建立饲料中4种嘌呤含量同时检测的方法,以期为相关代谢性疾病研究提供依据。
1 材料与方法
1.1 仪器与药品
1.1.1 仪器 高效液相色谱仪配紫外检测器(美国Waters公司);Seven Easy S20 pH计(上海梅特勒-托利多仪器有限公司);BSA224S电子分析天平(北京赛多利斯科学仪器有限公司);KQ-250E型医用超声波清洗器(昆山市超声仪器有限公司);水浴锅(上海博迅实业有限公司)。
1.1.2 药品 腺嘌呤、黄嘌呤、次黄嘌呤购自Sigma公司,纯度>99%;鸟嘌呤购自Fluka公司,纯度>99%;甲醇,色谱纯购自霍尼韦尔公司;磷酸、甲酸、高氯酸为优级纯,购自天津博迪化工有限公司;甲酸铵为分析纯,购自天津市光复精细化工研究所;氢氧化钠、磷酸二氢钾为分析纯,购自天津市风船化学试剂科技有限公司;样品为大鼠成长饲料,购自北京维通利华实验动物技术有限公司;试验用水均为重蒸水。
1.2 方法
1.2.1 色谱条件 色谱柱:Waters Atlantis T3色谱柱(4.6 mm×250 mm×5 μm);流动相:甲酸铵(pH3.6)-甲醇(99∶1);流速:1.0 mL·min-1;柱温:30℃;进样量:10 μL。
1.2.2 标准品储备液的配置 分别准确称取腺嘌呤、黄嘌呤、次黄嘌呤、鸟嘌呤标准品各0.01g置10mL量瓶中,用1mol·L-1NaOH溶液溶解,重蒸水定容至10mL,配置成浓度为1g·L-1的储备液,4℃保存。
1.2.3 标准品溶液的配置 精密量取1 g·L-1储备液适量,分别置于10mL瓶中,用重蒸水稀释定容,配置成各含嘌呤0.01、0.05、0.1、0.5、1、2、5、20 μg·mL-1系列标准液,摇匀备用。
1.2.4 样品的处理 取0.1~0.2 g粉碎样品置于10 mL玻璃管中,向其加入1 mL 70%高氯酸溶液,混匀后100℃水浴60 min迅速冷却,7 mol·L-1KOH调pH至7后再用0.5%甲酸调pH至3.6,流动相定容至5 mL,充分混匀后过0.22 μm滤膜待测。
1.2.5 系统适应性试验 分别吸取上述系列标准溶液进样10 μL分析,即得一系列色谱数据。以各自的峰面积为纵坐标,浓度为横坐标,进行线性分析。分别向高效液相色谱仪进入单一标准品,在“1.2.1”条件下进样10 μL分析,所得各单一标准品出峰时间,即为该标准品保留时间。
1.2.6 精密度试验 精密吸取同一样品溶液重复进样6次,测定峰面积,计算RSD。
1.2.7 稳定性试验 精确称取样品,按样品处理方法操作,在“1.2.1”色谱条件下,分别在0、4、8、12 h内注入高效液相色谱仪,测定峰面积,计算RSD。
1.2.8 重复性试验 精确称取样品6份,按样品处理方法操作,在1.2.1色谱条件下,各取10 μL进样,测定峰面积,计算RSD。
1.2.9 回收率试验 精密称取样品0.1 g,按其所含每种嘌呤量0.5倍、1倍、2倍加入各标准品溶液中,使其成为高中低3种浓度,经样品前处理后进样测定,每个浓度进样3次取均值和标准差,计算RSD。
2 结果
2.1 系统适用性 由色谱图可以看出,在上述色谱条件下,出峰情况良好,各嘌呤组分得到有效分离,出峰顺序为鸟嘌呤、腺嘌呤、次黄嘌呤、黄嘌呤。保留时间依次约为9.7、10.1、10.8、13.1 min(图1),样品在此保留时间也出现相同的峰,与相邻色谱峰的分离度均大于1.5,理论塔板数均大于16 000(图2),阴性对照品在相应位置无影响(图3)。
2.2 标准曲线 按“1.2.1”条件测定,以各嘌呤峰面积为纵坐标,相应浓度为横坐标,绘制各嘌呤标准曲线,计算回归方程如下:鸟嘌呤,Y=34 544X+229.6(r=1,n=8);腺嘌呤,Y=49 080X-246.72(r=0.999,n= 8);次黄嘌呤Y=42 392X+818.4(r=0.999,n=8);黄嘌呤,Y=26 694X-144.77(r=0.999,n=8)。各嘌呤在0.01~20 μg·mL-1范围内呈良好线性关系,最低检测限为0.01 μg·mL-1。
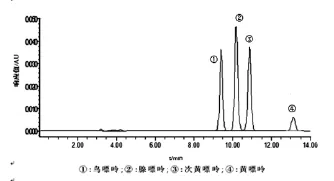
图1 标准品色谱图
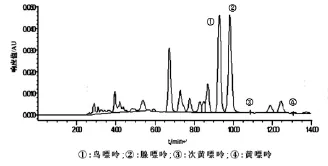
图2样品色谱图
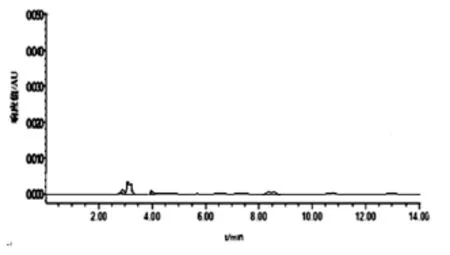
图3 阴性对照色谱图
2.3 稳定性试验结果 样品处理后分别在0、4、8、12 h进样,4种嘌呤峰面积的RSD依次为1.88%、1.82%、12.40%、11.38%,处理液在12 h内稳定。
2.4 重复性试验结果 精确称取样品6份,按样品处理方法操作进样,样品中4种嘌呤峰面积的RSD依次为1.90%、1.26%、6.01%、4.98%,重复性良好。
2.5 精密度试验结果 平行测定6次,测定4种嘌呤峰面积RSD为依次为1.37%、1.33%、5.20%、4.50%,精密度测试良好,符合要求。
2.6 回收率试验结果 测定样品的平均回收率依次为94.3%、99.43%、90.82%、97.15%,测定峰面积RSD依次为4.2、2.8、4.6、1.8。加样回收结果见表1。
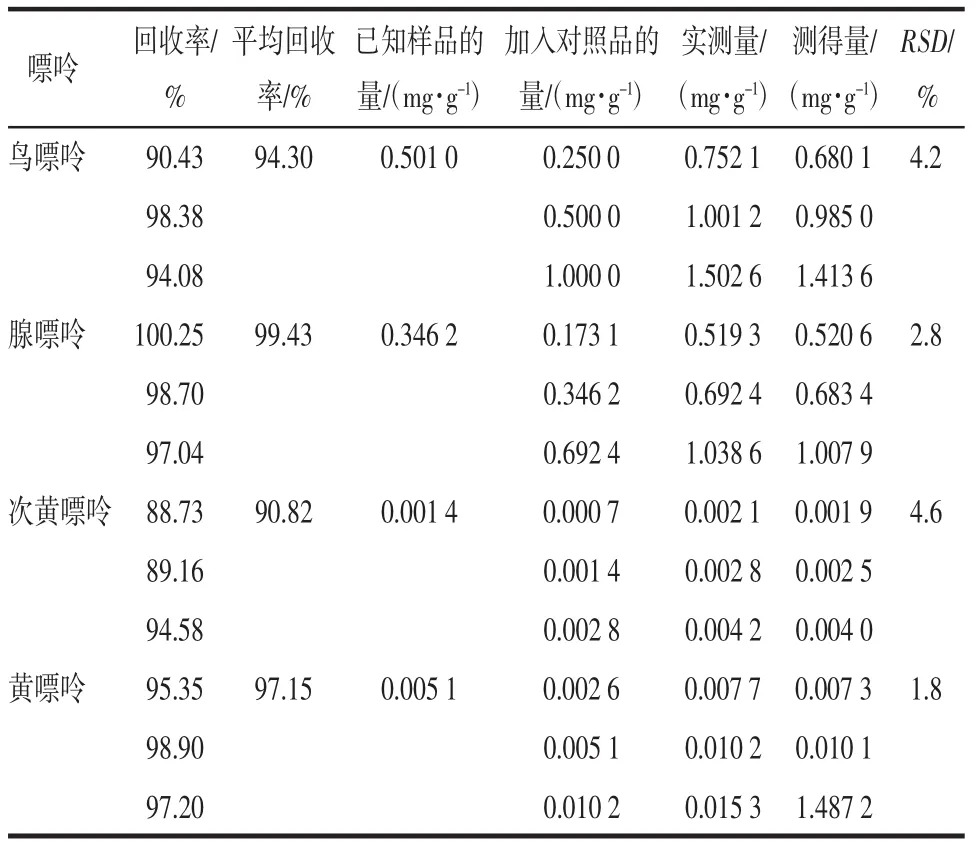
表1 回收率试验结果
2.7 样品含量测定结果 称取0.1 g样品处理后,按“1.2.1”条件进行测定,测得的峰面积带入回归方程,结果显示该饲料中鸟嘌呤含量为0.501 0 mg·g-1,腺嘌呤0.326 2 mg·g-1,次黄嘌呤0.001 4 mg·g-1,黄嘌呤0.005 1 mg·g-1。
3 讨论
3.1 饲料中嘌呤含量测定意义 随着饮食结构的改变,高尿酸血症和痛风的发病率正逐年上升,研究表明膳食和营养因素在痛风患者的发生、治疗中都有着重要作用。为阐明二者之间的关系,许多学者做出了研究:周道远[4]、徐慧静[5]使用饲料中添加氧嗪酸钾盐或酵母浸粉的方法,在2~3周内建立高尿酸血症模型,通过在饲料中加入不同剂量海参皂苷进行比较,发现低剂量和高剂量组可抑制肝脏黄嘌呤氧化酶、腺苷脱氨酶活性,改善高尿酸血症;台湾学者发现酪蛋白联合红花籽油饲喂大鼠有减轻高尿酸血症肾损害的作用,大豆蛋白联合红花籽油饲喂大鼠可降低血清尿酸和胆固醇[6],但尚无法定量明确饲料中的嘌呤含量与高尿酸血症的关系。故本试验建立高尿酸血症动物模型饲料中嘌呤含量检测方法,对于明确痛风、高尿酸血症等疾病动物模型的病因以及膳食预防和治疗有重要意义。
3.2 测定方法的选择 食品中嘌呤测量主要有高效液相色谱法[3,7]、毛细管电泳法[8]、气相色谱法[9]、偶联酶催化分光光度法[10]、液相色谱法、离子色谱法等。毛细管电泳法灵敏度低;气相色谱法用于单一组分测定,且需与质谱联用确定结果;本试验对于饲料中多嘌呤进行定量检测,未涉及酶催化,故选用高效液相色谱法。
3.3 流动相的选择 考虑到4种嘌呤的柱效和分离情况,曾选择甲醇-水(1∶1)、甲醇-水(5∶95)为流动相,结果次黄嘌呤和鸟嘌呤不能分离;选择磷酸二氢钾(pH3.6)为流动相,4种峰能够完全分离,出峰顺序是鸟嘌呤、次黄嘌呤、黄嘌呤、腺嘌呤,出峰时间依次为11.4、11.9、13.8、16.9 min,与凌云等[11]的研究结果相同;选择甲酸铵-甲醇(99∶1)为流动相,4种峰分离度好,出峰顺序是鸟嘌呤、腺嘌呤、次黄嘌呤、黄嘌呤,出峰时间依次为9.7、10.5、11.5、13.6 min,保留时间均短于甲醇、磷酸二氢钾[11-12]。故本试验选用甲酸铵-甲醇(99∶1)作为流动相不仅能够将4种峰有效分离,峰形良好,且保留时间较短,适用于批量检测。
3.4 样品水解条件的确定 食品中的4种嘌呤是以碱基形式存在于核酸中,故需经水解成嘌呤碱基再进行分析。常见的水解方法有高氯酸100℃水解[13],V(三氟乙酸)∶V(甲酸)∶V(去离子水)=3∶3∶1水解。后者常在100℃水解14~35 min后经旋转蒸发仪干燥,再经流动相超声溶解,Lou[14]发现漂洗步骤会使嘌呤总量下降60%,且该方法步骤较繁琐,对操作要求高,故本试验采用高氯酸水解的方法。按高氯酸的不同浓度(70%、80%、90%)、不同水解时间(30、45、60、75 min)水解样品,进样检测结果70%高氯酸100℃水解60 min所得总嘌呤含量最高,精密度、回收率都符合要求,可以推广使用。
本试验得到了定量检测饲料中4种嘌呤的检测方法,通过对流动相的选择、样品前处理不同条件的测试,得到了高效液相色谱法测定饲料中嘌呤的色谱条件。
[1] Amorini A M,Petzold A,Tavazzi B,et al.Increase of uric acid and purine compounds in biological fluids of multiple sclerosis patients [J].Clin Biochem,2009,42(10/11):1001
[2]刘佳,李玲.高尿酸血症的发病机制与药物治疗研究进展[J].国际药学研究杂志,2010,37(1):24
[3]潘洪志,荣胜忠,邹立娜,等.高效液相色谱法检测食品中嘌呤含量的方法研究[J].中国食品卫生杂志,2012,24(2):124
[4]周道远,陈敏,刘岩.不同造模剂诱导大鼠高尿酸血症模型的可行性比较[J].中国比较医学杂志,2012,22(10):23
[5]徐慧静,张灏,刘春花,等.摄食海参皂苷对小鼠高尿酸血症的影响[J].中国药理学通报,2011,27(8):1064
[6] Lo H C,Wang Y H,Ying C H,et al.Relative efficacy of casein or soya protein combined with palm or safflower-seed oil on hyperuricaemia in rats[J].Br J Nutr,2010,104(1):67
[7]陆春梅,于维森,于红卫.高效液相色谱法测定啤酒中4种嘌呤物质[J].中国卫生检验杂志,2012(10):2335
[8]赵云莎,黄均明,姜静,等.毛细管电泳金纳米粒子催化化学发光法测定黄嘌呤[J].分析实验室,2009:28(增刊):200
[9] Hamberg M,Zhang L Y.Quantitative determination of 8-hydroxyguanine and guanine by isotope dilution mass spectrometry [J].Anal Biochem,1995,229(2):336
[10]李忠琴,邬敏辰,许小平,等.偶联酶催化分光光度法测定黄嘌呤[J].化学通报:网络版,2007,7(1):1
[11]凌云,王新宴,雍炜,等.高效液相色谱法检测肉类食品中4种嘌呤碱[J].分析化学,2008,36(6):724
[12]程庆红,张颖,孟凡艳,等.高效液相色谱法测定虾仁和牡蛎中嘌呤类物质[J].应用化工,2013,42(10):1923
[13]Rong S Z,Zou L N,Zhang Y N,et al.Determination of purine contents in different parts of pork and beef by high performance liquid chromatography[J].Food Chem,2015,170 303
[14]Lou S N,Huang C H,Hsu P Y,et al.Changes in purine content of tilapia surimi products during processing[J].Fisheries Sci,2005,71 (4):889
(2015-05-21收稿)
R589
A
1006-8147(2015)06-0530-03
国家自然科学基金资助项目(81302422)
崔博(1989-),女,硕士在读,研究方向:营养与慢性病;通信作者:王璇,E-mail:wangxuan@tmu.edu.cn。

