miR-125b甲基化在同型半胱氨酸促进血管平滑肌细胞增殖中的作用
刘现梅,曹成建,田 珏,赵 丽,孔繁琪,周龙霞,陈久凯,王艳华,杨晓玲,贾月霞,姜怡邓(宁夏医科大学.基础医学院、.检验学院,宁夏银川 750004)
miR-125b甲基化在同型半胱氨酸促进血管平滑肌细胞增殖中的作用
刘现梅1,曹成建2,田珏1,赵丽2,孔繁琪1,周龙霞1,陈久凯2,王艳华2,杨晓玲1,贾月霞1,姜怡邓1
(宁夏医科大学1.基础医学院、2.检验学院,宁夏银川750004)
中国图书分类号: R322.74; R329.24; R341.7; R543.5; R977. 4
摘要:目的探讨同型半胱氨酸(homocysteine,Hcy)促进血管平滑肌细胞增殖中miR-125b甲基化的作用。方法原代培养人脐静脉平滑肌细胞(VSMCs),并分为空白对照组(0 μmol·L-1Hcy),不同浓度Hcy干预组(50、100、200及500 μmol·L-1Hcy),以荧光定量PCR(qRT-PCR)法检测miR-125b的表达变化;利用miR-125b前体和抑制剂转染VSMCs 后MTT法检测细胞增殖活性;生物信息学分析miR-125b启动子区CpG岛分布情况,巢式降落式甲基特异性PCR(nt-MSP)法检测miR-125b甲基化状态的变化;并利用DNA甲基化酶抑制剂5-氮杂胞苷(AZC)干预细胞后再次检测miR-125b的表达。结果与对照组相比,100,200及500 μmol· L-1Hcy可使miR-125b的表达水平降低,差异有显著性(P <0. 01); miR-125b前体可以抑制VSMCs增殖,而miR-125b抑制剂可以促进VSMCs增殖(P<0. 01);以miR-125b基因上游3 700 bp作为研究对象,生物信息学分析发现miR-125b启动子区含有一个长度为792bp(1881-2672区域)的CpG岛,且在Hcy干预下miR-125b的甲基化水平增强(P<0. 01);而用AZC干预后,发现miR-125b表达上调,差异有显著性(P<0. 05)。结论Hcy可能通过下调miR-125b表达从而促进VSMCs增殖,可能通过上调miR-125b基因甲基化水平从而下调miR-125b表达。
关键词:同型半胱氨酸; miR-125b; DNA甲基化;血管平滑肌细胞;动脉粥样硬化;增殖网络出版时间:2015-6-5 11:22
网络出版地址: http://www.cnki.net/kcms/detail/34.1086.R.20150605.1122.027.html
姜怡邓(1974-),男,博士,教授,研究方向:心血管病理生理学,通讯作者,Tel: 0951-6980998,E-mail: jwcjyd @ 163.com
同型半胱氨酸(homocysteine,Hcy)是动脉粥样硬化(atherosclerosis,AS)的独立危险因子[1],Hcy可通过促进血管平滑肌细胞(vascular smooth musclecells,VSMCs)增殖而影响AS的发生发展[2-3],但Hcy促进VSMCs增殖的机制尚不完全清楚。microRNA(miRNA)参与了多种细胞的增殖、凋亡、分化等过程,其中,miR-125b是动脉平滑肌细胞主要表达的miRNA之一[4],而且在某些VSMCs增殖为特征的病变组织中miR-125b的表达与正常组织中差异存在显著性[5]。但Hcy是否通过影响miR-125b的表达而促进VSMCs增殖未见报道。研究表明,Hcy可通过影响基因启动子区甲基化程度而影响基因表达,因此本研究拟探讨Hcy是否通过改变miR-125b基因启动子区甲基化水平从而影响miR-125b的表达,进而促进VSMCs增殖。
1 材料与方法
1.1主要试剂和仪器DMEM培养基、胎牛血清、胰酶(Hyclone公司);逆转录试剂盒及荧光定量PCR试剂盒(Fermentas公司); TRIzol试剂(Invitrogen公司); DNA抽提试剂盒(北京百泰克); DNA甲基化修饰试剂盒(美国ZYMO RESEARCH);鼠抗人α-平滑肌肌动蛋白单克隆抗体(北京中杉金桥)。引物由上海生工生物工程公司合成。PCR仪(美国Eppendorf公司);电泳仪及凝胶成像系统(BIO-RAD公司)。
1.2方法
1.2.1原代血管平滑肌细胞培养新鲜脐带取自宁夏医科大学附属医院产科健康足月剖腹产胎儿,取脐静脉进行血管平滑肌细胞的原代培养。首先,将剖宫产术后胎儿的脐静脉取下后,放入加有双抗(100 kU·L-1青霉素、1×105g·L-1链霉素)的DHank's液中。剥离血管外膜及结缔组织,将血管中膜部分留下,再沿着血管方向将其剪开,用棉签轻轻擦拭上表面,将内膜拭去后将之放入另一培养皿中,滴少量DMEM(含F12)培养液,将血管条切成1 mm2的小组织块,然后转进培养瓶内培养。待原代细胞生长至0. 7~0. 9时,用胰酶消化传代,选取生长良好的第3~7代细胞用于实验。培养液为含体积分数为0. 1胎牛血清的DMEM/F-12培养基,置于37℃,饱和湿度体积分数为0. 05 CO2培养箱培养。并将细胞分为空白对照组(0 μmol·L-1Hcy),不同浓度Hcy干预组(50、100、200及500 μmol· L-1Hcy)。
1.2.2荧光定量PCR(qRT-PCR)检测miR-125b的表达按照试剂盒说明书提取总miRNA,之后逆转录为cDNA,以此为模板进行荧光定量PCR检测miR-125b的表达; miR-125b引物序列:上游5'-GGGTCCCTGAGACCCTAACTTGT-3',下游5'-GCTGTCAACATACGCT ACGTA-3',扩增产物78 bp;反应条件:94℃预变性3 min,94℃变性30 s,57℃退火30 s,72℃延伸30 s,35次循环。以U6为内参照,根据PCR仪自动生成的Ct值,根据公式计算目的基因的相对量:相对表达量=2-△△Ct。
1.2.3巢式降落式甲基化特异性PCR(ntMS-PCR)检测miR-125b DNA甲基化程度根据DNA提取试剂盒说明书提取基因组DNA,用亚硫酸盐修饰法对DNA进行修饰,设计外引物、甲基化引物(M)及非甲基化引物(U),miR-125b外引物上游: 5' GGATGGTGTTATAGGAGGTTGTG-3',下游: 5'-CTCTTTCCCCCAAAACAAATATAC-3',产物长度为445 bp; M上游: 5'-GATGGTGTTATAGGAGGTTGTGC-3',下游: 5'-AAAAAACCAAAAAATAAAATTCGAA-3'; U上游: 5'-GATGGTGTTATAGGAGGTTGTGTG-3',下游: 5'-AAAAAACCAAAAAATAAAATTCAAA-3'。反应条件: 94℃预变性5 min,然后采用降落式PCR程序,30个循环,再于恒定的退火温度下进行20个循环,最后72℃再延伸10 min,甲基化产物与非甲基化产物均为117 bp,反应后取终产物,在2%琼脂糖凝胶电泳,分析光密度,按如下公式进行结果的计算:甲基化/% = OD甲基化/(OD甲基化+ OD非甲基化)×100%。
1.2.4 MTT法检测平滑肌细胞增殖活性0. 25%胰蛋白酶消化VSMCs,用含10%胎牛血清的完全培养基稀释成单细胞悬液,以每孔103~104的密度接种于96孔培养板中,每孔终体积200 μL。继续培养待细胞进入对数生长期后,将血清含量降至5%继续培养24 h,以同步化细胞。然后以Lip2000转染miR-125b各组分,后继续培养48 h。每孔加入20 μL MTT试剂(PBS稀释为质量浓度5 g·L-1),避光培养4 h,每孔换为150 μL DMSO,在摇床上摇动15 min后,490 nm检测波长下用酶标仪检测各孔吸光度(optical density),计算抑制率。抑制率/% =(1-实验组测定值/空白对照组测定值)×100%。以时间为横轴,细胞生长抑制率为纵轴,绘制细胞生长曲线。利用酶标仪测定各孔光吸收值,记录并分析结果。
2 结果
2.1 Hcy对miR-125b表达的影响qRT-PCR法检测各组VSMCs中miR-125b的表达,结果显示,Hcy干预各组miR-125b表达下调,但并不呈剂量依赖关系,在100 μmol·L-1Hcy处作用最明显,与对照组比较差异有统计学意义(P<0. 01),50 μmol Hcy组差异虽无统计学意义,但有下降趋势,见Fig 1。
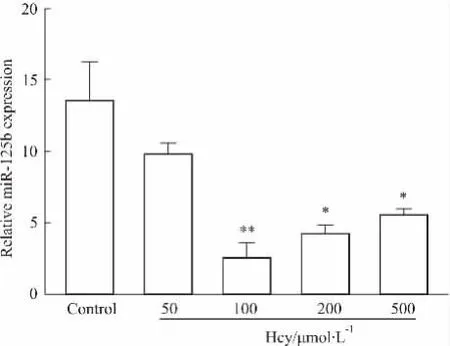
Fig 1 Different concentrations of Hcy inhibited expression of miR-125b*P<0. 05,**P<0. 01 vs control group
2.2 miR-125b对细胞增殖的影响利用miR-125b前体和抑制剂分别转染VSMCs,两者的终浓度为100 nmol·L-1。然后利用MTT法检测细胞增殖活性。结果发现转染pEZX-miR125b可以抑制VSMCs增殖,而转染miR-125b inhibitor却促进VSMCs增殖,差异均有统计学意义(P<0.01),见Fig 2。

Fig 2 MiR-125b infected proliferative activity of vascular smooth muscle**P<0.01 vs control group
2.3 miR-125b生物信息学分析利用生物信息学软件CpG island searcher分析miR-125b启动子区CpG岛,选取miR-125b基因上游3 700 bp作为研究对象,发现miR-125b启动子区含有一个长度为792bp(1881-2672区域)的CpG岛,提示miR-125b基因很可能受到甲基化的调控,见Fig 3。
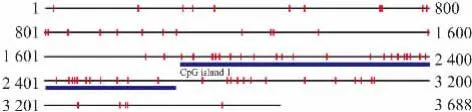
Fig 3 Bioformatics analysis of miR-125b
2.4 Hcy对miR-125b启动子区甲基化程度的影响用Hcy干预的各组细胞,利用ntMS-PCR法检测miR-125b甲基化程度变化,如Fig 4所示,不同浓度Hcy干预后,miR-125b启动子区发生高甲基化变化,但并不呈剂量依赖关系,在100 μmol·L-1组作用最明显,与对照组相比,差异有显著性(P<0. 01),见Fig 4。
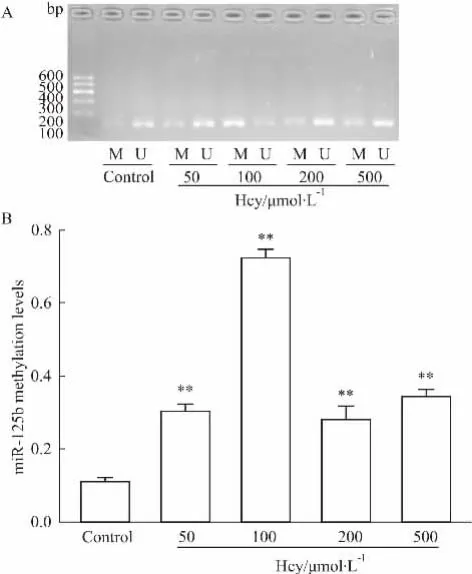
Fig 4 Hcy induced change of miR-125b DNA methylation levelM: Methylated production; U: Unmethylated production.**P<0. 01 vs control.
2.5 AZC干预后miR-125b表达水平变化根据上述实验结果,选取100 μmol·L-1Hcy干预VSMCs,在加入DNA甲基转移酶抑制剂5-氮杂胞苷(AZC)10 nmol·L-1后,再次检测miR-125b表达,结果显示AZC组与100 μmol·L-1Hcy干预组相比miR-125b表达水平升高(P<0. 05),提示miR-125b的表达受到甲基化的调控,见Fig 5。

Fig 5 Change of miR-125b expression after AZC intervention*P<0. 05 vs 100 μmol·L-1Hcy group
3 讨论
本研究结果显示,Hcy可降低VSMCs的miR-125b表达; miR-125b前体可抑制VSMCs增殖,抑制miR-125则促进VSMCs增殖; Hcy干预VSMCs后miR-125b启动子区发生高甲基化变化,而加入DNA甲基化酶抑制剂AZC后,miR-125b表达升高。
microRNA(miRNA)是一类长度只有21nt左右的内源性非编码单链RNA,是近年来基因转录后水平调控的研究热点。研究表明,miRNA虽然大约只占人类预测基因的3%以上,但却调控大约30%的蛋白编码基因,参与多种细胞的增殖、凋亡、分化等过程[6]。不同组织和细胞具有特异性的miRNAs,如miR-223在造血系统特异性表达,miR-1、miR-30c 和miR-26等在心肌细胞中特异表达[7];而动脉血管平滑肌细胞主要表达的miRNA为miR-125b、miR-145等[4]。miR-125b不仅在不同的正常组织中表达不同,在正常组织与病理组织中的表达也存在明显差异,如Ruirui等[5]利用基因芯片的技术,检测了球囊损伤诱导的血管新生内膜形成模型中颈动脉microRNA的表达,发现miR-125b的含量下调。VSMCs增殖是血管新生内膜形成的关键分子事件[8],提示miR-125b可能在血管功能中发挥重要作用,并可能调控VSMCs的增殖。本实验检测Hcy干预下的VSMCs中miR-125b的表达,发现其水平降低;而转染miR-125b的前体(通过细胞内生物学过程表达miR-125b)或抑制剂后检测VSMCs细胞增殖活性,发现其前体可以使细胞增殖活性下降,而其抑制剂可以使细胞增殖活性升高。综合以上结果,提示Hcy可通过下调miR-125b的表达而促进VSMCs的增殖。
为了进一步明确Hcy下调miR-125b的表达的机制,我们检测了miR-125b的甲基化水平。DNA甲基化是表观遗传范畴的重要内容之一,所谓DNA甲基化是指在DNA甲基化转移酶的催化下,将甲基转移到CpG二核苷酸5'胞嘧啶的第5位碳原子上的过程[9]。DNA甲基化研究最早在肿瘤中开展,而近年关于DNA甲基化在AS中的作用越来越受到关注。在AS形成中,国内外先后报道了LDL受体等[10]的DNA甲基化改变。本课题组前期研究在人脐静脉细胞培养的过程中加入不同浓度的Hcy培养过程中也观察到全基因组、ApoE等基因的甲基化改变[11-12]。一般情况下,DNA的甲基化会使基因表达沉默,而去甲基化则激活基因的表达[13]。近年研究表明,DNA甲基化也可以影响miRNA的表达,如Kong等[14]研究表明,DNA甲基化可以导致miR-375表达水平改变,其高甲基化会引起miR-375下调。Hashimoto等[15]研究发现,在胃癌的组织和细胞中miRNA-181c基因出现高甲基化变化,其表达降低,且甲基化是发生在miRNA-181c基因的CpG岛上,而用甲基转移酶抑制剂5-氮杂胞苷(AZC)处理胃癌细胞可以使microRNA-181c的表达上调,并抑制胃癌细胞的生长增殖。本实验通过生物信息学分析发现,miR-125b启动子区存在CpG岛,表明miR-125b具有受甲基化调控的结构基础;检测Hcy干预下的VSMCs中miR-125b甲基化水平,发现其甲基化程度上调;而我们用AZC干预后再次检测miR-125b的表达,发现其表达上调,提示Hcy可能通过使miR-125b DNA高甲基化从而抑制其表达。
综上所述,本研究结果表明,Hcy可能通过上调miR-125b基因甲基化水平,进而下调miR-125b表达,从而促进VSMCs增殖。这一发现为进一步揭示Hcy致AS发生发展的机制提供了新思路,为AS的防治提供了新的治疗靶点。
参考文献:
[1]Bednarek-Tupikowska G,Tworowska-Bardzinska U,Tupikowski K,et al.The correlations between endogenous dehydroepiandrosterone sulfate and some atherosclerosis risk factors in premenopausal women[J].Med Sci Monit,2008,14(1): CR37-41.
[2]Kartal O N,Taha S,Azzi A.Homocysteine induces DNA synthesis and proliferation of vascular smooth muscle cells by interferingwith MAPK kinase pathway[J].Biofactors,2005,24:193.
[3]董燕燕;陈光亮.高同型半胱氨酸血症危害及致病机制研究进展[J].中国药理学通报,2014,30(9):1205-8.
[3]Dong Y Y,Chen G L.Progress of hyperhomocysteinemia hazard and pathogenesis[J].Chin Pharmacol Bull,2014,30(9):1205-8.
[4]Hébert S S.Putative role of microRNA-regulated pathways in comorbid neurological and cardiovascular disorders[J].Cardiovasc Psychiatry Neurol,2009,24(34): 5848-56.
[5]Ruirui J,Cheng Y,Yue J,et al.MicroRNA expression signature and antisense-mediated depletion reveal an essential role of microRNA in vascular neointimal lesion formation[J].Circ Res,2007,100:1579-88.
[6]Carthew R W.Gene regulation by microRNAs[J].Curr Opin Genet Dev,2006,16(2):203-8.
[7]Iorio M V,Croce C M.MicroRNAs in cancer: small molecules with a huge impact[J].J Clin Oncol,2009,27(34): 5848-56.
[8]Liu X,Cheng Y,Zhang S,et al.A necessary role of miR-221 and miR-222 in vascular smooth muscle cell proliferation and Neointim[J].Circ Res,2009,104(4):476-87.
[9]Goldberg A D,Allis C D,Bernstein E.Epigenetics: a landscape takes shape[J].Cell,2007,128(4): 635-8.
[10]Huang Y,Peng K,Su J,et al.Different effects of homocysteine and oxidized low density lipoprotein on methylation status in the promoter region of the estrogen receptor alpha gene[J].Acta Biochim Biophys Sin(Shanghai),2007,39(1):19-26.
[11]Yideng J,Jianzhong Z,Ying H,et al.Hyperhomocysteinemiamediated globe DNA Hypomethylation and its potential Epigenetic mechanism in rats[J].Acta Biochim Biophys Sin,2007,39(6): 392-403.
[12]Yi-Deng J,Tao S,Hui-Ping Z,et al.Folate and ApoE DNA methylation induced by homocysteine in human monocytes[J].DNA Cell Biol,2007,26(10):737-44.
[13]Portela A,Esteller M.Epigenetic modifications and human disease [J].Nat Biotechnol,2010,28:1057-68.
[14]Kong K L,Kwong D L,Chan T H,et al.MicroRNA-375 inhibits tumour growth and metastasis in oesophageal squamous cell carcinoma through repressing insulin-like growth factor 1 receptor[J].Gut,2012,61(1):33-42.
[15]Hashimoto Y,Akiyama Y,Otsubo T,et al.Involvement of epigenetically silenced microRNA-181c in gastric carcinogenesis[J].Carcinogenesis,2010,31(5):777-84.
Role of homocysteine to promote the vascular smooth muscle cell proliferation by MiR-125b methylation
LIU Xian-mei1,CAO Cheng-jian2,TIAN Jue1,ZHAO Li2,KONG Fan-qi1,ZHOU Long-xia1,CHEN Jiu-kai2,WANG Yan-hua2,YANG Xiao-ling1,JIA Yue-xia1,JIANG Yi-deng1
(1.Preclinical Medicine College; 2.Inspection College,Ningxia Medical University,Yinchuan 750004,China)
Abstract:Aim To investigate the role of miR-125b and its DNA methylation in homocysteine(Hcy)-induced vascular smooth muscle cells(VSMCs)proliferation.Methods VSMCs were stimulated with 0,50,100,200,500 μmol·L-1Hcy respectively.Then qRT-PCR was used to detect the mRNA levels of miR-125b,and nested-touchdown methylation-specific PCR(ntMS-PCR)was used to detect the methylation levels of miR-125b.VSMCs were transfected with miR-125b precursor or the inhibitor of miR-125b,then 3-(4,5-dimethylthiazol-2-yl)-2-5-diphenyl tetrazolium bromide(MTT)assay was used to reflect the proliferation of VSMCs.The distribution of CpG islands of miR-125b promoter region was analyzed by bioinformatics methods.VSMCs were stimulated with 100 μmol·L-1Hcy and transfected with or without DNA methylation inhibitors 5-nitrogen impurity cytidine(AZC),then the expression of miR-125b was detected by qRT-PCR.Results The mRNA levels of miR-125b were decreased in 100,200,500 μmol·L-1Hcy group compared with 0 μmol·L-1Hcy group.The precursor of miR-125b could inhibit the proliferation activity and the inhibitor of miR-125b could increase the proliferation activity of VSMCs cells.Bioinformatics analysis indicated that MiR-125b promoter region had a CpG island whose length was 792 bp(1881-2672).The miR-125b promoter region methylation levels increased after Hcy intervention(P<0. 01).The expression level of miR-125b increased after AZC intervention(P<0. 05).
Conclusions①Hcy promotes vascular smooth muscle cell proliferation maybe by down-regulating the expression of miR-125b.②Hcy down-regulates the expression of miR-125 maybe by up-regulating the methylation levels of miR-125b promoter region.
Key words:homocysteine; miR-125b; DNA methylation; vascular smooth muscle cell; atherosclerosis; proliferation
作者简介:刘现梅(1986-),女,硕士生,研究方向:动脉粥样硬化病理生理学,E-mail: meiziliu1413@163.com;
基金项目:国家自然科学基金资助项目(No 81360027,81360052,81360053)
收稿日期:2015-01-05,修回日期:2015-03-02
文献标志码:A
文章编号:1001-1978(2015)07-1023-05
doi:10.3969/j.issn.1001-1978.2015.07.027

