线粒体损伤与修复在帕金森病中的作用
邓 婕,李怡芳,栗原博,何蓉蓉(暨南大学抗应激健康研究中心,药学院,广东广州 510632)
线粒体损伤与修复在帕金森病中的作用
邓婕,李怡芳,栗原博,何蓉蓉
(暨南大学抗应激健康研究中心,药学院,广东广州510632)
中国图书分类号: R-05; R329.24; R745.705
摘要:帕金森病(Parkinson’s disease,PD)是一种常见的中枢神经系统疾病,目前尚无有效的治疗方法。PD产生的原因有很多,包括遗传、环境、衰老等,这些因素导致黑质多巴胺能神经元退变有一共同过程:线粒体损伤与修复。该文综述了引起多巴胺能神经元线粒体功能损伤的环境因素和遗传因素,简述了线粒体修复途径(如自噬)对PD的治疗作用,进而从线粒体保护的角度分析天然药物治疗PD的研究现状。
关键词:帕金森病;线粒体损伤;线粒体自噬; Parkin; PINK1;心磷脂;天然药物网络出版时间:2015-6-5 11:22网络出版地址: http://www.cnki.net/kcms/detail/34.1086.R.20150605.1122.004.html
何蓉蓉(1983-),女,博士,副教授,博士生导师,研究方向:神经免疫药理学,通讯作者,Tel: 020-85227791,E-mail: rongronghe@ jnu.edu.cn
帕金森病(Parkinson’s disease,PD)是一种多发于中老年的神经系统退行性疾病,分为散发性和家族性两种。65岁以上的人群患病率约为2%,且其临床发病率有增高的趋势,严重危害了中老年人的身心健康,给家庭、社会带来巨大的负担。目前PD的机制尚不明确,许多研究表明,线粒体损伤在PD的发病机制中起了主要的作用[1]。中脑多巴胺能神经元的线粒体质量明显小于周围非多巴胺能神经元的线粒体质量,导致中脑多巴胺能神经元对线粒体功能障碍更为敏感[2]。到目前为止,对于PD的治疗药物以左旋多巴为主,但长期应用会出现明显的不良反应或不同程度药效减退。近年来,天然药物在PD治疗研究方面取得了一定的进展,本文通过综述PD线粒体损伤与修复的机制,旨在为开发预防和治疗PD的天然药物提供一定的科学依据。
1 线粒体损伤与帕金森病关系
1.1环境毒素引起的线粒体损伤与帕金森病的关系现有研究表明,导致PD的线粒体复合物Ⅰ抑制因素主要有环境因素和遗传因素[3]。环境因素是最早被关注的,最为常见的是环境毒素1-甲基-4-苯基-1,2,3,6-四氢蝶呤(MPTP)、鱼藤酮、百草枯和代森锰。MPTP是一种脂溶性神经毒剂,能够迅速通过血脑屏障,经代谢产生具有毒性作用的MPP+,当MPP+经多巴胺转运体进入多巴胺能神经元后,被线粒体主动摄取、浓集,特异性抑制复合物I,减少ATP生成而使能量耗竭,同时增加活性氧的生成。此外,MPP+会降低体外线粒体活性和基因的表达,体内给予MPTP后可以观察到线粒体基因表达和酪氨酸羟化酶的表达下降[4]。MPP+进入线粒体,作用于线粒体复合物Ⅰ,导致细胞异常改变,例如DNA断裂,从而激活一系列和细胞死亡有关的通路,包括p53和JNK/c-jun信号通路的激活,可以诱导和转移Bax到线粒体。Bax的转移可以促进细胞色素C和凋亡促进因子从线粒体转移到细胞质。在细胞质中,细胞色素C参与了半胱天冬酶依赖性的细胞凋亡途径。
杀虫剂鱼藤酮是一种从植物根中提取出来的天然产物,被人们认为是安全的“天然农药”,广泛应用于农业上。但是,有研究发现鱼藤酮会引起中毒的症状,接近于人PD的症状。小剂量鱼藤酮介导的大鼠PD模型中,存在线粒体膜去极化、caspase-3激活和DNA断裂,这些都和多巴胺能神经元死亡有关[5]。有研究发现鱼藤酮对PC12细胞具有毒性作用,可以诱导细胞凋亡,其机制可能与降低线粒体膜电位有关[6]。
百草枯是农业中广泛使用的一种除草剂,可以导致黑质致密部多巴胺能神经元的选择性变性,产生PD重要的病理特征。有研究表明,长期给予百草枯可以抑制线粒体复合物Ⅰ,诱导产生ROS,进一步导致多巴胺能神经元缺失。百草枯聚集在线粒体,作为强有效的氧化还原循环物质,能将和氧分子相互作用的自由基转化为超氧化物和其他ROS。百草枯还可以通过与谷氨酸盐相互作用增加ROS的生成,这一过程会生成一氧化氮合酶(NOS),使NO进入多巴胺能神经元,导致进一步的线粒体损伤[7]。
代森锰被用作杀菌剂,可用于多种植物疾病治疗。但是有研究发现,代森锰和人类PD的发展有关,代森锰能够抑制体内蛋白酶体的活性,抑制呼吸链中的线粒体复合物Ⅲ,导致ROS的生成从而损伤线粒体,可能会增加人类患PD的风险[8]。由上述可知,环境毒素引起的线粒体损伤如Tab 1所示。
1.2遗传因素引起的线粒体损伤与帕金森病的关系据调查5%~10%的PD患者是家族性帕金森病,其发病与α-synuclein、PINK1、Parkin、DJ-1等基因突变有关。α-synuclein表达于中枢神经系统,其突变体在PD患者的路易体中广泛存在,易于聚集,难以被蛋白酶体降解。蛋白质聚合和线粒体损伤在PD的发病机制中是相互联系和相互补充的。在携

Tab 1 Mitochondrial damage caused by environmental toxins

Tab 2 Mitochondrial damage in familial parkinson's disease
带有突变的α-synuclein基因的小鼠中,a-synuclein在线粒体的积累伴随着线粒体退化,涉及mtDNA损伤、线粒体复合物Ⅳ损伤[9]。除此之外,线粒体中α-synuclein聚集会降低线粒体复合物Ⅰ的活性[10]。
目前研究发现,PINK1和Parkin在维持线粒体完整性和功能上有重要作用[11]。在增殖的SH-SY5Y细胞中,Parkin特定于线粒体,连接线粒体转录因子(TFAM),调节线粒体转录和复制[12]。此外,Parkin可以被募集到受损线粒体,对线粒体动力学和自噬至关重要[13]。研究表明小鼠中过表达Parkin,可以通过保护线粒体和减少α-synuclein从而减弱MPTP介导的多巴胺能神经细胞缺失[14]。但是小鼠缺乏Parkin基因会增加机体对线粒体毒素如鱼藤酮的敏感性[15]。
家族性帕金森病和线粒体之间还存在更直接的联系,如PINK1突变的发现。PINK1敲低人多巴胺能神经元和PINK1敲除小鼠的主神经元中PINK1缺失能导致广泛的线粒体损伤,包括线粒体形态异常、膜电位降低和ROS产生[16]。而PINK1过表达能恢复正常的线粒体形态、抑制ROS的产生,表明PINK1在维持线粒体形态和保护线粒体免受ROS攻击方面有重要作用[17]。然而,PINK1敲除小鼠在线粒体蛋白中表现出区域依赖性改变,这些线粒体蛋白和能量代谢以及中脑、纹状体和大脑皮层膜电位有关,特别在中脑区表现出线粒体损伤的高翻转性[18]。此外,在PINK1突变的帕金森病病人成纤维母细胞中表现出线粒体呼吸异常和ATP合成缺陷[19]。
DJ-1蛋白在脑内高表达,部分位于线粒体。DJ-1缺失细胞又称为DJ-1裸细胞,研究表明,在DJ-1裸多巴胺能神经细胞中表现出线粒体复合物Ⅰ活性不足[20],DJ-1过表达可以部分逆转小鼠DJ-1裸细胞中的线粒体复合物Ⅰ活性降低[21]。Heo等[20]通过研究发现,线粒体复合物Ⅰ组成障碍和DJ-1裸细胞结构和功能异常可以被腺病毒介导的DJ-1过表达逆转,阐明了DJ-1在线粒体属性中的特异性,表明DJ-1突变诱导的线粒体缺陷可能是PD多巴胺能神经元退化的病理机制之一。研究发现DJ-1基因敲除小鼠表现出线粒体膜电位下降和渗透性转换孔开放的增加。除此之外,DJ-1基因敲除小鼠的体内细胞模型中出现线粒体呼吸受损、线粒体内ROS增加以及线粒体形态改变[22]。由上所述,遗传因素引起的PD中线粒体损伤如Tab 2所示。
2 线粒体自噬对帕金森病的保护作用
由以上分析可知引起线粒体功能损伤的因素众多,而通过自噬清除受损线粒体来保护多巴胺能神经元,是治疗PD的重要策略。神经元细胞需要依赖线粒体来维持结构和功能,通过自噬有效地清除受损线粒体可以保障线粒体稳态。大部分神经元线粒体分布于远端的树突和轴突,Parkin和PINK1介导了神经轴突受损线粒体的自噬[23]。此外,心磷脂(cardiolipin,CL)在线粒体自噬的分子识别过程中也起了重要的作用[24]。
2.1 Parkin、PINK1在线粒体自噬中的作用Parkin是一种E3泛素连接酶,通过介导底物蛋白的泛素化,调控蛋白降解和信号通路等。Parkin可以选择性的移位到线粒体膜电位下降的损伤线粒体,通过线粒体自噬清除受损线粒体。PINK1是一种帕金森病相关蛋白,正常线粒体中,PINK1蛋白存在于线粒体外膜,能够作为受损线粒体的感受器,其稳定性是Parkin募集到受损线粒体及激发线粒体自噬所必需的[25]。de Vries等[26]提出了PINK1和Parkin影响线粒体自噬的3个可能模式,一是调节线粒体融合和分裂的平衡,二是调整线粒体的运动性,三是直接招募自噬分子。研究进一步提出PINK1/Parkin在线粒体自噬中可能存在的现象。以Parkin募集到膜去极化之后PINK1依赖性线粒体上为开始,一是MFN1/2泛素化和降解,使得裂变替代融合。二是线粒体外膜蛋白如VDAC1泛素化被p62识别,自噬小泡上的LC3直接作用于p62从而形成自噬小体。综上所述,Parkin、PINK1在线粒体自噬中的作用机制如Fig 1所示。
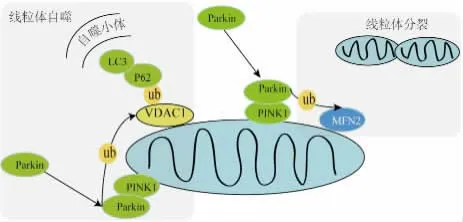
Fig 1 Role of Parkin and PINK1 in mitophagy
2.2心磷脂介导的线粒体自噬最新研究发现,线粒体内膜特有的CL外翻至线粒体外膜在线粒体自噬中发挥了重要的作用[27]。研究表明,在线粒体凋亡通路中CL主要与3种相关分子(Cyt·C、Bid和caspase-8)相互作用,发挥信号整合和级联传递作用[28]。研究发现介导自噬体形成的自噬蛋白LC3上有线粒体自噬(mitophagy)至关重要的CL连接位点。正常的线粒体中,CL位于线粒体内膜,当线粒体损伤时,很大一部分的CL转移到线粒体外膜,和自噬蛋白LC3相互作用,介导损伤线粒体选择性自噬的增加[29]。CL的重新分配很可能通过膜内外接触部位的自噬蛋白如Bid/tBid 和Bax相互作用而发生[30]。Bid通常存在于非活跃状态的胞质中,经caspase-8裂解之后,其羧基末端部分(tBid)从胞质转移到线粒体,诱导细胞色素C的释放。而CL介导tBid通过三螺旋域靶向线粒体。这些研究结果表明CL在细胞色素C释放的途径中起了一定的作用[31]。而细胞色素C从线粒体释放是自噬的一个主要特征。以上结果表明,CL的重新分配在神经元细胞中可作为损伤线粒体的自噬信号,对线粒体损伤引起的黑质神经元系统疾病PD有重要的作用。因此,CL介导的线粒体自噬及其调控元件是理想的PD药物干预靶点,其作用机制如Fig 2所示。

Fig 2 Cardiolipin-mediated mitochondrial mitophagy
3 从线粒体保护角度评价天然药物对帕金森病的治疗作用
3.1减少线粒体膜电位的丢失和活性氧的生成梓醇是一种环烯醚萜类的小分子化合物,对鱼藤酮所致小鼠脑线粒体损伤有保护作用。研究表明,梓醇能够提高小鼠复合酶Ⅰ活性,增加GSH的含量,减少膜电位的丢失和活性氧的生成,抑制LDH的释放,显示梓醇对鱼藤酮损伤小鼠脑线粒体具有保护作用[32]。此外,雷公藤醇在鱼藤酮介导的人多巴胺能损伤细胞中有一定的保护作用。有研究阐明了雷公藤醇能保护SH-SY5Y细胞避免鱼藤酮所致的细胞损伤和细胞凋亡,抑制鱼藤酮介导的线粒体膜电位缺失[33]。通过建立鱼藤酮损伤PC12细胞模型,采用黄芩苷进行药物干预,发现黄芩苷能明显减少鱼藤酮损伤PC12细胞的ROS含量[34]。
3.2维持线粒体结构和功能的稳定性研究发现,槲皮素对PD具有保护作用,其作用可能是通过与Bcl-2家族蛋白的相互作用产生,上调Bcl-2蛋白与下调Bax蛋白的表达来维持线粒体结构和功能的稳定性,发挥细胞凋亡主开关的作用[35]。白藜芦醇是从中药虎杖中提取的有效成分,具有神经保护等多种药理作用。PGC-1α是转录因子,可以作为线粒体功能和氧化代谢的主要调节器。白藜芦醇对早发型帕金森病人纤维母细胞的作用,发现白藜芦醇可以升高PGC-1α的目标基因的mRNA的表达来调节能量平衡[36]。
4 展望
近年来随着对线粒体结构和功能的深入研究,发现帕金森病的进行性发展和线粒体密切相关。引起线粒体损伤的因素众多,多巴胺能神经元中受损线粒体如果不能及时被清除,会引起多巴胺能神经细胞凋亡坏死,进而导致PD的发生。线粒体自噬是近年来PD治疗研究的热点,最新研究也表明CL介导的线粒体自噬及其调控元件可能是理想的PD药物干预靶点。从线粒体保护角度评价PD治疗作用的天然药物研究数量较多且结构多样,主要从调节线粒体膜电位和活性氧方面进行研究,目前仍缺乏天然药物针对线粒体自噬作用的研究。为此,在今后的研究工作中可以从线粒体自噬角度研究天然药物对PD的治疗作用。
对多数药物的单体或组分进行相应的生物学活性测定,通常能够得到不同程度的活性和治疗疾病的效果,但是目前尚未研制出临床上有效治疗PD的天然药物,其原因可能在于绝大多数天然化合物的生物活性不强、对靶点作用广泛,即非特异性作用明显。为此,在今后治疗PD的天然药物的研究工作中需要明确药物的作用靶点,对纯化的天然药物化合物可以通过结构修饰增强靶向性。
参考文献:
[1]Winklhofer K F,Haass C.Mitochondrial dysfunction in Parkinson's disease[J].Biochim Biophys Acta,2010,1802(1): 29-44.
[2]Liang C L,Wang T T,Luby-Phelps K,German D C.Mitochondria mass is low in mouse substantia nigra dopamine neurons: implications for Parkinson's disease[J].Exp Neurol,2007,203(2): 370-80.
[3]Dauer W,Przedborski S.Parkinson's disease: Mechanisms and models[J].Neuron,2003,39(6): 889-909.
[4]Piao Y,Kim H G,Oh M S,Pak Y K.Overexpression of TFAM,NRF-1 and myr-AKT protects the MPP+-induced mitochondrial dysfunctions in neuronal cells[J].Biochim Biophys Acta,2012,1820(5): 577-85.
[5]Xiong N,Long X,Xiong J,et al.Mitochondrial complex I inhibitor rotenone-induced toxicity and its potential mechanisms in Parkinson's disease models[J].Crit Rev Toxicol,2012,42(7): 613 -32.
[6]竺飞燕,张雄,王百辰,胡智伟.鱼藤酮诱导PC12细胞凋亡及线粒体膜电位变化[J].中国药理学通报,2014,30(2): 266-9.
[6]Zhu F Y,Zhang X,Wang B C,Hu Z W.Rotenone induces apoptosis of PC12 cells and alteration in mitochondrial membrane potential[J].Chin Pharmacol Bull,2014,30(2):266-9.
[7]Subramaniam S R,Chesselet M F.Mitochondrial dysfunction and oxidative stress in Parkinson's disease[J].Prog Neurobiol,2013,106: 17-32.
[8]Ritz B R,Manthripragada A D,Costello S,et al.Dopamine transporter genetic variants and pesticides in Parkinson’s disease [J].Environ Health Perspect,2009,117(6): 964-9.
[9]Martin L J,Pan Y,Price A C,et al.Parkinson's disease α-synu-clein transgenic mice develop neuronal mitochondrial degeneration and cell death[J].J Neurosci,2006,26(1): 41-50.
[10]Chesselet M F,Richter F,Zhu C,et al.A progressive mouse model of Parkinson’s disease: the Thy1-aSyn(“Line 61”)mice [J].Neurotherapeutics,2012,9(2): 297-314.
[11]Bueler H.Impaired mitochondrial dynamics and function in the pathogenesis of Parkinson's disease[J].Exp Neurol,2009,218(2): 235-46.
[12]Kuroda Y,Mitsui T,Kunishige M,et al.Parkin enhances mitochondrial biogenesis in proliferating cells[J].Hum Mol Genet,2006,15(6): 883-95.
[13]Sun Y,Vashisht A A,Tchieu J,et al.Voltage-dependent anion channels(VDACs)recruit Parkin to defective mitochondria to promote mitochondrial autophagy[J].J Biol Chem,2012,287(48): 40652-60.
[14]Bian M,Liu J,Hong X,et al.Overexpression of parkin ameliorates dopaminergic neurodegeneration induced by 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine in mice[J].PloS One,2012,7(6): e39953.
[15]Rosen K M,Veereshwarayya V,Moussa C E,et al.Parkin protects against mitochondrial toxins and beta-amyloid accumulation in skeletal muscle cells[J].J Biol Chem,2006,281(18): 12809-16.
[16]Wood-Kaczmar A,Gandhi S,Yao Z,et al.Pink1 is necessary for long term survival and mitochondrial function in human dopaminergic neurons[J].PloS One,2008,3(6): e2455.
[17]Wang H L,Chou A H,Wu A S,et al.PARK6 PINK1 mutants are defective in maintaining mitochondrial membrane potential and inhibiting ROS formation of substantia nigra dopaminergic neurons [J].Bioch Biophys Acta,2011,1812(6): 674-84.
[18]Diedrich M,Kitada T,Nebrich G,et al.Brain region specific mitophagy capacity could contribute to selective neuronal vulnerability in Parkinson's disease[J].Proteome Sci,2011,9(1): 1-19.
[19]Piccoli C,Sardanelli A,Scrima R,et al.Mitochondrial respiratory dysfunction in familiar parkinsonism associated with PINK1 mutation[J].Neurochem Res,2008,33(12): 2565-74.
[20]Heo J Y,Park J H,Kim S J,et al.DJ-1 null dopaminergic neuronal cells exhibit defects in mitochondrial function and structure: involvement of mitochondrial complex I assembly[J].PloS One,2012,7(3): e32629.
[21]Kwon H J,Heo J Y,Shim J H,et al.DJ-1 mediates paraquat-induced dopaminergic neuronal cell death[J].Toxicol Lett,2011,202(2): 85-92.
[22]Krebiehl G,Ruckerbauer S,Burbulla L F,et al.Reduced basal autophagy and impaired mitochondrial dynamics due to loss of Parkinson's disease-associated protein DJ-1[J].PloS One,2010,5(2): e9367.
[23]Ashrafi G,Schlehe J S,LaVoie M J,et al.Mitophagy of damaged mitochondria occurs locally in distal neuronal axons and requires PINK1 and Parkin[J].J Cell Biol,2014,206(5): 655-70.
[24]Chu C T,Ji J,Dagda R K,et al.Cardiolipin externalization to the outer mitochondrial membrane acts as an elimination signal for mitophagy in neuronal cells[J].Nat Cell Biol,2013,15(10): 1197-205.
[25]柏杖勇,李清华.Pink1/parkin,线粒体自噬与帕金森病[J].中国老年学杂志,2014,34(9): 2609-13.
[25]Bai Z Y,Li Q H.Pink1/parkin,mitophagy and Parkinson's disease[J].Chin J Gerontol,2014,34(9): 2609-13.
[26]de Vries R L,Przedborski S.Mitophagy and parkinson's disease: Be eaten to stay healthy[J].Mol Cell Neurosci,2013,55: 37-43.
[27]Kagan V E,Epand R M.Deciphering the mysteries of cardiolipins in mitochondria[J].Chem Phys Lipids,2014,179: 1-2.
[28]Youle R J,Karbowski M.Mitochondrial fission in apoptosis[J].Nat Rev Mol Cell Biol,2005,6(8): 657-63.
[29]Chu C T,Bayir H,Kagan V E.LC3 binds externalized cardiolipin on injured mitochondria to signal mitophagy in neurons: implications for Parkinson disease[J].Autophagy,2014,10(2): 376-8.
[30]Kim T H,Zhao Y,Ding W X,et al.Bid-cardiolipin interaction at mitochondrial contact site contributes to mitochondrial cristae reorganization and cytochrome C release[J].Mol Biol Cell,2004,15(7): 3061-72.
[31]Lutter M,Fang M,Luo X,et al.Cardiolipin provides specificity for targeting of tBid to mitochondria[J].Nat Cell Biol,2000,2(10): 754-61.
[32]石桂芳,王贺双,毛玉荣,等.梓醇对鱼藤酮所致小鼠脑线粒体损伤的保护作用[J].现代生物医学进展,2012,12(29): 5661-4.
[32]Shi G F,Wang H S,Mao Y R,et al.Protective effect of catalpol against mice brain mitochondrial injuries induced by rotenone[J].Prog Mod Biomed,2012,12(29): 5661-4.
[33]Choi B S,Kim H,Lee H J,et al.Celastrol from‘Thunder God Vine’protects SH-SY5Y cells through the preservation of mitochondrial function and inhibition of p38 MAPK in a rotenone model of Parkinson’s disease[J].Neurochem Res,2014,39(1): 84 -96.
[34]王松海.红景天苷通过调节ROS-NO相关线粒体通路对MPTP/MPP+诱导的帕金森病模型的神经保护作用[D].第四军医大学,2014.
[34]Wang S H.Protective effects of salidroside in the MPTP/MPP+induced model of parkinson's disease through ROS-NO related mitochondrion pathway[D].Fourth Military Medical University,2014.
[35]毕伟,朱丽红,王传明,等.槲皮素抑制鱼藤酮诱导的PC12细胞凋亡[J].中国病理生理杂志,2011,27(1): 82-5.
[35]Bi W,Zhu L H,Wang C M,et al.Inhibitory effect of quercetin on apoptosis of PC12 cells induced by rotenone[J].Chin J Pathophysiol,2011,27(1): 82-5.
[36]Ferretta A,Gaballo A,Tanzarella P,et al.Effect of resveratrol on mitochondrial function: Implications in parkin-associated familiar Parkinson's disease[J].Biochim Biophys Acta,2014,1842(7): 902-15.
Role of mitochondrial damage and repair in Parkinson's disease
DENG Jie,LI Yi-fang,Hiroshi Kurihara,HE Rong-rong,
(School of Pharmacy,Anti-Stress Health Research Center,Jinan University,Guangzhou 510632,China)
Abstract:Parkinson’s disease(PD)is a common disease in central nervous system,for which an effective treatment has yet to be found.The causes of PD include genetic,environmental,aging factors,etc.There is a common factor which can lead to the degeneration of dopaminergic neurons in the substantia: mitochondrial damage and repair.This paper has summarized the environmental and genetic factors that can cause mitochondrial damage in dopaminergic neurons,and outlined several mitochondrial repairing pathways(such as mitophagy)in the treatment of PD.It also analyzes the research situation of utilizing natural medicine in the therapy of PD from the perspective of the mitochondrial protection.
Key words:PD; mitochondrial damage; mitophagy; Parkin; PINK1; cardiolipin; natural medicine
作者简介:邓婕(1991-),女,硕士生,研究方向:神经免疫药理学,Tel:020-85227791,E-mail: jnudengjie@163.com;
基金项目:国家自然科学基金资助项目(No 81473115);教育部新世纪人才项目(No NCET-12-0678)
收稿日期:2015-03-11,修回日期:2015-04-14
文献标志码:A
文章编号:1001-1978(2015)07-0906-05
doi:10.3969/j.issn.1001-1978.2015.07.004

