自拟扶正消瘤方辅助治疗进展期乳腺癌及对血清肿瘤标志物的影响
李宏伟
(河北省围场满族蒙古族自治县卫生监督所,河北 承德 068450)
自拟扶正消瘤方辅助治疗进展期乳腺癌及对血清肿瘤标志物的影响
李宏伟
(河北省围场满族蒙古族自治县卫生监督所,河北 承德 068450)
目的 观察自拟扶正消瘤方联合CEF方案术前化学治疗(简称化疗)进展期乳腺癌的临床疗效,以及对肿瘤标志物癌胚抗原(CEA)、癌相关糖蛋白抗原(CA153)表达水平的影响。方法 将85例进展期乳腺癌患者随机分为观察组44例和对照组41例,均给予3周期新辅助化疗,采用环磷酰胺(CTX)+表柔吡星(EPI)+5-氟尿嘧啶(5-FU)方案。观察组加服医院自拟扶正消瘤方汤剂益气养血、祛瘀消积,每日1剂,疗程同化疗周期,对比两组患者化疗结束后生活质量、近期疗效及肿瘤标志物水平。结果 观察组化疗后Karnofsky (KPS)评分为(85.2±6.1)分,明显高于对照组的(82.4±5.7)分(t=2.182,P=0.032)。观察组化疗总有效率为65.91%,临床获益率为93.18%,均稍高于对照组的46.34%和85.37%,但差异无统计学意义(t=3.306,P=0.069;fisher,P=0.303)。两组患者胃肠道反应、白细胞减少、粒细胞减少、血小板减少、肝损害、肾损害发生率比较,差异均无统计学意义(P>0.05)。化疗后两组患者的CEA和CA-153水平比较,差异均有统计学意义(t=4.330,P<0.01;t=4.905,P<0.01)。结论 中药扶正消瘤方联合CEF方案术前治疗进展期乳腺癌,较常规新辅助化疗能明显提高患者生活质量,降低肿瘤标志物水平,减毒增效。
乳腺癌;新辅助化疗;扶正消瘤方;疗效;肿瘤标志物
目前,以手术为主的综合治疗是乳腺癌的主要治疗手段,术前行新辅助化学治疗(NACT)已成为治疗中晚期乳腺癌的常规治疗手段[1]。由于肿瘤细胞对多种化学治疗(简称化疗)药物的原发性和继发性耐药,常使化疗疗效不理想[2]。以蒽环类药物为基础的CEF[环磷酰胺+表柔吡星+5-氟尿嘧啶(5-FU)]方案是公认的乳腺癌一线化疗方案[3]。近年来,中医中药在乳腺癌的综合治疗中表现出独特优势[4]。基于已有的研究成果,笔者采用自拟扶正消瘤方剂联合CEF化疗方案对乳腺癌患者行术前治疗,并对血清肿瘤标志物的影响进行了临床随机对照研究。现报道如下。
1 资料与方法
1.1 一般资料
选取我院2011年7月至2013年12月收治的85例进展期乳腺癌择期手术患者为研究对象。纳入标准:乳腺癌明确诊断,Karnofsky(KPS)评分超过70分,患者知情同意治疗方案。排除标准:发现有远处转移灶;接受放化疗、内分泌治疗及靶向治疗;伴有血液系统疾病、心脑血管疾病患者及肝肾功能不全。入选85例患者均为女性,年龄44~63岁,平均(54.6±5.2)岁;导管癌22例,原位癌21例,黏液腺癌23例,小叶癌19例;TNM分期Ⅱb期56例,Ⅲa期29例;KPS评分72~83分,平均(77.1±5.9)分;经免疫组化法检测人表皮生长因子受体的同源受体(HER-2)表达阳性32例。本治疗方案经医院伦理委员会批准,患者均签署知情同意书。按照随机数字表法将患者分为观察组(44例)和对照组(41例),两组患者年龄、肿瘤分期、KPS评分、病理分型等一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
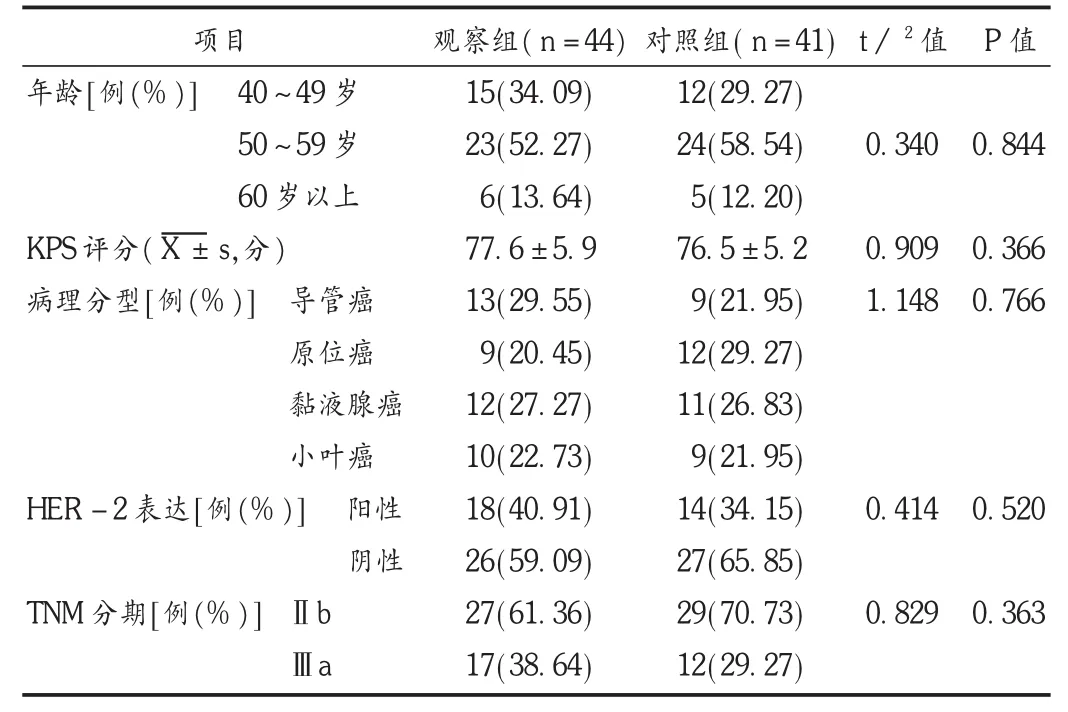
表1 两组患者一般资料比较
1.2 治疗方法
两组患者术前均予环磷酰胺 (CTX)+表柔吡星 (EPI)+ 5-FU方案(CEF方案),具体为:CTX(江苏恒瑞医药股份有限公司,国药准字H32020856,规格为每支100 mg)500 mg/m2加0.9%氯化钠注射液30 mL,静脉注射,第1,8天;EPI(辉瑞制药有限公司,国药准字H20093251,规格为5 mL∶10 mg)60 mg/m2加0.5%葡萄糖注射液100 mL,30 min内静脉滴注,第1天;5-FU(上海旭东海普药业有限公司,国药准字H31020593,规格为10 mL∶0.25 g)500 mg/m2加0.5%葡萄糖注射液500 mL,8 h内静脉滴注完,第1,8天。21 d为1个化疗周期,连续化疗3个周期。观察组加服自拟扶正消瘤方汤剂(组方为黄芪、党参各30 g,当归、枸杞子、半枝莲、仙鹤草、山慈菇各20 g,莪术、三棱、薏苡仁、法半夏、陈皮各15 g,生甘草10 g),水煎服,早晚2次餐前服用,每次200 mL,每日1剂,疗程同化疗周期。每个化疗周期监测血尿常规和肝肾功能,中重度胃肠道反应给予格拉司琼、奥美拉唑等,骨髓抑制等给予利血生、重组粒细胞集落刺激因子,肝功能损害给予谷胱甘肽、水飞蓟宾等治疗[5]。化疗后3周,患者血常规恢复正常后接受乳腺癌改良根治术。
1.3 观察指标及疗效判定标准
临床疗效判定[5]:治疗前后行乳腺B超检查,并参照世界卫生组织(WHO)实体瘤客观疗效标准判定近期疗效,分完全缓解(CR)、部分缓解(PR)、稳定(SD)、疾病进展(PD)。总有效=CR+PR,临床获益=CR+PR+SD。
药品不良反应[6]:参照NCI-CTCAE 3.0版标准评价治疗期间药品不良反应,0度(无反应),Ⅰ度(轻度反应),Ⅱ度(中度可耐受),Ⅲ度(中度不可耐受),Ⅳ度(有严重并发症)。
肿瘤标志物水平:化疗前后空腹采静脉血5 mL,采用美国雅培Architecti 2000全自动化学发光免疫分析仪和配套试剂盒检测血清癌胚抗原(CEA)、癌相关糖蛋白抗原(CA-153)浓度。
1.4 统计学处理
2 结果
2.1 临床疗效
所有患者均完成术前化疗,化疗后患者肿胀感、疼痛、乏力等症状得到不同程度改善,观察组和对照组化疗后的KPS评分分别为(85.2±6.1)分和(82.4±5.7)分(t=2.182,P=0.032)。治疗后,两组患者的疗效总体构成不同(P<0.05),观察组总有效率与临床获益率均高于对照组,但差异无统计学意义(P>0.05)。见表2。
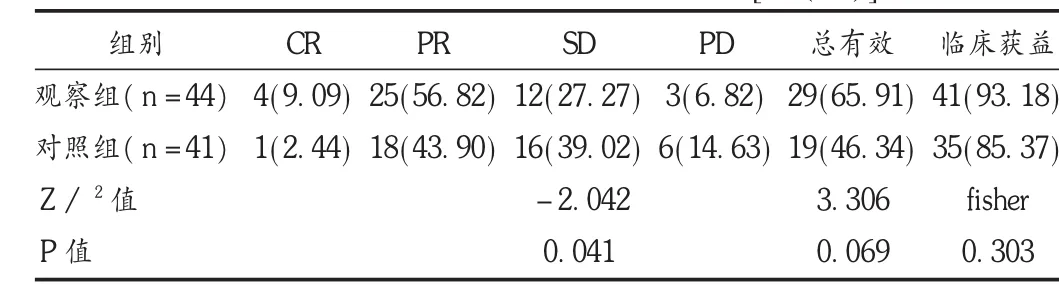
表2 两组患者新辅助化疗疗效比较[例(%)]
2.2 药品不良反应
患者药品不良反应以Ⅰ~Ⅱ度为主,Ⅲ度少见,Ⅳ度罕见。两组患者胃肠道反应,白细胞、粒细胞、血小板减少,肝功能损害、肾功能损害发生情况比较,差异均无统计学意义(P>0.05)。见表3。
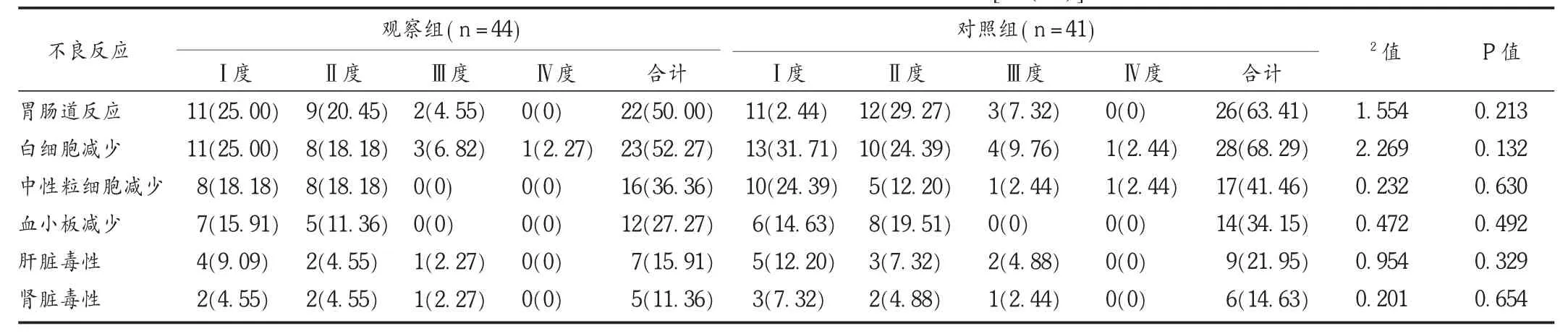
表3 两组患者辅助化疗期间药品不良反应比较[例(%)]
表4 两组患者治疗前后CEA和CA-153水平比较(±s)
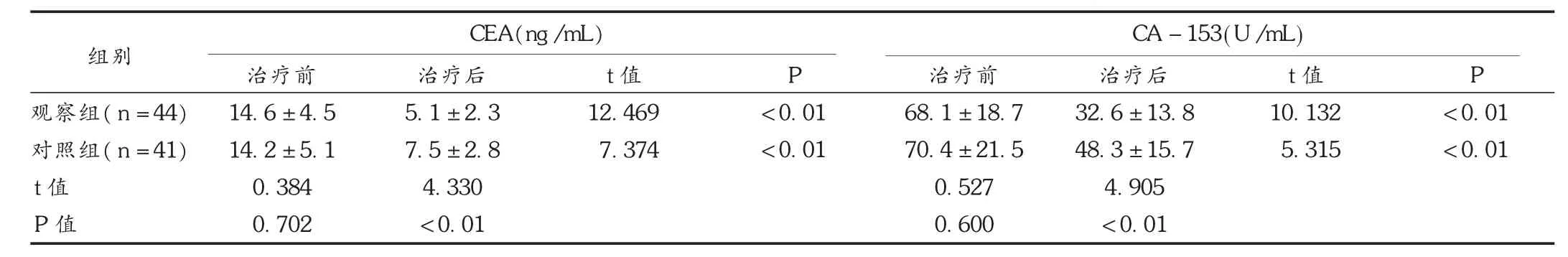
表4 两组患者治疗前后CEA和CA-153水平比较(±s)
组别观察组(n=44)对照组(n=41)t值P值治疗前14.6±4.5 14.2±5.1 0.384 0.702 CEA(ng/mL)治疗后5.1±2.3 7.5±2.8 4.330 <0.01 t值12.469 7.374 P <0.01 <0.01治疗前68.1±18.7 70.4±21.5 0.527 0.600 CA-153(U/mL)治疗后32.6±13.8 48.3±15.7 4.905 <0.01 t值10.132 5.315 P <0.01 <0.01
2.3 肿瘤标志物变化
化疗后,两组患者的CEA与CA-153浓度均显著下降,且观察组明显低于对照组(P<0.05)。见表4。
3 讨论
乳腺癌根治术前实施NACT可缩小原发病灶,降低肿瘤TNM分期,为不具备手术条件的患者增加手术机会,为具备手术条件的患者缩小切除范围,增加保乳机会,且据此能判断肿瘤对化疗方案的敏感性[7],故NACT已成为乳腺癌的常规治疗手段。肿瘤标志物是存在于癌组织及体液内,在肿瘤发生和发展过程中由肿瘤细胞合成、释放,是宿主对肿瘤反应性释放的、反映肿瘤存在和生长的一类生物活性物质[8],其水平与病情严重程度、肿瘤分期及临床预后等密切相关。CA-153和CEA均为非器官特异性肿瘤标志物,CA-153是一种黏蛋白样抗原,主要由乳腺癌、卵巢癌、肺癌、胰腺癌细胞及某些上皮细胞产生,是目前为止乳腺癌病情复发检测的最佳指标[9];CEA是一种糖蛋白,在各种肿瘤均有不同水平的阳性表达,组织特异性不强,但与CA-153联合用于乳腺癌的检测敏感度可达75.8%,特异度可达90.2%[10]。
以蒽环类药物为主的方案是乳腺癌临床化疗的基石[11],CEF方案为乳腺癌化疗一线方案。王道亮等[12]报道,乳腺癌术后采用CEF方案,5年无病生存率与总生存率分别为77.8%和84.4%。CEF方案中,EPI为蒽环类抗癌代表药物,可干扰转录过程,阻止肿瘤细胞mRNA形成,抑制DNA和RNA的合成;CTX是烷化剂类抗肿瘤药,可分解释出烷化作用很强的氯乙基磷酰胺,对肿瘤细胞产生细胞毒作用;5-FU可抑制嘧啶核苷酸限速酶-胸苷酸合成酶的活性,影响脱氧胸苷酸生物合成,从而抑制肿瘤细胞增殖。本研究中对照组采用该方案治疗3周期后,总有效率与临床获益率分别为46.34%和85.37%。
祖国医学认为,乳腺癌属“乳岩”“乳疳”等范畴,多与正气不足、肝失疏泄、气机不畅、气滞血瘀等有关。女子肝郁脾虚、正气虚衰,或因六淫内侵、七情太过而至肝气郁结,气滞则致痰凝,邪毒内蕴,日久致气滞血瘀,冲任失调,经络阻塞,结于乳房而发病[13]。因此,气滞、血瘀、邪毒是乳腺癌的主要病理因素,病在乳房,实则与肝脾、气血有关,当以益气健脾、祛瘀消积为主要治则。自拟扶正消瘤方中,黄芪、党参味甘性温,归肺脾经、健脾益气,升阳固表,扶后天之本,共为君药,使生化有源。三棱味苦辛性平,归肝脾经,有破血行气、消积止痛之功;莪术味苦辛性温,归肝脾经,破气消积,活血化瘀;山慈菇味甘微辛寒,归肝脾经,清热解毒,消痈散结,助莪术、三棱消瘀下血、消积散瘕;法半夏味辛性温,归脾胃肺经,燥湿化痰,消痞散结;半枝莲味甘淡性寒,归心小肠肺经,清热解毒,利尿消肿;仙鹤草苦涩性平,归心肝经,收敛止血,补虚,消积,上述诸药为臣药,主攻解毒散结、化瘀消痰。当归、枸杞子滋阴补肾、养血和血;陈皮理气调中,燥湿化痰;薏苡利水渗湿、健脾补气,四药用作佐药,助君药补益气血,活血化瘀。甘草为使药,既清热解毒,又可调和上述诸药。诸药合用,既扶正祛邪,又攻毒散结,共奏益气养血、化瘀消痰、解毒散结之功。为突出中医药在乳腺癌治疗中的价值,观察组患者加服自拟扶正消瘤汤剂。治疗结束后,观察组生活质量评分显著提高,化疗总有效率、临床获益率分别较对照组提高了近19%和8%;同时,观察组胃肠道反应,白细胞、粒细胞、血小板减少,肝、肾功能损害发生率分别较之对照组略有下降,说明扶正消瘤方在不增加药品不良反应的基础上,一定程度上提高临床疗效。此外,治疗前后CEA和CA-153水平变化,两组患者肿瘤标志物水平均显著下降,但观察组下降幅度远高于对照组,从血清学方面进一步佐证扶正消瘤方的临床疗效。
综上所述,在对进展期乳腺癌行常规术前CEF方案化疗基础上,联合服用扶正消瘤方,较单纯新辅助化疗能明显降低体内肿瘤标志物水平,提高患者生活质量,增进临床疗效,并在一定程度上表现出减少化疗药物毒性的保护作用,有临床推广意义。
[1]Yuan Z,Qu X,Zhang ZT,et al.Neoadjuvant chemotherapy in patients with stagesⅡandⅢ breast cancer[J].Chin Med J,2009,122(24):2 993-2 997.
[2]李东梅,蒋晓松,朱思平,等.扶正解毒法配合新辅助化疗治疗乳腺癌的临床研究[J].甘肃中医,2010,23(12):31-33.
[3]徐玉瑞,巢 琳,陈力平.TC与CEF方案作为早期乳腺癌术后辅助化疗方案的临床比较[J].广东医学,2011,32(21):2 805-2 807.
[4]贾英杰,张蕴超,陈 军,等.探讨中药消岩汤联合重组人内皮血管抑制素配合化疗治疗乳腺癌作用机制研究[J].癌症进展,2011,9(3):336-342.
[5]顾燕儿,蒋红娜,黄剑虹,等.综合护理干预用于改善乳腺癌术后ED化疗患者生存质量45例[J].中国药业,2012,21(23):85-86.
[6]巢 琳,徐玉瑞,陈力平.两种不同新辅助化疗方案治疗局部晚期乳腺癌的临床疗效比较[J].中国癌症杂志,2010,20(12):926-928.
[7]刘 科,王国斌,程 波.GC方案与FEC方案新辅助化疗治疗乳腺癌患者的疗效比较[J].癌症,2007,26(4):427-429.
[8]刘苑欢,魏荣兴,邱群芳.联合检测CA153、CA125、CEA对乳腺癌临床诊断价值探讨[J].实用癌症杂志,2014,29(4):406-408.
[9]Sam N,Ragab HM,EI Maksoud NA,et al.Prognostic significance of serum Her2/neu,BCL2,CA153 and CEA in breast cancer patients:a short follow-up[J].Cancer Biomark,2010,6(2):63-72.
[10]郑 航,罗荣城.TPS、CA-153和CEA联合检测对乳腺癌的诊断价值[J].第一军医大学学报,2005,25(10):1 293-1 295.
[11]白海亚,马秀芬.新辅助化疗对局部进展期乳腺癌患者T淋巴细胞亚群及 NK细胞免疫功能的影响[J].中国免疫学杂志,2012,28(9):843-845.
[12]王道亮,许 骏,王本忠.乳腺癌术后不同方案化疗的临床观察与预后比较[J].安徽医科大学学报,2013,48(7):841-843.
[13]熊良庚.扶正消积方联合化疗对晚期乳腺癌患者生活质量及血清
肿瘤标志物的影响[J].云南中医中药杂志,2012,33(4):14-15.
R285.6;R289.5
A< class="emphasis_bold">文章编号:1
1006-4931(2015)03-0011-03
2014-07-28)

