鸡补体C3d抗血清的制备与应用
闫敏鑫,黄秀芬,任慧英,刘杉杉,姜 良,李永清*(.青岛农业大学动物科技学院,山东青岛6609;.畜禽疫病防控技术北京市重点实验室,北京市农林科学院畜牧兽医研究所,北京00097)
鸡补体C3d抗血清的制备与应用
闫敏鑫1,2,黄秀芬2,任慧英1,刘杉杉2,姜良2,李永清2*
(1.青岛农业大学动物科技学院,山东青岛266109;2.畜禽疫病防控技术北京市重点实验室,北京市农林科学院畜牧兽医研究所,北京100097)
摘 要:为探讨补体因子C3d在家禽健康诊断中的意义,将鸡补体因子C3d全长基因克隆到原核表达载体pET28a中构建重组表达质粒pET28a-C3d,然后将pET28a-C3d转化到大肠埃希菌BL21(DE3)并以IPTG诱导表达。表达产物采用氯化钾染色切胶法进行纯化,获得分子质量约35ku的C3d目的蛋白。将所得蛋白与弗氏佐剂制备疫苗免疫小鼠,制备抗鸡补体因子C3d血清。用制备的血清与重组杆状病毒表达的C3d蛋白进行Western blot和间接免疫荧光(IFA)鉴定血清的特异性。进一步应用该血清对不同健康状态的鸡血清进行C3d相关补体成份相对含量的检测。结果鸡补体因子C3d在大肠埃希菌中成功表达,纯化的C3d蛋白免疫小鼠后制备的抗血清经ELISA检测抗体效价达1∶256 000。Western blot和IFA结果显示,该血清能与重组杆状病毒表达的C3d蛋白发生特异性反应。临床应用试验表明,该血清不仅能用于检测不同健康状态鸡血浆中C3d的表达状况,还能用于ELISA检测不同鸡血清中C3d相关补体成分的相对含量差异。研究还证实鸡血浆中C3d相关补体成分的表达因机体免疫状态不同而存在差异,结果为了解C3d与鸡体健康状况之间的关系提供了依据。
关键词:鸡C3d;原核表达;蛋白纯化;抗血清;免疫学指标
补体是存在于人和脊椎动物血清与组织液中一类具有酶活性且不耐热的蛋白质,广泛参与机体免疫防御和免疫调节功能,也介导免疫病理损伤作用。C3是宿主补体系统的核心分子[1-2],在补体激活的经典途径、替代途径及甘露聚糖结合凝集途径中均起着枢纽作用。补体活化过程中水解生成多种补体片段,C3d是C3的一个最小裂解片段,在先天性免疫和获得性免疫之间起着桥梁作用,它可以与B细胞表面的CR2/CD21(补体受体2)结合,刺激机体的免疫系统,增强B细胞活力,降低反应阈值,并具有免疫佐剂效应[3-4]。正常机体血清中C3d的含量和活性相对稳定。病理状况下可能被异常激活并消耗,导致血清中C3d水平发生改变。因此,C3d水平可作为一个衡量机体健康状况和疾病辅助诊断的指标。
多项研究已经证实,C3d分子佐剂的效应已被广泛应用于新型疫苗的制备,但目前仍缺少有关鸡C3d分子结构及其单体对机体免疫系统影响的研究。为探讨鸡C3d在家禽健康诊断中的意义,本研究利用实验室已成功克隆的鸡C3d基因,利用原核表达系统表达鸡C3d,制备其抗血清,并利用杆状病毒表达的C3d检测抗血清的特异性。进一步用该血清检测不同健康状态鸡血清中C3d的含量,为进一步了解C3d含量与鸡体健康状况之间的关系以及通过血清中C3d水平检测鸡的健康状况奠定基础。
1 材料与方法
1.1材料
1.1.1质粒、细胞及实验动物 质粒pFB-C3d、pET28a载体、sf9昆虫细胞、pFB-C3d-BAC质粒由北京市农林科学院畜牧兽医研究所高技术实验室保存;大肠埃希菌感受态细胞TOP10、表达菌株BL21 (DE3)为天根生化科技(北京)有限公司产品;实验动物Balb/c雌性小鼠购自北京维通利华实验动物技术有限公司。
1.1.2主要试剂 ZeroBack Fast Ligation Kit、DAB、TMB为天根生化科技(北京)有限公司产品;CellfectinⅡReagent、Platinum pfx DNA polymerase为invitrogen公司产品;DNA Marker、PCR试剂为TaKaRa公司产品;限制性内切酶、T4DNA连接酶为BioLabs公司产品;QIAprep Spin MiniprepKit、Gel Extraction Kit为Qiagen公司产品;预染蛋白marker为Thermo公司产品;HRP标记羊抗鼠IgG(HRP-IgG)、HRP-His单抗为北京康为世纪生物科技有限公司产品;试验所用引物合成及质粒测序均由上海生工生物工程技术服务有限公司完成。
1.2方法
1.2.1原核表达质粒的构建与鉴定 利用Oligo6软件设计带有EcoRⅠ、XhoⅠ酶切位点的用于扩增C3d的特异性引物,FP:5′-GAATTCGAGAAAGCCACCATGGGGACCAAGCTGA-3′,RP:5′-AACT CGAGCTAGTTGTTGTTCTCGATGCGGTAGG-3′,(下划线表示酶切位点),预期扩增产物长度978bp。以实验室保存的pFB-C3d质粒为模板,PCR扩增C3d基因片段,PCR反应条件为:95℃5min;94℃30s,61℃45s,68℃1min 10s,30个循环;68℃10min。回收目的基因片段与原核表达载体pET28a连接,转化表达菌株BL21(DE3),经菌落PCR及酶切鉴定后测序,测序正确的阳性克隆命名pET28a-C3d-BL21(DE3)。
1.2.2目的蛋白的诱导表达与纯化 挑取阳性克隆单菌落接种50μg/mL卡那霉素LB液体,37℃培养过夜,次日以1∶100的比例接种至新鲜的卡那霉素LB液体,37℃、200r/min培养至OD 600nm值为0.6~0.8,取1mL菌液作为诱导前对照,其余加入不同浓度的IPTG(终浓度分别为0.2、0.5、1.0mmol/L),28℃、230r/min诱导6h,收集菌体,PBS洗2遍,冰浴超声破碎,4℃、8 000r/min离心,分别取上清和沉淀进行100g/L SDS-PAGE电泳分析。同时设经IPTG诱导的空载体对照。将电泳后的蛋白胶一块进行考马斯亮蓝染色,另一块以1∶2 500稀释的辣根过氧化物酶(HRP)标记的His单抗进行Western blot分析。
表达产物采用氯化钾染色切胶法[19-20]进行纯化,即按上述方法对大量的重组菌裂解物进行100g/L SDS-PAGE电泳分离,然后将凝胶放入4℃预冷的0.25mol/L KCl溶液中染色,切下目的条带,置-20℃冰冻完全后碾碎含目的蛋白的凝胶,加适量PBS于4℃溶解,12 000r/min离心2min,取上清即为蛋白溶液,分别采用Nanodrop及Pierce BCA Protein Assay Kit测定蛋白浓度。
1.2.3抗血清的制备及效价测定 选取6只6周龄~8周龄Balb/c雌性小鼠,免疫前采集适量血清留作阴性对照,初次免疫,每只小鼠以50μg纯化的C3d蛋白与等量弗氏完全佐剂进行皮下多点注射。间隔2周后,分别以剂量为100、150、200μg/只的蛋白与等体积的弗氏不完全佐剂混合物进行第2、3、4次免疫,每次免疫后12d断尾采集血清,以纯化蛋白为包被抗原建立的间接ELISA测定抗体效价。待血清效价达到所需滴度时,摘除小鼠眼球收集所有血清并测定最终抗体效价。
1.2.4抗血清的特异性鉴定
1.2.4.1Western blot鉴定 将实验室已构建的表达C3d的重组杆状病毒P2代接种sf9昆虫细胞,培养72h后出现病变。分别收集感染的细胞及其培养上清进行裂解,裂解产物经100g/L SDSPAGE电泳分离后转印至PVDF膜上并以含50g/L脱脂奶粉的PBST封闭。然后以制备的1∶300稀释的抗C3d小鼠血清作为一抗,1∶10 000稀释的HRP-羊抗鼠IgG作为二抗,进行免疫印迹,DAB显色进行结果分析。
1.2.4.2间接免疫荧光(IFA)鉴定 将P2代表达C3d的重组杆状病毒接种于生长在爬片上的sf9细胞中,在6孔细胞培养板中培养3d~4d出现病变后,弃上清用PBS洗涤1次~2次,然后用40g/L多聚甲醛室温固定1h,0.1% TritonX-100室温作用15min,PBS洗涤后的细胞经5g/L牛血清白蛋白封闭30min,再经1∶100稀释于封闭液的抗C3d鼠血清以及1∶500稀释于封闭液中的FITC标记的羊抗鼠IgG分别室温避光作用1h(期间以PBS洗涤3次),PBS充分洗涤后加入1∶10 000稀释的DAPI作用10min,细胞爬片固定在预先滴有封片剂(Vectashield)的载玻片上,共聚焦显微镜观察结果。
1.2.5抗血清的临床应用
1.2.5.1抗血清用于Western blot检测鸡血清中的C3d 分别取总蛋白浓度相等的SPF、经沙门菌鞭毛抗原免疫及HVT和马立克病病毒强毒株RBIB攻毒的鸡血清,100g/L SDS-PAGE电泳分离后转印封闭,然后以1∶100稀释的抗鸡C3d鼠血清以及1∶10 000稀释的HRP-羊抗鼠IgG进行Western blot,检测鸡血清中的C3d。
1.2.5.2抗血清用于间接ELISA检测鸡血清中的C3d 各取30份不同免疫状况的鸡血清,先用包被液稀释总蛋白质量浓度为0.5μg/mL,然后按100μL/孔包被酶联板4℃过夜。经PBST充分洗涤,50g/L脱脂奶粉37℃封闭1h后,用1∶100稀释的抗鸡C3d鼠血清作为一抗,1∶5 000稀释的HRP标记的羊抗鼠IgG作为二抗进行间接ELISA,检测上述鸡血清样品中C3d含量。对测定样品的OD 450nm值分别采用方差分析和t检验两种方法进行统计学分析,以P<0.05具有显著性差异,P<0.01具有极显著差异。
2 结果
2.1目的蛋白的诱导表达、纯化与鉴定
将含重组质粒的大肠埃希菌BL21(DE3)在28℃下以不同浓度的IPTG进行诱导表达。结果以1.0mmol/L的IPTG诱导6h,目的蛋白获得高效表达,而且几乎以包涵体的形式存在于细菌的裂解沉淀中。100g/L SDS-PAGE电泳显示目的蛋白的分子质量约35ku。采用氯化钾染色切胶法纯化后的目的蛋白条带单一,浓度为1mg/mL(图1A)。将表达产物和重组蛋白进行Western blot分析,结果目的蛋白能够与辣根过氧化物酶标记的抗His标签单抗特异性结合,出现分子质量约为35ku的免疫印迹条带(图1B)。
2.2抗血清效价测定
以纯化的C3d为抗包被原的间接ELISA测定制备的小鼠血清的抗体效价,以样品的吸光度值大于2.1倍阴性对照的吸光度值判定为阳性,结果第3次免疫后抗血清的效价最高达到1∶256 000,加强免疫后增长趋势不大。
2.3抗血清的特异性鉴定
以重组杆状病毒在昆虫细胞sf9中表达C3d融合蛋白作为抗原的Western blot鉴定结果表明,抗血清只能与35ku的C3d融合蛋白发生特异性结合,而与sf9细胞的其他蛋白不发生反应(图2)。
经共聚焦显微镜观察IFA发现,抗血清能特异性识别sf9细胞中杆状病毒表达的鸡补体C3d,而且能显示重组蛋白在细胞中的分布位置,说明抗血清具有良好的免疫活性(图3)。
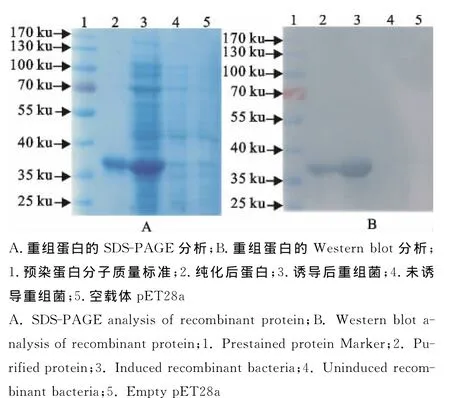
图1 重组蛋白的SDS-PAGE和Western blot分析Fig.1 SDS-PAGE and Western blot analysis of recombinant protein expression
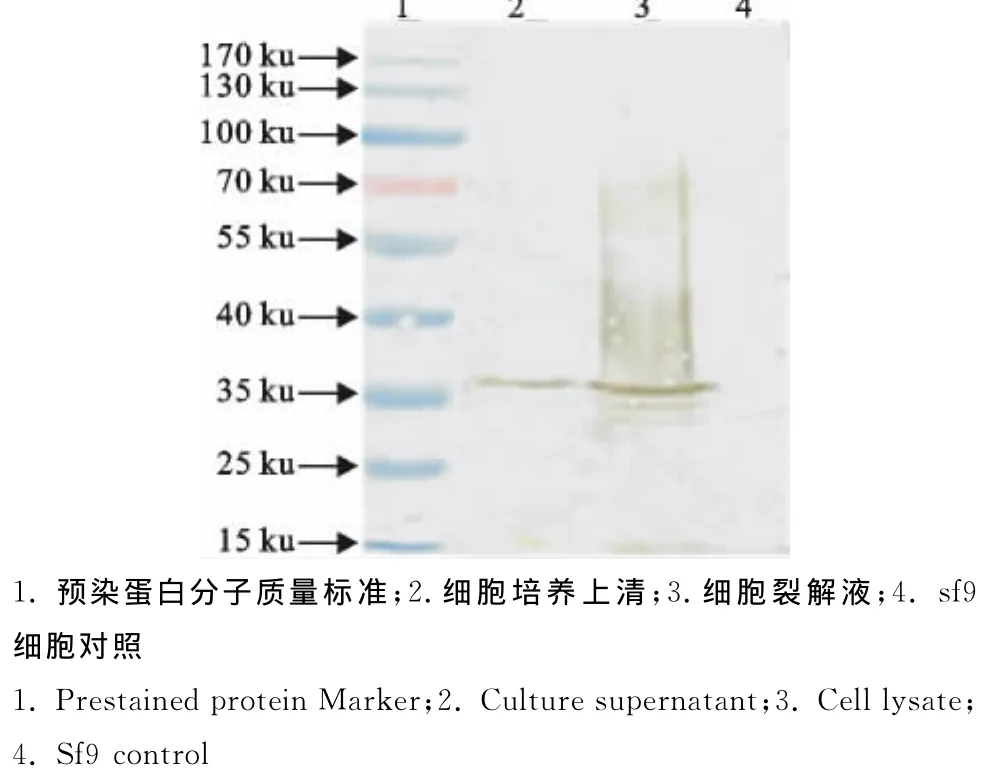
图2 Western blot鉴定抗血清的特异性Fig.2 Western blot identification of specificity of anti-C3dserum
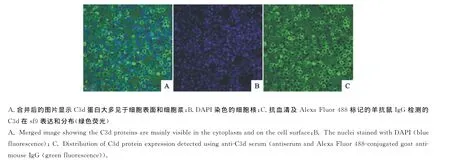
图3 IFA与共聚焦显微镜观察抗血清的免疫活性Fig.3 Analysis of immune activity of anti-C3dserum by IFA and cofocal microscopy
图3B为DAPI染色的细胞核,图3C为抗血清及Alexa Fluor 488标记的羊抗鼠IgG检测的C3d 在sf9表达和分布(绿色荧光),图3A为图3B和图3C合并后的图片。由图3A能明显看到,DAPI染的蓝色的细胞核在sf9细胞中间位置,而绿色荧光染色的C3d蛋白明显分布在蓝色的细胞核周围,一个细胞除了细胞核外,其他部分大多应该是细胞表面和细胞浆,所以说显示C3d蛋白大多见于细胞表面和细胞浆。
2.4抗血清用于Western blot检测鸡血清中的C3d相关补体成分
分别对来自SPF、HVT免疫、RBIB攻毒及沙门菌鞭毛蛋白免疫鸡的血清样品进行Western blot分析。结果发现,相对SPF鸡和沙门菌鞭毛蛋白免疫鸡,HVT及RBIB攻毒鸡血清中除检测到分子质量约为120ku的C3和35ku的C3d外,还检测到1条分子质量约为45ku的C3b条带(图4)。
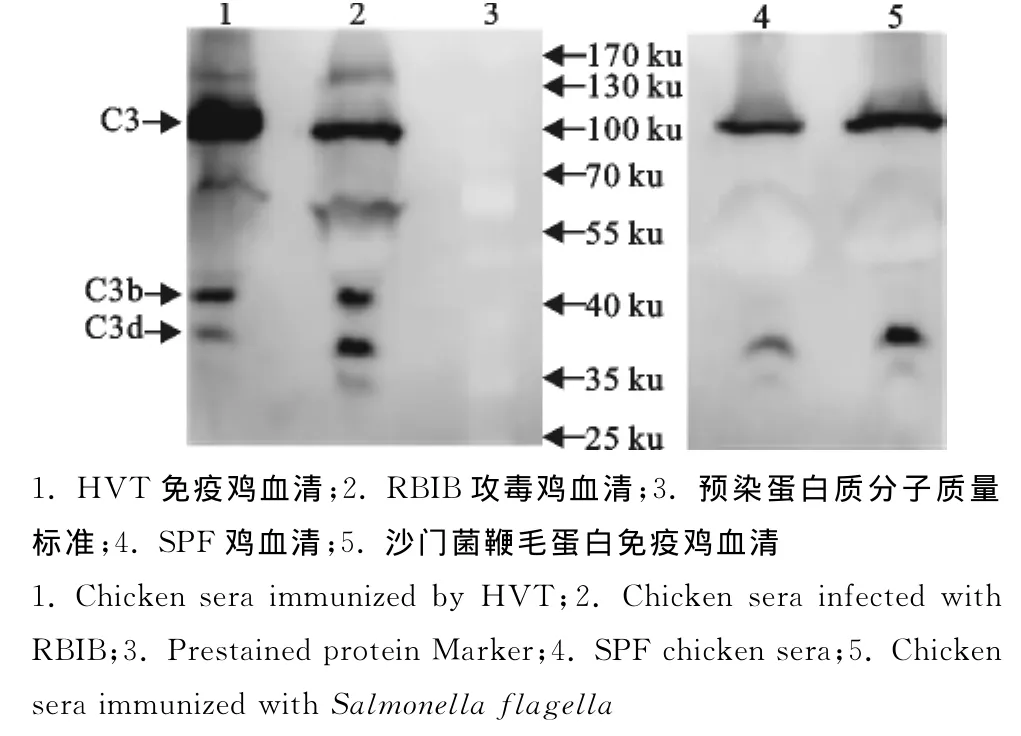
图4 Western blot检测鸡血清中的C3d相关补体成分Fig.4 Identification of C3din chicken sera by Western blot
2.5抗血清用于间接ELISA检测鸡血清中的C3d相关补体成份相对含量
以纯化的抗血清对30份不同健康状态的鸡血清进行间接ELISA检测,结果各样品的平均OD450nm值,虽然RBIB攻毒鸡、HVT免疫鸡和沙门菌鞭毛蛋白免疫的鸡之间差异不显著,但它们均明显高于SPF鸡(P<0.01)(图5)。
3 讨论
补体广泛参与机体的免疫防御与免疫调节功能,因此,补体系统的活化程度是机体免疫状态的重要指标之一。补体系统的核心分子C3在其转化酶作用下先裂解为C3a和C3b,C3b再裂解为C3c和C3d,C3c裂解片段在机体中很快被清除,而C3d是C3蛋白不能再被蛋白酶裂解但仍保持与抗原共价连接的最小片段[5],能够转移至血清中稳定存在。目前C3d作为免疫佐剂被广泛应用于新型疫苗的研制,其原理主要通过与抗原共价结合,为抗原与B细胞受体的交联提供共刺激信号,增强B细胞活力,降低反应阈值,并调节B细胞和T细胞间的相互作用[6-8]。然而有研究证明,过量的C3d会打破机体的免疫平衡状态,从而利于疾病发生,例如血液中过量的C3d可促进HIV的传播[9]。此外,测定血清补体C3及C3d含量能辅助判断系统性红斑狼疮潜在的活动性[10],因此血清中补体C3及裂解片段C3d的检测,对于判断机体补体活化水平,了解机体的健康状况具有重要意义。
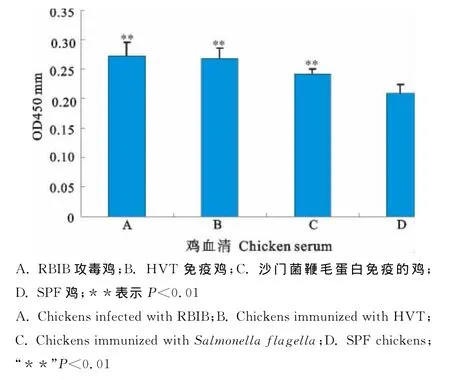
图5 间接ELISA检测鸡血清中C3d相关补体成分Fig.5 Detection of C3din chicken sera by indirect ELISA
迄今,人们对鸡补体因子C3d单体在维持免疫功能平衡中的作用了解还很少,本研究通过原核表达以及氯化钾染色切胶法制备了高纯度的C3d重组蛋白[11],并且制备了小鼠抗鸡C3d血清。Western blot和IFA结果表明,所制备的小鼠抗C3d血清,既能与变性的C3d蛋白发生特异性结合,也能与sf9细胞表达的构象型蛋白发生免疫反应,表明了该血清的特异性和良好的抗体活性,为后续用于检测体内C3d表达状况奠定了基础。
为进一步研究补体因子C3d在家禽健康诊断中的意义,我们应用制备的小鼠抗鸡C3d血清对分别来源于病毒感染、沙门菌鞭毛蛋白免疫及SPF鸡的血清样品进行检测,结果表明相对SPF鸡和沙门菌鞭毛蛋白免疫鸡,HVT及RBIB攻毒鸡血清中除有分子质量约为120ku的C3和35ku的C3d外,还存在一条分子质量为45ku蛋白条带,而这个蛋白的分子质量大小与C3b相符,说明鸡在受到MDV病毒感染时,体内会出现大量的C3b分子。通常情况下,补体是以非活性状态的酶原形式存在于血清和体液中,其含量相对稳定,不随机体的免疫应答而变化,但在抗原抗体复合物或其他因子激活下,补体则通过经典及旁路途径活化,并裂解产生各级补体成份,C3是该系统发挥效应功能的关键成份,C3d又是C3的最终裂解产物,因此,通过检测C3d在不同裂解状态下总的相对含量变化,能在一定程度上反映机体的健康状态。本研究中,我们以ELISA测定样品中总C3d相关补体成份的相对含量,结果发现MDV的2个血清型攻毒的鸡血清中C3d相关补体成份的相对含量均明显高于SPF鸡。这些初步的应用试验结果说明,鸡血清中C3d及其相关补体分子的含量或活化程度可能成为鸡体健康状态的一个免疫指标,这对了解C3d对机体免疫功能的影响及其在禽类免疫系统中的重要性提供了依据。
参考文献:
[1] 魏后军,王 芳,胡 波,等.兔补体C3d基因cDNA的克隆、鉴定及原核表达[J].中国兽医学报,2013,33(2):201-203.
[2] 昝 琦,刘 欣,逄 越,等.补体C3结构与功能研究进展[J].中国免疫学杂志,2014,30(4):549-553.
[3] Carroll M C,Isenman E.Regulation of humoral immunity by complement[J].Immunity,2012,37(24):199-207.
[4] Vanden Elsen J M,Isenman D E.A crystal structure of the complex between human complement receptor 2and its ligand C3dJ.Science20113326029608-611.
[5] Zhang Rui,Zheng Zhi-yong,Lin Jian-song,et al.The continual presence of C3dbut not IgG glomerular capillary deposition in stage I idiopathic membranous nephropathy in patients receiving corticosteroid treatment[J].Diagn Pathol,2012(7):109.
[6] 马金荣,欧阳伟,王永山,等.传染性法氏囊病病毒VP2与C3d串联基因重组表达质粒的构建及其免疫功能研究[J].中国预防兽医学报,2012,34(6):471-475.
[7] Bora N S,Bharati M,Valeriy V,et al.Relationship between the complement system,risk factors and prediction models in agerelated macular degeneration[J].Mol Immunol,2015,63(2):176-183.
[8] Musa H H,Zhang W J,Lv J,et al.The molecular adjuvant mC3denhances the immunogenicity of FimA from type I fimbriae of Salmonella enterica serovar enteritidis[J].J Microbiol Immunol Infect,2014,47(1):57-62.
[9] Kacani L,Prodinger W M,Sprinzl G M,et al.Detachment of human immunodeficiency virus type 1from germinal centers by blocking complement receptor type 2[J].Virology,2000,74 (18):7997-80021.
[10] Negi V S,Aggarwal A,Dayal R,et al.Complement degradation product C3din urine:marker of lupus nephritis[J].J Rheumatol,2000,27(2):380-383.
[11] 吴德芹,颜 晨,刘文华,等.多价噬菌体Bp7尾丝蛋白gp37的表达及其对噬菌体增殖的影响[J].畜牧兽医学报,2012,43 (2):324-328.
Preparation and Application of Antiserum against Chicken Complement 3d
YAN Min-xin1,2,HUANG Xiu-fen2,REN Hui-ying1,LIU Shan-shan2,JIANG Liang2,LI Yong-qing2
(1.College of Animal Science and Technology,Qingdao Agricultural University,Qingdao,Shandong,266109;2.Beijing Key Laboratory
for Prevention and Control of Infectious Diseases in Livestock and Poultry,Institute of Animal Husbandry and Veterinary Medicine,Beijing Academy of Agriculture and Forestry Sciences,Beijing,100097,China)
Abstract:To investigate the value of chicken complement 3d(C3d)in diagnosis of avian health,the full length of C3dgene was cloned into prokaryotic expressing plasmid pET28aand constructed recombinant expression plasmid pET28a-C3d.Then pET28a-C3dwas transformed into BL21(DE3)and induced by IPTG.The desirable C3dproteins with 35ku of molecular size were isolated by cutting the gel slices that contained the right band which was stained by KCl solution.The vaccines were developed by mixing purified C3dproteins with Fred's adjuvant and inoculated into mice.The C3dantiserum raised from above vaccinated mice was identified by Western blot and immunofluoresence assay(IFA)based on C3dprotein which was expressed in sf9insect cells by recombinant baculovirus.The antiserum was further applied to detect C3dassociated complement component relative levels of serum sampled from chickens in different health status.The results showed that the mouse serum against chicken C3dwas developed by using C3d protein expressed in E.coli,which ELISA titre was above 1∶256 000.Western blot analysis and IFA showed that the antiserum could specifically bind with C3dprotein expressed by recombinant baculovirus. The clinical application test showed that the antiserum,not only can be used in detection of C3dexpression of chickens with different health status,can also be used in detection of C3dassociated complement component relative levels of serum sampled from chicken in different health status by ELISA.Our results demonstrated that there were significantly different C3dassociated complement component relative levels among chickens which were in different health status.It provided the evidence for learning the relationships between C3dassociated complement component and chicken health status.
Key words:chicken C3d;prokaryotic expression;protein purification;antiserum;immunological idex
作者简介:闫敏鑫(1988-),女,山东泰安人,硕士,主要从事兽医微生物学和免疫学研究。*通讯作者
基金项目:国家自然科学基金项目(31372420);北京市自然科学基金项目(6122018)
收稿日期:2015-01-16
中图分类号:S852.65;S858.31
文献标识码:A
文章编号:1007-5038(2015)07-0047-05

