猪戊型肝炎病毒ORF3基因的克隆与原核表达
何美琳,张焕容,2*,王 栋(.西南民族大学生命科学与技术学院,四川成都6004;2.动物医学四川省高等学校重点实验室,四川成都6004)
猪戊型肝炎病毒ORF3基因的克隆与原核表达
何美琳1,张焕容1,2*,王栋1
(1.西南民族大学生命科学与技术学院,四川成都610041;2.动物医学四川省高等学校重点实验室,四川成都610041)
摘 要:为了表达猪源戊型肝炎病毒衣壳蛋白,并对其反应原性进行研究,采用RT-PCR方法扩增猪戊型肝炎病毒(SHEV)ORF3完整基因,将扩增产物插入pMD19-T载体,再亚克隆至原核表达载体pET-32a (+),构建了pET-32a(+)-ORF3表达载体,转入E.coli BL21(DE3),IPTG诱导表达,同时对诱导表达条件进行筛选,并用SDS-PAGE和免疫印迹等方法分析鉴定表达产物。结果表明,成功扩增到345bp的目的基因片段,表达载体pET-32a(+)-ORF3转入E.coli BL21(DE3),经IPTG诱导,成功表达了ORF3基因编码的蛋白,当IPTG浓度为1mmol/L,诱导时间为6h时,该基因在E.coli BL21(DE3)中表达量最高。表达产物的分子质量约为29.6ku,与预期目的蛋白分子质量相符。表达的蛋白既有包涵体形式,也有可溶性形式。经Western blot检测,表达的目的蛋白能与SHEV阳性血清发生特异性反应。
关键词:猪戊型肝炎病毒;ORF3基因;表达
戊型肝炎(Hepatitis E,HE)是由戊型肝炎病毒(Hepatitis E virus,HEV)感染引起的经肠道传播的急性病毒性肝炎,主要通过粪便经口传播。人群感染后病死率在0.5%~3%之间,孕妇感染后病情较重,病死率高达15%~25%。戊型肝炎的暴发流行主要发生在亚洲和非洲一些卫生条件较差的发展中国家,散发病例见于世界各地[1-2]。Meng X J等[3]证实美国猪群中存在HEV抗体,并检测到猪HEV RNA,发现其与人HEV具有极高的同源性,并可感染黑猩猩和恒河猴,从而首次证实了HEV种间传播的可能性。随后,越来越多的证据表明猪戊型肝炎是一种人畜共患病,凸现出猪戊型肝炎的公共卫生学意义。目前基因Ⅳ型HEV在我国猪群中普遍流行[4]。临床上检测HEV抗体及HEV疫苗的研制多是围绕ORF2和ORF3而设计[5]。由于HEV组织培养困难,难以研制减毒或灭活疫苗,因此,利用基因工程技术制备重组抗原,研制多肽疫苗成为戊型肝炎研究的热点[6]。本试验对猪戊型肝炎病毒ORF3基因片段进行了克隆及原核表达,并对其抗原性进行了初步鉴定,以期获得可以作为诊断用的重组蛋白,为进一步建立诊断方法提供依据。
1 材料与方法
1.1材料
1.1.1含猪HEV核酸的粪便样品、血清、载体和宿主菌株 含猪Ⅳ型HEV核酸的粪便样品和阳性血清由爱荷华州立大学兽医诊断与动物生产系Tanja教授惠赠;2011年-2013年间采自四川地区20个规模化猪场的猪粪便样品270份,pMD19-T载体为宝生物工程(大连)有限公司产品;感受态细胞、E.coli DH5ɑ、pET-32a(+)和E.coli BL21(DE3)均由西南民族大学生命科学与技术学院动物医学实验室保存。
1.1.2主要试剂 Trizol为Invitrogen公司产品;DNA Marker DL 2 000和DL 15 000为天根生化科技(北京)有限公司产品;反转录试剂盒为宝生物工程(大连)有限公司产品;EX-Taq DNA聚合酶、dNTP为TaKaRa公司产品;AXY prepTM DNA胶回收试剂盒、AXY prepTM小量质粒提取试剂盒为Axygen公司产品;限制性内切酶BamHⅠ和EcoRⅠ为Promega公司产品。
1.2方法
1.2.1引物设计与合成 根据GenBank中登录的猪戊型肝炎ORF3基因序列(登录号:AY594199.1),利用Primer 5.0软件设计一对特异性引物,上游引物F1(BamHⅠ):5′-CGCGGATCCATGGAGATGCCACCATGCGCT-3′,下游引物R1(EcoRⅠ):5′-CCGGAATTCTCAACGGCGAAGCCCCAGCT-3′,引物由上海生工生物工程技术服务有限公司合成。
1.2.2病毒RNA的提取与ORF3基因的扩增
取猪粪样悬液,12 000r/min离心5min,取上清液,根据Invitrogen公司的Trizol说明书提取样本总RNA。将提取的总RNA按照反转录试剂盒说明反转录合成cDNA。反转录后得到的cDNA置于-20℃保存。以提取的cDNA为模板进行PCR扩增。PCR反应总体系为25μL:cDNA 2.0μL,上、下游引物各1μL,10×PCR buffer 2.5μL,25mmol/L MgCl22μL,2.5mmol/L dNTP 2μL,EXTaq DNA聚合酶(5U/μL)0.15μL,ddH2O调整总体积至25μL。PCR反应程序为:95℃5min;95℃30s,53℃30s,72℃30s,共35个循环;72℃10 min,16℃反应结束。PCR扩增产物用20g/L琼脂糖凝胶电泳观察。
1.2.3PCR产物的纯化与克隆 按AXY prepTMDNA胶回收试剂盒说明回收目的片段,并取5μL回收产物经20g/L的琼脂糖凝胶电泳检测回收效果。将目的片段按照TaKaRa公司的pMD19-T Vector Kit说明进行连接。连接产物按常规方法转化至感受态细胞E.coli DH5ɑ培养,挑取单菌落进行菌落PCR鉴定。阳性克隆增菌培养后按常规碱裂解法提取质粒,用BamHⅠ和EcoRⅠ双酶切鉴定,鉴定正确的阳性克隆菌液送上海生工生物工程技术服务有限公司测序,测序正确的质粒命名为pMD19-T-ORF3。
1.2.4重组表达质粒的构建与鉴定 用BamHⅠ和EcoRⅠ酶切pMD19-T-ORF3质粒以及表达载体pET-32a(+),回收目的片段,在T4DNA连接酶的作用下进行连接构建重组蛋白表达质粒pET-32a(+)-ORF3,连接产物,转化至感受态细胞E.coli BL21(DE3)。挑选单个白色菌落接种于含Amp (100μg/mL)的LB液体培养基中培养过夜,经菌液PCR和酶切鉴定为阳性者,将菌液按1∶100的比例接种于新鲜的含相同浓度抗生素的LB液体培养基中,37℃、180r/min振荡培养至OD 600nm值达0.6~0.7,取2mL菌液作为诱导前对照,向其余菌液中加入IPTG至终浓度为1mmol/L,37℃,振荡培养,分别收取2、4、6、8、10h及过夜诱导菌液各2mL,8 000r/min离心20min,收集菌体沉淀进行SDS-PAGE检测。
1.2.5表达产物的SDS-PAGE检测 将各时间点收集的菌体重悬于200μL PBS中吹散混匀,各取20μL分别加入5μL 5×SDS上样缓冲液,沸水浴5min,取10μL上清于浓度120g/L的聚丙烯酰胺凝胶进行SDS-PAGE检测。电泳结果用凝胶成像系统采集图像保存。
1.2.6重组蛋白表达形式的鉴定 根据1.2.5结果选取表达量高的时间点进行目的蛋白的大量诱导表达,菌液以8 000r/min离心20min,收集菌体沉淀,用PBS重悬并洗涤2次,菌体重悬于适量PBS,冰浴条件下进行。
1.2.7重组ORF3蛋白的纯化 配制120g/L的分离胶,向胶板里缓慢加入4mL分离胶,加入1mL的去离子水,待胶凝固后倒掉去离子水,加入4%的浓缩胶200μL,不插梳子,待胶凝固后加入800μL的经上样缓冲液处理过的样品,另按常规方法配胶,加入标准分子量蛋白做参考,按常规方法电泳,电泳结束后将胶置0.25mol/L的KCl溶液中在脱色,摇床上摇1h,可见在30ku左右位置出现一条白色条带,将白色条带切下置蒸馏水中在脱色摇床上摇20min脱去KCL,将切下来的胶研磨碎再加上适量PBS,反复冻融3次后,8 000r/min离心10min,取上清。
1.2.8重组蛋白的Western blot检测 取纯化后的重组蛋白进行SDS-PAGE电泳后,将凝胶上的相应条带转印至PVDF膜上,电转后的PVDF膜置于50g/L的脱脂奶粉中,4℃封闭过夜,然后转入用TBST按1∶200倍稀释的猪HEV阳性血清中,37℃温育2h,用TBST液洗膜3次。再转入用TBST液按1∶2 000稀释的HRP标记的羊抗猪IgG中,37℃温育2h,TBST洗涤液洗膜3次。按照Bio-Rad公司Immun-StarTMWestern C Chemiluminescent Kit说明书显色,于VersaDoc成像系统中观察结果。
2 结果
2.1RT-PCR扩增结果
用设计的引物从猪粪便样品中扩增出长度约350bp的片段,与预期片段大小一致(图1)。

图1 ORF3基因的PCR扩增产物Fig.1 PCR products of ORF3gene
2.2克隆质粒酶切鉴定结果
重组质粒经BamHⅠ和EcoRⅠ双酶切,得到与预期大小一致的载体片段和目的片段,说明猪HEV ORF3基因片段成功插入pMD19-T载体中(图2)。
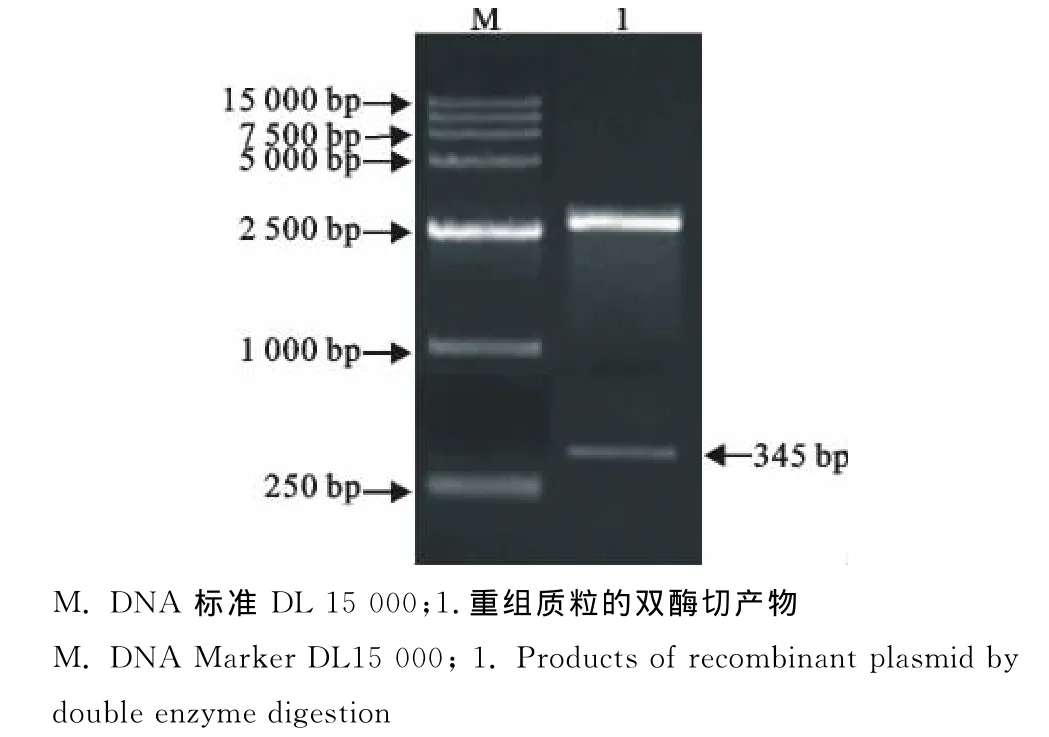
图2 重组质粒的酶切鉴定Fig.2 Identification of recombinant plasmid by enzyme digestion
2.3目的蛋白诱导表达最佳时间的筛选
重组表达菌在IPTG浓度1mmol/L时诱导表达,不同时间点收集表达产物经SDS-PAGE分析,结果2、4、6、8、10h和过夜诱导获得大小约为29.6ku的目的蛋白,当诱导时间为6h时,目的蛋白表达量最高(图3)。
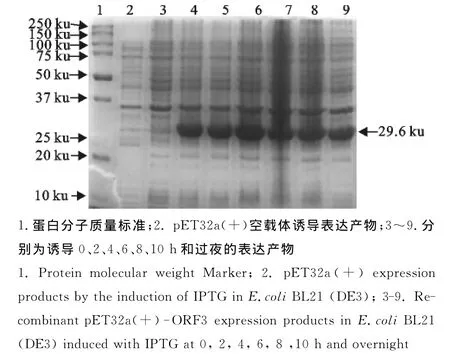
图3 ORF3基因在E.coli BL21(DE3)中的表达Fig.3 Expression of ORF3gene in E.coliBL21(DE3)
2.4重组蛋白表达形式的鉴定
超声破碎离心后的菌体上清和沉淀经SDSPAGE检测显示,ORF3重组蛋白既以包涵体形式存在,又以可溶性蛋白形式存在(图4)。

图4 超声破碎后ORF3重组蛋白Fig.4 ORF3recombinant protein disintegrated by ultrasonication
2.5ORF3重组蛋白Western blot检测
Western blot检测结果表明,表达的重组ORF3蛋白能够与猪HEV阳性血清特异性结合,在约29.6ku处出现条带,与预期一致(图5)。说明表达的重组蛋白可被猪HEV阳性血清识别,具有良好的抗原性。
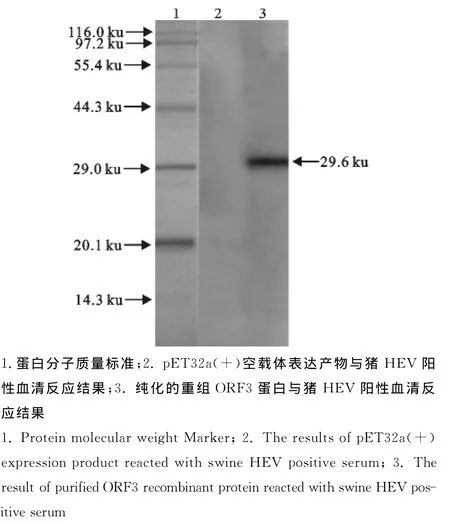
图5 ORF3重组蛋白的Western blot鉴定Fig.5 Western blot analysis of ORF3recombinant protein
3 讨论
长期以来,国内外对戊型肝炎病毒的研究主要集中在ORF1和ORF2及其编码蛋白的功能上。但对ORF3的研究表明,ORF3编码蛋白至少含有4个线性抗原表位[7]。由于ORF3在细胞信号转导、病毒颗粒装配和机体免疫方面可能发挥重要作用,其蛋白表达受到更多的关注。杜丽等[8]分析了pORF3蛋白对于靶细胞MAPK磷酸化的影响,提出MAPK家族中的p-ERK1和p-ERK2表达水平的升高与靶细胞的增殖相关。Guegan J P等[9]研究表明生长因子可通过MEK1/2-ERK1/2通路的激活促进细胞增殖。王晶晶等[10]研究表明,Ⅳ型ORF3蛋白可抑制TNF-α介导的p65核转移。Dong C等[11]发现HEV ORF3蛋白能结合STATl,抑制IFN-α诱导的STATl磷酸化,导致抗病毒基因PKR、2,5-OAS和MxA表达受到抑制,逃避宿主的攻击。有学者认为,利用不同型HEV pORF3作诊断试剂,不但可以检测戊型肝炎病毒基因型,还可以用于诊断急性戊肝[12]。
本研究对Ⅳ型戊型肝炎病毒的ORF3基因进行原核表达,并对其抗原性进行了初步鉴定,旨在获得可以作为诊断抗原用的重组蛋白。尽管关于猪戊型肝炎病毒ORF2方面的原核表达研究相对成熟[13],但对ORF3相关蛋白表达的研究却不多。本研究成功构建了猪HEV原核表达重组质粒pET32a(+)-ORF3,当IPTG浓度为1mmol/L,诱导时间为6h时,目的蛋白在E.coli BL21(DE3)中表达量最高。诱导表达后对菌液进行超声破碎,再用SDS-PAGE电泳检测重组菌裂解上清液和沉淀中融合蛋白的存在形式。结果表明,目的蛋白在上清液和沉淀中均大量存在,经Western blot检测,表达的目的蛋白能与猪HEV阳性血清发生特异性反应。由于该蛋白可以可溶性形式存在,从而避免了包涵体复性工艺造成的制备成本上升[14]。同时由于该蛋白也可以包涵体形式存在,避免了表达菌内蛋白水解酶的作用,这会使最后纯化蛋白的难度下降。表达蛋白良好的抗原性适合作为抗原建立猪戊型肝炎病毒抗体的检测方法。该重组蛋白为进一步建立HEV血清学诊断方法奠定了基础,具有重要的现实意义。
参考文献:
[1] Purdy M A,Carson D,Caustland K A,et al.Viral specificity of hepatitis E virus antigens identified by fluorescent antibody assay using recombinant HEV proteins[J].J Med Virol,1994,44(2):212-214.
[2] Cheng,Y,Du L,Shi Q,et al.Identification of miR-221and-222as important regulators in genotypeⅣswine hepatitis E virus ORF3-expressing HEK 293cells[J].Virus Genes,2013,47 (1):49-55.
[3] Meng X J,Purcell R H,Halbur P G,et al.A novel virus in swine is closely related to the human hepatitis E virus[J].Pro Nat Acad Sci USA,1997,94(18):9860-9865.
[4] 王凤阳,李布勇,王 轶,等.海口和三亚地区商品猪中戊型肝炎病毒感染情况调查[J].中国热带医学,2007,7(6):897-897,900.
[5] 李 斌,苏乾莲,赵 武,等.戊型肝炎疫苗研究进展[J].动物医学进展,2013,34(6):154-159.
[6] 李丹丹,张馨心,于 婧,等.猪戊型肝炎病毒基因ORF2片段克隆及其原核表达[J].中国兽医杂志,2009(3):17-19.
[7] 张红梅,戴 星,孟继鸿,等.戊型肝炎病毒第4基因型中国株ORF2编码蛋白的抗原表位分析[J].遗传,2007(5):637-642.
[8] 杜 丽,成 鹰,史巧芸,等.基因Ⅳ型戊型肝炎病毒ORF3 对HEK293细胞MAPKs磷酸化的影响[J].动物医学进展,2014,35(4):46-48.
[9] Guegan J P,Fremin C,Baffet G.The MAPK MEK1/2-ERK1/2pathway and its implication in hepatocyte cell cycle control[J].Int J Hepatol,2012:328-372.
[10] 王晶晶,张元杰,田德英.戊型肝炎病毒开放读码框3蛋白抑制肿瘤坏死因子-α介导肝细胞p65的核转移[J].中西医结合肝病杂志,2012,22(1):30-31.
[11] Dong C,Zafhllah M,Mixson H T,et al.Suppression of interferon-αsignaling by hepatitis E virus[J].Hepatology,2012,55(5):1324-1332.
[12] 窦守强,唐延平,蓝赐华,等.戊型肝炎病毒研究新进展[J].中国兽药杂志,2007,41(3):32-34.
[13] 郝宝成,兰 喜,胡永浩,等.猪戊型肝炎病毒ORF2部分片段原核表达载体的构建[J].中国畜牧兽医,2011(10):214-217.
[14] 梁焕斌,梁楚敏,古洪浪,等.猪源戊型肝炎病毒ORF3基因的原核表达及抗原性分析[J].黑龙江畜牧兽医,2013(3):86-88.
Cloning and Prokaryotic Expression of Swine Hepatitis E Virus ORF3 Gene
HE Mei-lin1,ZHANG Huan-rong1,2,WANG Dong1
(1.College of Life Science and Technology,Southwest University for Nationalities,Chengdu,Sichuan,610041,China;2.Key Laboratory of Medicine of Universities in Sichuan,Chengdu,Sichuan,610041,China)
Abstract:To express recombinant swine hepatitis E virus capsid protein in prokaryotic cells and analyze the reactogenieity of expressed product.The full-length of Swine Hepatitis E Virus(SHEV)ORF3gene was amplified by reverse transcript polymerase chain reaction(RT-PCR)and inserted into vector pMD19-T,then subcloned into prokaryotic expression vector pET-32a(+).The pET-32a(+)-ORF3was transformed into E.coli BL21(DE3)for expression with the induction of IPTG,at the same time,the time of expression under the induction of IPTG was optimized.The expression product was identified by SDS-PAGE and Western blot.The result showed that the successfully amplified target gene was about 345bp.The protein encoded by ORF3gene was successfully expressed by IPTG induction.The highest expressed protein in E. coli BL21(DE3)was induced with 1mmol/L IPTG for 6h.The relative molecular mass of expressed product was about 29.6ku,consistent with the expected target protein.The expressed protein not only existed in the form of inclusion body but also in the form of soluble protein.Western blot showed that the expressed fusion protein can specifically reacted with SHEV positive serum.
Key words:Swine hepatitis E virus;ORF3gene;expression
作者简介:何美琳(1990-),女,湖北黄梅人,硕士,主要从事动物传染病学研究。*通讯作者
基金项目:四川省科技计划项目应用基础计划(2011JY0034)
收稿日期:2014-12-24
中图分类号:S855.3;Q786
文献标识码:A
文章编号:1007-5038(2015)07-0033-05

