猪传染性胃肠炎病毒的分离鉴定及S 基因进化分析
孙秋艳,郭洪梅,沈美艳,王志远(山东畜牧兽医职业学院,山东潍坊261061)
猪传染性胃肠炎病毒的分离鉴定及S 基因进化分析
孙秋艳,郭洪梅,沈美艳,王志远*
(山东畜牧兽医职业学院,山东潍坊261061)
摘 要:从山东地区某大型养猪场疑似感染猪传染性胃肠炎病毒(TGEV)的仔猪肠道粪便中,利用ST细胞(猪睾丸细胞系)分离到1株病毒。通过噬斑克隆纯化、病毒理化特性、间接免疫荧光(IFA)、动物回归和RT-PCR进行鉴定。结果表明,病毒株在ST细胞形成形态均一。直径在2mm~3mm左右、外形圆而规则噬斑,耐酸,耐胰酶,对乙醚、氯仿、热比较敏感的RNA病毒;IFA鉴定采用共聚焦显微镜观察可见特异性细胞浆内橙红色荧光;动物回归试验出现典型猪传染性胃肠炎临床症状;RT-PCR扩增获得与预期目的基因片段大小一致的条带。综合分析以上结果,证明所分离到的病毒为TGEV,将其命名为TGEV-SDW1株。参照GenBank中TGEV S基因的核苷酸序列,用RT-PCR成功扩增获得分离株的S基因序列,并与Gen-Bank中公布的13株TGEV毒株的S基因序列进行同源性比较,并绘制系统发育进化树。结果表明,分离株S基因片段长为4 350bp,与13株TGEV毒株氨基酸同源性很高,在96.0%~99.4%之间;核苷酸同源性与TH-98株最高,可达98.2%,与DAE株同源性最低,为77.7%。核苷酸系统进化树结果显示,分离株与中国KT2亲缘关系较近,处于同一分支,表明TGEV-SDW1株来自我国或我国周边国家的变异株。
关键词:猪传染性胃肠炎病毒;分离鉴定;S基因;序列进化分析
猪传染性胃肠炎(Transmissible gastroenteritis,TGE)是由猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)引起的一种以猪的严重腹泻、呕吐和脱水为临床特征的高度接触性急性传染病,属于世界动物卫生组织(OIE)规定必须报告的动物传染病[1]。该病主要发生在气温低的冬季和春季,不同年龄的猪均易感,尤其以2周龄以下仔猪最为严重,病死率可达95%~100%;成年猪感染后几乎没有死亡,但严重影响猪的增重和降低饲料报酬。该病于1946年由Doyle L P等[2]在美国首次报道,随后多个国家相继报道发生了TGE,我国从20世纪60年代起就有TGE的报道,近些年来有进一步流行的趋势,给养猪业造成极大危害[3]。因此,对病原的分离鉴定[4-6]和早期诊断对该病的防控具有极为重要的意义。本试验从山东地区大型养猪场收集疑似感染TGEV仔猪的肠道粪便样品,通过细胞分离培养,成功分离到一株病毒,通过蚀斑克隆纯化、病毒理化特性、间接免疫荧光、动物回归和RTPCR进行鉴定,确诊分离病毒株为猪传染性胃肠炎病毒,为探讨该毒株其可能来源,扩增了分离毒株的S基因[7-8]序列,并对分离株的S基因序列进行了遗传变异分析。
1 材料与方法
1.1材料
1.1.1细胞及毒株 猪睾丸细胞系(Swine testicle cell,ST细胞)、小鼠纤维母细胞系(L2细胞)、参考毒株TGEV-purdue株由复旦大学医学院病原生物系王玉燕教授惠赠;所有细胞均用含100mL/L胎牛血清的DMEM培养液培养,病毒增殖的维持液为含200mL/L胎牛血清的DMEM。
1.1.2主要材料 DMEM、胎牛血清为Invirogen公司产品;胰蛋白酶为上海生工生物工程技术服务有限公司产品;羊抗鼠IgG-TRITC为Jackson ImmunoResearch公司产品;DAPI(4′6-二脒基-2-苯基吲哚)为Roche公司产品;多聚赖氨酸、Mowiol封片剂为Sigma-Aldrich公司产品;病毒RNA提取试剂盒、琼脂糖凝胶回收试剂盒为天根生化有限公司产品;AMV第一链cDNA合成试剂盒、PCR引物为上海生工生物工程技术服务有限公司产品;TCS-SP5激光共聚焦显微镜为Leica公司产品。
1.1.3粪样来源 山东省某大型养猪场7日龄仔猪突然发病,首先呕吐,继而发生频繁呈喷射状水样腹泻,粪便黄色、绿色或白色,常夹有未消化的凝乳块。病猪极度口渴,明显脱水,体重迅速减轻,病猪2d~7d内死亡。
1.1.4实验动物 SPF猪7日龄,购自山东省实验动物中心,试验期间的饲养管理按常规方法进行。
1.2方法
1.2.1粪样处理 将采集的粪便样品用含100mL/L胎牛血清的DMEM培养液1∶5稀释,10 000r/min离心30min,取上清液,用0.22μm的微孔滤膜滤器过滤,收集滤液,置-70℃保存作为接种材料。
1.2.2病毒的分离培养 将处理的病料按照营养液的100mL/L量分别接种于长满单层的ST细胞和L2细胞,37℃吸附1h,然后加入含20mL/L胎牛血清的DMEM维持液,于37℃、体积分数为5% CO2培养箱中继续培养,连续观察1周,是否出现细胞病变(CPE),不出现CPE的病毒连续传7代,如仍没有出现CPE则视为阴性;有CPE则继续传代,传代到CPE比较稳定。
1.2.3噬斑克隆纯化试验 将ST细胞进行消化,细胞数调整至1×106个/mL,加至培养皿中,每皿5mL,37℃、体积分数为5% CO2培养箱中培养,待细胞长成单层后;将CPE稳定的第10代培养细胞培养物做10倍系列稀释,选取适当稀释度,每皿1mL,每个稀释度接种3个平皿,37℃、体积分数为5% CO2培养箱中吸附2h,加营养覆盖琼脂,每皿7mL;37℃、体积分数为5% CO2培养箱中培养24h~72h;用1 mL移液管挑取病毒噬斑,置入2mL完全培养基中,置-70℃保存,再将保存病毒按以上步骤重复进行噬斑挑取试验,纯化病毒;往已挑取病毒噬斑的平皿中加入中性红琼脂染色8h后观察噬斑。并将纯化的毒株命名为TGEV-SDW1。
1.2.4病毒TCID50的测定 按常规方法,将ST细胞进行消化传代,将细胞数调整至1×106个/mL,加至96孔细胞培养板中,每孔0.1mL,37℃、体积分数为5% CO2培养箱中培养,待细胞长成单层后,将TGEV-SDW1作10倍系列稀释,选取适当稀释度,每个稀释度接种96孔板中的8孔,每孔0.1mL,37℃、体积分数为5% CO2培养箱中培养,每隔24h观察CPE情况,至96h。按Reed-Muench公式计算TCID50。
1.2.5病毒理化特性试验
1.2.5.1病毒核酸类型的鉴定 按文献描述的方法,用5-溴脱氧尿核苷(5-BUDR)法,取96孔长满单层ST细胞,加入浓度为50μg/mL的5-BUDR维持液,同时设不加5-BUDR对照组。然后在试验组和对照组中分别接种TGEV-SDW1病毒,每隔24h观察CPE情况,至96h。按Reed-Muench公式计算TCID50。
1.2.5.2病毒抵抗力的鉴定 将分离的病毒通过相应的处理后,接种ST细胞,进行耐乙醚、耐氯仿、耐胰酶、耐酸(pH 3.0,30℃维持2h)、耐热(60℃,30min)等试验。
1.2.6间接免疫荧光(IFA)鉴定
1.2.6.1鼠抗TGEV高免血清的制备 将参考毒株TGEV-purdue和TGEV-SDW1株大量培养,病毒细胞培养物经-20℃反复冻融3次,4℃、3 500r/min离心15min,收集上清,4℃缓慢向上清中滴加300g/L PEG8000至终浓度80g/L,缓慢搅拌2h,4℃、9 000r/min离心2h,弃去上清,用0.5mL~1mL无菌PBS溶解沉淀,500r/min离心1min,100μL/EP管分装,置-80℃冻存。将制备的抗原用弗氏完全佐剂乳化,分别免疫接种6周龄Balb/c小鼠5只,腹腔注射0.25mL/只;第2周用弗氏不完全佐剂乳化,0.5mL/只;再隔3d加强免疫用弗氏不完全佐剂乳化,0.5mL/只。每周采血,测定血清中和抗体琼扩效价达1∶8以上时,心脏采血,分离血清,测定中和抗体效价,该血清用作下列试验的一抗,置-20℃备用。
1.2.6.2IFA试验 用无水乙醇浸泡1cm2盖玻片30min,在玻片上滴加多聚赖氨酸包被盖玻片,将包被好的盖玻片置于24孔细胞培养板,每孔1片,加入用胰酶消化好的ST细胞,每孔1mL,37℃、体积分数为5% CO2培养箱培养至细胞长成单层。分别将TGEV-purdue、TGEV-SDW1加入已长成单层的含细胞趴片的24孔细胞培养板内,37℃吸附18h,40 mL/L多聚甲醛固定,PBS洗涤3次,50g/L BSA室温封闭1h,加入用50g/L BSA-PBS 1∶500稀释的上述制备的鼠抗TGEV高免血清一抗,4℃过夜,PBS洗涤3次;加TRITC标记的羊抗鼠IgG二抗,室温孵育1h,PBS洗涤3次;加DAPI避光染色10min,PBS洗涤1次,5min;Mowiol封片剂粘合牢固盖玻片与载玻片,4℃避光保存;用TCS-SP5激光共聚焦显微镜观察病毒情况。
1.2.7动物回归试验 取10只7日龄SPF仔猪,随机分成2组,试验组5只,对照组2只。将TGEV-SDW1细胞毒经口接种试验组,剂量为104.59TCID50/只;对照组用同样的方法和剂量接种无菌细胞培养液。观察病毒对仔猪的致病性,同时进行病原分离。
1.2.8RT-PCR参考文献[9-12]进行
1.2.8.1引物合成 参照GenBank中TGEV S基因的核苷酸序列设计一对引物(上海生工生物工程技术服务有限公司合成),Primer(Forward):5′-GCATGAGGCATAATCTAAACATGGAA -3′;Primer (Reverse):5′-CTGAAAAAGCTCGAGTCACTCACTG -3′;预计扩增片段长度为1 148bp。
1.2.8.2RNA的提取 将1.2.1中处理的粪便上清液、纯化TGEV-SDW1、动物回归试验肠道病料和参考株TGEV-purdue按照病毒RNA提取试剂盒说明书进行操作,提取RNA,参考株TGEV-purdue作为阳性对照。
1.2.8.3cDNA的生成 按照AMV第一链cDNA合成试剂盒说明书进行操作,合成cDNA。
1.2.8.4PCR反应 反应体系条件如下:模板cDNA 5μL,10×PCR buffer 5μL,2.5mmol/μL dNTPs 2μL,引物各1μL,TaqDNA聚合酶0.2μL,用ddH2O调整终体积至50μL。反应条件:94℃5min;94℃1min,55℃1min,72℃1min,30个循环;72℃5 min。反应结束后,取5μL于10g/L的琼脂糖凝胶电泳,观察结果。
1.2.9S基因序列进化分析
1.2.9.1引物合成 参照GenBank中TGEV S基因的核苷酸序列,设计3对引物(上海生工生物工程技术服务有限公司合成),见表1。

表1 TGEV S基因的引物设计Table 1 Design of primers in S gene region of TGEV
1.2.9.2RT-PCR扩增 试验方法同1.2.8RTPCR。
1.2.9.3目的片段回收及测序 用天根公司琼脂糖凝胶回收试剂盒分别回收纯化病毒的PCR产物,将其送往上海杰李生物工程技术有限公司进行测序。
1.2.9.4S基因序列分析 将得到的3个S基因片段拼接成完整的S基因序列,应用DNA Star软件将拼接完整的S基因序列与GenBank中登录的13株TGEV毒株的S基因序列进行同源性比较,并绘制系统发育进化树。
2 结果
2.1病毒分离培养
将处理好的病毒液分别接种ST细胞、L2细胞,在第5代盲传时,ST细胞与第3天出现轻微病变,表现为个别细胞变圆、融合。盲传至第6代48h后可观察到明显的细胞病变(CPE),表现为细胞出现圆缩,聚集成团,少数细胞脱落,在72h后,95%单层细胞脱落,对照细胞正常(图1)。传至第10代时细胞病变稳定,产生病变时间为40h。L2细胞在盲传第7代后仍无病毒生长,初次分离的TGEV在L2细胞上很难生长,所以ST细胞[13-14]是分离病毒株的合适生长细胞,对分离到的病毒株可以做初步鉴定。

图1 正常的ST细胞与接种后72h的ST细胞(100×)Fig.1 Normal ST cells and infected ST cells after 72h(100×)
2.2噬斑克隆纯化试验
TGEV-SDW1株在ST细胞上形成与参考毒株TGEV-purdue相同噬斑特征,噬斑形态均一,直径在2mm~3mm左右,外形圆而规则(图2)。
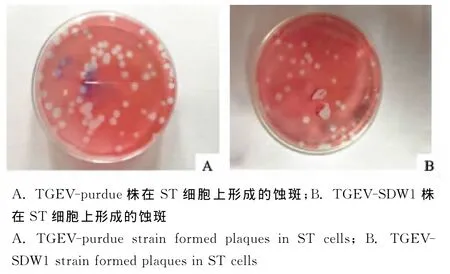
图2 TGEV-purdue与TGEV-SDW1株在ST细胞上形成的蚀斑Fig.2 TGEV-purdue and TGEV-SDW1strain formed plaques in ST cells
2.3分离病毒TCID50的测定
TGEV-SDW1第11代培养物TCID50为10-4.59/0.1mL。
2.4病毒的理化特性鉴定
2.4.1病毒核酸类型的鉴定 按Reed-Muench公式计算TCID50,结果TGEV-SDW1毒株试验组的TCID50为1×10-4.59/0.1mL,对照组的TCID50为1 ×10-4.78/0.1mL,二者的T CID50的对数差值小于1,表明5-BUDR不能抑制该株病毒的增殖,证明该株病毒的核酸类型为RNA。
2.4.2病毒抵抗力的测定 病毒抵抗力的试验结果表明,分离的病毒株均耐酸、耐胰酶;对乙醚、氯仿、热比较敏感。
2.5间接免疫荧光鉴定
2.5.1鼠抗TGEV高免血清的制备 免疫老鼠血清抗体的琼扩效价达到1∶8以上时采血,中和试验测定血清效价,鼠抗TGEV-purdue株中和抗体效价为1∶1 024,鼠抗TGEV-SDW1株中和效价为1∶256。
2.5.2IFA试验 用TRITC标记的羊抗鼠IgG抗体,采用IFA进行鉴定,用TCS-SP5激光共聚焦显微镜观察情况。结果表明,共聚焦显微镜下观察ST细胞的细胞核经DAPI染色后呈蓝色荧光,被TGEV-SDW1株感染的细胞18h后胞浆中可见特异性橙红色荧光,有完整的细胞形态,周围未被病毒感染的细胞不见橙红色荧光(图3)。
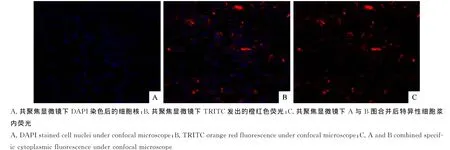
图3 TGEV-SDW1免疫荧光抗体鉴定结果Fig.3 The identification results of TGEV-SDW1by immunofluorescence antibody
2.6动物回归试验
试验组仔猪在接种40h后出现典型的猪传染性胃肠炎临床症状,表现为短时间呕吐,伴有黄色水样腹泻,体重快速下降,脱水;接种68h后死亡1只,剖检发现肠管扩张,充满液体,小肠壁变薄;第4天死亡4只,第6天全部死亡,致死率为100%,对照组正常。应用RT-PCR方法检测死亡仔猪的肠道粪便处理液,结果TGEV均为阳性。
2.7RT-PCR的鉴定结果
TGEV-SDW1株病料处理液、纯化的TGEVSDW1株和分离毒株动物回归试验中的肠道病料,均能扩增出与参考株TGEV-purdue相同的1 148bp目的片段(图4),从而确定该株病毒为TGEV。对照仔猪肠道病料扩增结果均为阴性。
2.8S基因序列进化分析
将所测的TGEV-SDW1株S基因序列与GenBank中登录的国内外13株TGEV毒株的相应序列进行同源性比较分析。结果表明,TGEVSDW1株与13株TGEV毒株氨基酸同源性很高,在96.0%~99.4%之间;核苷酸同源性与TH-98株最高,可达98.2%;与DAE株同源性最低,为77.7%。核苷酸系统发育进化树(图5)结果显示,TGEVSDW1分离株与KT2亲缘关系较近,处于同一分支。
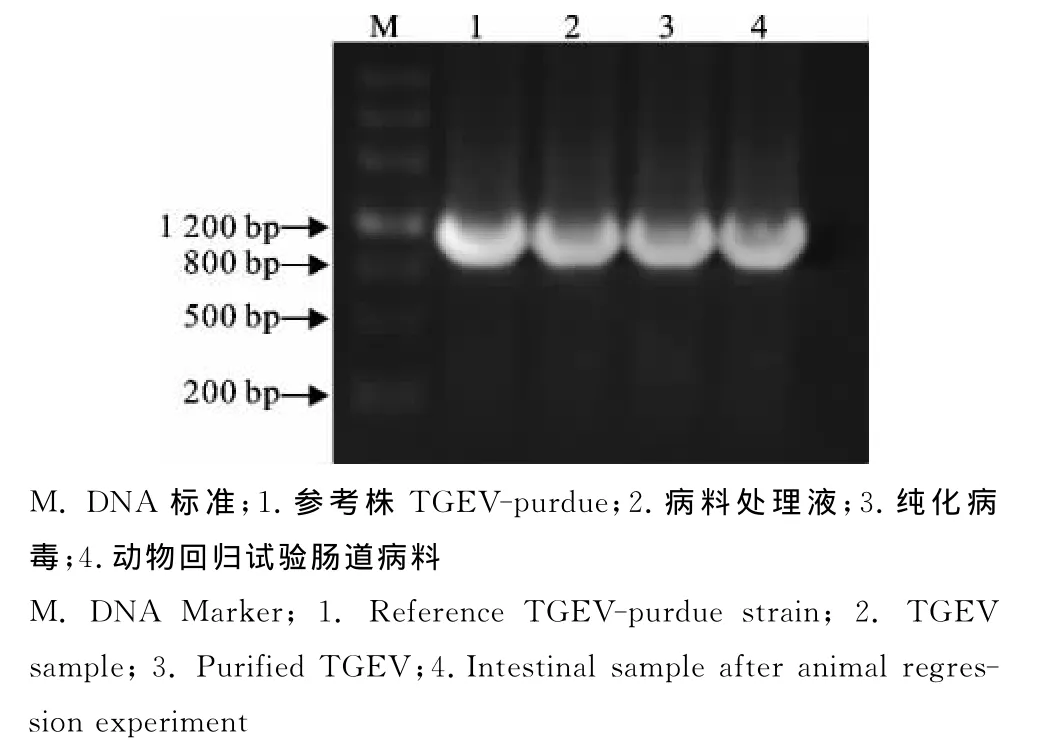
图4 RT-PCR鉴定结果Fig.4 Identification results of TGEV-SDW1by RT-PCR
3 讨论

图5 TGEV-SDW1分离株S基因进化树分析Fig.5 Phylogenetic tree analysis of S gene of TGEV-SDW1strain
本研究对山东省大型养猪场疑似感染TGEV的仔猪肠道粪便,采用较为敏感的传代系ST细胞[15]进行了病毒分离培养,由于初代培养适应细胞比较困难所以在分离初期病料采用了含100g/L胎牛血清的DMEM稀释,并保持pH 7.0左右,研究认为S蛋白与宿主细胞受体结合受pH的影响[16-18]。细胞病变现象是病毒在细胞内增殖及其对细胞产生损害的最明显的表现。由于各种TGEV毒株毒力的差异,当细胞接种病毒的时候,其出现CPE的时间也不尽相同,某些毒株即或是盲传多代也不出现病变,因此本试验尽可能多的盲传多代,而且等到CPE稳定后,才对病毒进行其他鉴定。猪传染性胃肠炎病毒、猪流行性腹泻病毒和猪轮状病毒均可导致仔猪腹泻,这3种病毒均有可能在ST细胞上增殖,因此本试验采用了蚀斑克隆纯化技术。不同病毒在相同的细胞上形成的蚀斑特征不一样,同一种病毒在同一种细胞上形成蚀斑特性一般比较稳定,根据分离株与TGEV参考株相同噬斑特征,从而提高病毒的检出率。通过对分离病毒理化特性的鉴定,证实该病毒是一种耐酸、胰酶,对乙醚、氯仿、热比较敏感RNA病毒,非常符合猪传染性胃肠炎病毒理化特性。间接免疫荧光(IFA)试验采用自制的单克隆抗体作为一抗,TRITC标记的羊抗鼠IgG作为二抗,DAPI染色,用TCS-SP5激光共聚焦显微镜观察,TRITC发出橙红色荧光,DAPI可以将细胞核染成蓝色,这样可以清楚的检测到分离病毒感染ST细胞的情况,从而提高分离病毒检出的特异性和敏感性。为了深入研究分离病毒的致病性,采用动物回归试验,攻毒组仔猪出现特征性的TGE临床症状和病理剖检变化,因此,分离毒株对仔猪有致病性,为深入开展该株病毒的致病机理奠定了基础。本试验采用RT-PCR方法鉴定分离毒株,排除了细菌和PEDV感染的可能,从而保证分离的病毒为TGEV。综合分析以上结果,证明所分离到的病毒为TGEV。
TGEV是一类有包膜的单股正链RNA病毒,基因组编码4种结构蛋白,其中纤突糖蛋白(S)位于病毒最外层,决定宿主细胞的亲嗜性、病毒的致病性和病毒的血凝活性,同时也是诱导机体产生中和抗体的主要保护性抗原[19-22]。因此,研究S基因有利于了解TGEV的基因重组、抗原变异、病毒感染机制和基因变化的规律。本研究对TGEV-SDW1株S基因序列进行了测序分析,结果表明,分离株S基因片段长为4 350bp,与13株TGEV毒株核苷酸同源性在98.2%~77.7%,虽然分离毒株与其他13株TGEV毒株核苷酸同源性差异较大,但是氨基酸同源性却很高,在96.0%~99.4%之间,这说明S基因点突变很多因该是无意义突变,这种突变的累积能否引起病毒特性的变化,这个问题还有待进一步研究。核苷酸系统发育进化树结果显示,TGEVSDW1株与中国分离的KT2亲缘关系最近,处于同一分支;与中国分离的HN2002、TS、TSX和TH-98株,韩国分离的KT3和133株,日本分离的T014株,西班牙分离的56-165株亲缘关系都比较近;与韩国分离的DAE株,美国分离的NEB72-RT株,中国分离的HR/DN1株和西班牙分离的Pur46-MAD株亲缘关系相距较远,表明TGEV-SDW1株因该是来自与我国和我国周边国家的变异株。
参考文献:
[1] Saif L J,Wesley R D.Transmissible gastroenteritis[M]//In Diseases of Swin(Leman A D,Straw B E,Mengeling W L eds),Iowa State University Press,Ames,IA.1992:362-386.
[2] Doyle L P,Huthing L M.A transmissible gastroenteritis in pig [J].J Am Vet Med Assoc,1946,108:257-259.
[3] 郭万柱,刘亚刚,娄高明.兽医病毒学[M].四川成都:四川科学技术出版社,2003.
[4] 姜春霞,马广鹏,姜艳平,等.猪传染性胃肠炎病毒LJ-12株的分离与鉴定[J].畜牧与兽医,2013(3):47-50.
[5] 丁 利,陈光达,许信刚,等.猪传染性胃肠炎病毒陕西株的分离鉴定[J].中国兽医杂志,2011,47(10):9-12.
[6] 郭容利,倪艳秀,温立斌,等.猪传染性胃肠炎病毒江苏株的分离与鉴定及其S基因序列分析[J].华北农学报,2013,28(5):74-79.
[7] Weiwei H,Qinghua Y,Liqi Z,et al.Complete genomic sequence of the coronavirus transmissible gastroenteritis virus SHXB isolated in China[J].Arch Virol,2014,159(9):2295-2302.
8 Hou YYue XCai Xet al.Complete genome of transmissible gastroenteritis virus AYU strain isolated in Shanghai,China [J].Virol J,2012,86(21):1193-1195.
[9] 王建中.猪传染性胃肠炎病毒S基因实时荧光定量RT-PCR检测方法的建立及初步应用[J].中国畜牧兽医,2014,41(1):66-71.
[10] 焦 洋,姜 焱,王凯民,等.猪传染性胃肠炎病毒、猪流行性腹泻病毒和猪博卡病毒多重PCR检测方法的建立[J].动物医学进展,2013,34(8):71-75.
[11] 郑世民,周首龙,赵良友,等.猪传染性胃肠炎和流行性腹泻病毒二联RT-PCR检测方法的建立[J].东北农业大学学报,2014,45(6):57-60.
[12] 刘 邓,袁秀芳,徐丽华,等.猪流行性腹泻病毒和猪传染性胃肠炎病毒双重RT-PCR鉴别方法的建立[J].动物医学进展,2009,30(10):1-5.
[13] 任晓峰,佟玲,孙雪娇,等.猪传染性胃肠炎病毒(TGEV)种毒特性研究[J].东北农业大学学报,2013,44(6):1-7.
[14] 魏 凤,管 宇,肖跃强.PK15、ST细胞增殖猪传染性胃肠炎病毒的比较研究[J].黑龙江畜牧兽医,2014(1):125-126.
[15] Ding L,Xu X,Huang Y,et al.Transmissible gastroenteritis virus infection induces apoptosis through FasL-and mitochondriamediated pathways[J].Vet Microbiol,2012,158(1-2):12-22.
[16] Nash T C,Buchmeier M J.Entry of mouse hepatitis virus into cells by endosomal and nonenndosomal pathways[J].Virology199723311-8.
[17] Shahwan K,Hesse M,Mork A K,et al.Sialic acid binding properties of soluble coronavirus spike(S1)proteins:differences between infectious bronchitis virus and transmissible gastroenteritis virus[J].Viruses,2013,5(8):1924-1933.
[18] Schwegmann-Wessels C,Bauer S,Winter C,et al.The sialic acid binding activity of the S protein facilitates infection by porcine transmissible gastroenteritis coronavirus[J].Virol J,2011,12(8):43-45.
[19] 苏君鸿,李云岗,陈树林,等.以乳酸杆菌为载体的猪传染性胃肠炎病毒S基因A、D抗原位点DNA疫苗的构建[J].动物医学进展,2009,30(8):19-23.
[20] Zhao Q,Zhu J,Zhu W A,et al.Monoclonal antibody against transmissible gastroenteritis virus generated via immunization of a DNA plasmid bearing TGEV S1gene[J].mAb Immunodiagn Immuother,2013,32(1):50-54.
[21] Yin J C,Ren X F,T ian Z J,et al.Assembly of pseudorabies virus genome based transfer vehicle carrying major antigensites of S gene o f transmissible gastroenteritis virus:Potential perspective for developing live vector vaccines[J].Biologicals,2007,35(1):55-61.
[22] 秦志华,张明宇,张传美,等.猪传染性胃肠炎病毒纤突蛋白抗原表位区的表达及其免疫原性分析[J].中国兽医杂志,2014,50(7):22-24.
Isolation and Identification of Transmissible Gastroenteritis Virus and Phylogenetic Analysis of S Gene
SUN Qiu-yan,GUO Hong-mei,SHEN Mei-yan,WANG Zhi-yuan
(Shandong Vocational Medicine College of Animal Science and Veterinary,Weifang,Shandong,261061,China)
Abstract:A TGEV strain was isolated with ST cell line from the faeces of a suspectively TGEV-infected piglet in a pig farms of Shandong province.Identification was conducted by purified plaque,virus physicochemical properties,indirect fluorescent antibody test,animal experiment and RT-PCR.The plaque of this strain is morphologically homogeneous with diameter about 2to 3mm,round and regular at ST cell.This RNA virus is resistant to acid,pancreatic enzymes,but sensitive to ether,chloroform and heat.The visible specific cytoplasmic fluorescence was identified in the infected cells through the indirect immunofluorescence assay(IFA);Distinct orange fluorescence was found in the cytoplast.Clinic symptom of TGE can be got from the animal experiment,and target band was obtained through RT-PCR.These results demonstrated that the isolated virus is porcine transmissible gastroenteritis virus(TGEV),named TGEV-SDW1 strain.S gene was amplified by RT-PCR,in which the primers were designed based on nucleotide sequence of S gene of 13TGEV strains published in GenBank.Then S gene was sequenced and analyzed.The length of S gene is 4 350bp,this result showed that amino acid homology is high in 96.0%-99.4%;the nucleotide sequence homologies compared with TH-98and DAE strain were 98.2.%and 77.7%,respectively.The results of the phylogenetic tree analysis found that TGEV-SDW1was in the same branch with KT2of China. TGEV-SDW1strain should be variants to the strains in our country and surrounding countries.
Key words:Porcine transmissible gastroenteritis virus;isolation and identification;S gene;RT-PCR;phylogenetic analysis
作者简介:孙秋艳(1978-),女,山东单县人,讲师,硕士研究生,主要从事预防兽医学研究。*通讯作者
基金项目:山东省生猪产业体系潍坊实验站项目(SDAIT-06-021-12);山东省潍坊市科学技术发展计划项目(201301141)
收稿日期:2014-12-17
中图分类号:S852.659.6;Q789
文献标识码:A
文章编号:1007-5038(2015)07-0007-06

