伊维菌素微乳制剂的安全性试验
邢守叶,周绪正,李 冰,牛建荣,魏小娟,张继瑜*(1.甘肃农业大学动物医学院,甘肃兰州730070;.中国农业科学院兰州畜牧与兽药研究所/农业部兽用药物创制重点实验室,甘肃兰州730050)
伊维菌素微乳制剂的安全性试验
邢守叶1,2,周绪正2,李冰2,牛建荣2,魏小娟2,张继瑜2*
(1.甘肃农业大学动物医学院,甘肃兰州730070;2.中国农业科学院兰州畜牧与兽药研究所/农业部兽用药物创制重点实验室,甘肃兰州730050)
摘 要:按照《中国兽药典》2010版和《兽药及添加剂安全性毒理学评价程序》的要求,对伊维菌素微乳制剂进行肌肉刺激性试验、热原试验和注射途径LD50测定,为其临床应用提供安全性依据。肌肉刺激性试验,观察4只家兔注射伊维菌素微乳制剂后48h的变化;热原试验,测家兔的体温变化,判断伊维菌素微乳制剂所含热原的限度是否符合规定;LD50测定,分别给大鼠、小鼠按组一次腹腔注射不同剂量的伊维菌素微乳,连续观察7d~14d,记录各组动物急性毒性反应的症状、病理变化、死亡时间,按简化寇氏法计算其半数致死量(LD50)及95%可信限。结果表明,伊维菌素微乳制剂对家兔股四头肌未见明显刺激作用;热原限度符合规定,无致热源;伊维菌素微乳制剂对大鼠、小鼠腹腔注射的LD50为其临床推荐用量(0.2mg/kg)的191.28倍和161.00倍,并且高于伊维菌素原料药的LD50(24.249 3mg/kg)。伊维菌素微乳制剂的安全性试验结果提示其安全可靠。
关键词:伊维菌素;微乳;肌肉刺激性试验;热原试验;急性毒性试验;安全性评价
微乳(microemulsion,ME)又称纳米乳(nanoemulsion),是粒径10nm~100nm由水、油、表面活性剂和助表面活性剂组成的一种新型药物载体。该载体对水溶性、脂溶性以及难溶性药物均有良好的溶解能力,而且具有缓释和靶向作用[1]。由于其物理稳定性和生物利用度高,能够促进药物的吸收,近年来已被国内外广泛应用[2]。而且纳米乳制备不需要特殊的设备,操作简单,易于保存,广泛应用于农药、食品保鲜剂、防腐剂、兽药研制等,前景非常广阔[3]。伊维菌素(ivermectin,IVM)是一种新型高效、广谱、低毒的大环内酯类抗生素,是美国Merck公司合成的第1种阿维菌素(AVM)类药物衍生物[4]。对马、牛、绵羊等多种动物的体内外寄生虫有高效驱杀作用,而且对血矛线虫、库珀线虫、毛圆线虫、奥斯特它线虫、牛疥螨、圆线虫、细颈线虫、仰口线虫、鞭虫、结节线虫、夏柏线虫、网尾线虫等具有94%~100%的驱杀作用[5]。目前,兽医临床应用的伊维菌素制剂,存在每次给药维持时间短,需多次重复给药等缺点,而且普通制剂体内血药浓度起伏大,常出现“峰谷”现象,导致其安全性和有效性均较低[6]。伊维菌素是脂溶性药物,在水中几乎不溶,可溶于许多有机溶剂,如氯仿、甲醇、乙醇、乙酸乙酯、二氯甲烷等[7]。为解决上述问题,我们以纳米乳为载体,制备出一种以80%以上水为溶剂的伊维菌素微乳。伊维菌素微乳主要给药方式为肌肉注射和皮下注射,纳米乳注射液成为伊维菌素的一种新型剂型。
药物的安全性评价是研究、开发新药的一个重要环节,为新药的上市提供全面、客观的依据。为了将伊维菌素微乳制剂合理、安全的应用于临床并提供理论依据,依据《中国兽药典(一部)》2010版[8]对注射剂要求和《化学药物刺激性、过敏性和溶血性研究技术指导原则》[9]对该注射液进行了安全性评价,包括肌肉刺激性试验、热原试验和急性毒性试验。
1 材料与方法
1.1材料
1.1.1主要试剂与仪器 伊维菌素微乳注射液(规格为1g/100mL),中国农业科学院兰州畜牧与兽药研究所研制;流通蒸汽灭菌,临用前用灭菌生理盐水稀释适当倍数;生理盐水(批号为07050202),由山东临淄制药厂生产;电子天平(AY22O型),日本Electronic Balance公司产品;全自动立式电热压力
蒸汽灭菌器(YXQ-LS-50SⅡ),上海博迅公司医疗设备厂生产,注射器(1mL)。
1.1.2实验动物 日本大耳白兔,体重2kg~2.2 kg,雌雄各半;购自中国农业科学院兰州兽医研究所实验动物场,许可证号:SCXK(甘)2010-0001。Wistar大鼠(清洁级,许可证号:SCXK(军)2012-0020),70只,体重180g~220g,雌雄各半,购自兰州军区兰州总医院实验动物中心。昆明系小鼠(普通级,许可证号:SCXK(甘)2010-0001)90只,雌雄各半,体重20g~22g,购自中国农业科学院兰州兽医研究所实验动物场。饲养环境:温度20℃~26℃,相对湿度40%~70%。自由采食饲料,自由饮水。试验前临床健康观察7d。
1.2方法
1.2.1肌肉刺激性试验 取健康日本大耳白兔4只,体重在2kg以上。剪去两侧股四头肌部位的兔毛,用碘酊和乙醇消毒后,自身对照,分别在左侧股四头肌按推荐剂量0.3mg/kg注射伊维菌素微乳注射液1.0mL,右侧股四头肌注射等量的灭菌生理盐水,进针部位为大腿前侧,膝关节和股骨关节之间的1/2处,进针角度为30°~45°。注射后正常饲养,48 h后,解剖取股四头肌,沿肌纤维平行方向切开肌肉,暴露注药部位,观察注射部位肌肉有无刺激(充血、水肿、硬结、变性或坏死)。按《中药药理研究方法学》换算成相应分值[10],并对肌肉刺激进行判断。
1.2.2热原试验 依照《中国兽药典》2010版规定的热原检查方法,经8次预测体温选取适合于热原检查法的健康家兔3只,且正常体温为38.0℃~39.6℃。在试验前停食1h,然后每隔30min测量1次体温,测2次,2次体温差不得超过0.2℃,以此2次体温的平均值为正常体温;在测正常体温后15 min以内,将温热至38℃的伊维菌素微乳制剂,自耳缘静脉按推荐剂量0.3mg/kg注射给药1mL,然后每隔30min测量1次体温,共测6次。以6次体温中,最高的一次减去正常体温,即为该兔体温的升高温度(℃),计算3只家兔体温升高总和,并按照兽药典的热原检查判定标准,判定供试品是否符合热原检查规定。
1.2.3急性毒性试验
1.2.3.1伊维菌素微乳急性毒性试验预试验 分别取大鼠和小鼠每组各4只,雌雄各半,设若干剂量组,依次进行试验,一次性腹腔注射不同剂量的伊维菌素微乳注射液,测定LD0和LD100,分别作为正式试验的致死剂量(a)与致死剂量剂量(b),并观察动物的毒副反应以及死亡情况。根据致死剂量(b)与致死剂量剂量(a)的比值确定正式试验的组数N。按r=lg-1求得相邻两剂量组比值。
1.2.3.2伊维菌素微乳急性毒性试验正式试验
根据预试验结果,将50只大鼠随机分成5组,每组10只,雌雄各半。给药剂量分别为6.00、4.84、3.90、3.14、2.53g/kg。一次性腹腔注射给药。再取70只小鼠随机分成7组,每组10只,雌雄各半。给药剂量分别为8.71、6.50、4.85、3.62、2.70、2.01、1.50g/kg。一次性腹腔注射给药。各组给药后立刻观察动物的外观体征、行为活动、饮食、大小便、呼吸系统、中枢神经系统症状等,并记录症状表现及死亡动物数,给药后连续观察7d~14d。对试验中死亡的动物及时尸检,观察组织器官的体积、颜色有无异常并做详细记录,若肉眼观察异常时,则对该组织进行病理组织学检查。
按照每组动物的死亡数,用以下公式计算LD50及其95%可信限:
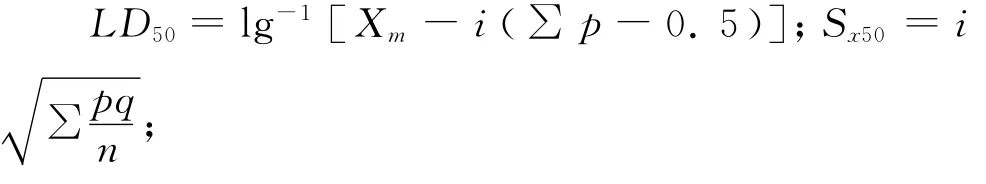
LD50的95%的可信限=lg-1(lgLD50±1.96× Sx50)
式中,Xm为最大剂量的对数值;i为组距,即相邻两组剂量对数值之差;p为各剂量组死亡率(以小数表示);q为各剂量组存活率,q=1-p;∑p为各剂量组死亡率之和;n为各组动物数。
2 结果
2.1肌肉刺激性试验
日本大耳白兔肌注伊维菌素微乳注射液后,健康如常。给药后48h,给药组触摸注射部位无硬结,眼观无肿胀,剖开可见肌肉组织轻度充血或出血,出血点直径都在0.7cm以下,无肌肉坏死、变性现象,4只家兔给药组的反应级数分别为0、2、1、1,平均反应级数为1。氯化钠注射液对照组未见明显刺激反应和病理变化,偶见有出血点,直径在0.2cm以下,4只家兔对照组的反应级数分别为0、0、1、0,平均反应级数为0.25。其平均反应分值均在2以下,认为伊维菌素微乳制剂符合规定。
2.2热原试验
3只家兔在注射伊维菌素微乳制剂前后,体温变化不大,初试3只家兔的体温升高均在0.6℃以下,并且3只家兔体温升高总和低于1.3℃,表明受试品符合热原检查的规定(表1)。
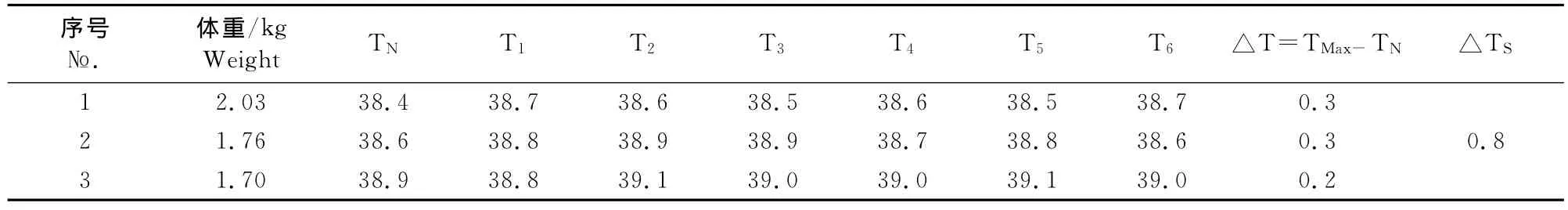
表1 家兔法热原检查Table 1 The result of pyrogen test on rabbits
2.3伊维菌素微乳急性毒性试验
大鼠急性毒性试验预试验结果为LD100(b)=6 g/kg,LD0(a)=2.5g/kg,r=1.24;小鼠急性毒性试验预试验结果为LD100(b)=8.71g/kg,LD0(a)=1.50g/kg,r=1.34。
2.3.1伊维菌素微乳大鼠急性毒性试验正式结果
各剂量组有轻度中毒症状的大鼠表现为给药后50min左右出现食欲减退,呆滞,蜷缩,行动迟缓,被毛凌乱,少数大鼠出现腹泻,粪便变软,为黑色。大部分在给药后12h开始少量饮水采食,活动增加,24h~48h后精神和饮食恢复正常。有严重中毒症状的大鼠表现为给药后50min左右可见身体震颤,被毛竖立,不饮水,不采食,多数大鼠出现腹泻,粪便变软,为黑色。12h后开始出现颤抖,抽搐衰竭致死。死亡高峰出现在给药后12h~96h。对死亡的大鼠进行剖检,可见肝颜色变暗,呈暗红色,边缘有少许出血点,心、肺有少许充血现象,肠系膜充血,部分大鼠可见尿潴留。雄性大鼠和雌性大鼠的死亡率无显著性差异(P>0.05),详见表2。将表中数据代入公式得,伊维菌素微乳对大鼠的LD50= 3.825 6g/kg;LD50的95%可信限为3.463 9g/kg ~4.225 1g/kg。

表2 伊维菌素微乳大鼠急性毒性试验结果Table 2 The results of acute toxicity test with ivermectin microemulsion in rats
2.3.2伊维菌素微乳小鼠急性毒性试验正式结果
各剂量组有轻度中毒症状的小鼠表现为给药后30min左右出现饮食减少,少动,蜷缩。大部分在给药后的2h~4h开始少量饮水饮食,活动增加,12h后精神活动和饮食状况恢复正常。有严重中毒症状的小鼠表现为给药后30min左右,小鼠多数缩作一团,趴卧不起,精神沉郁,不采食,不饮水。8h后开始出现原地侧卧转圈,神经症状明显,抽搐死亡。死亡高峰出现在给药后8h~24h。对死亡的小鼠进行剖检,可见肝、脾轻微肿大,肾颜色变暗,肠系膜充血,部分小鼠可见尿潴留。
雄性小鼠和雌性小鼠的死亡率无显著性差异(P>0.05)(表3)
将表中数据代入公式得,伊维菌素微乳对小鼠的LD50=3.220 0g/kg;LD50的95%可信限为1.8197g/kg~5.697 9g/kg。
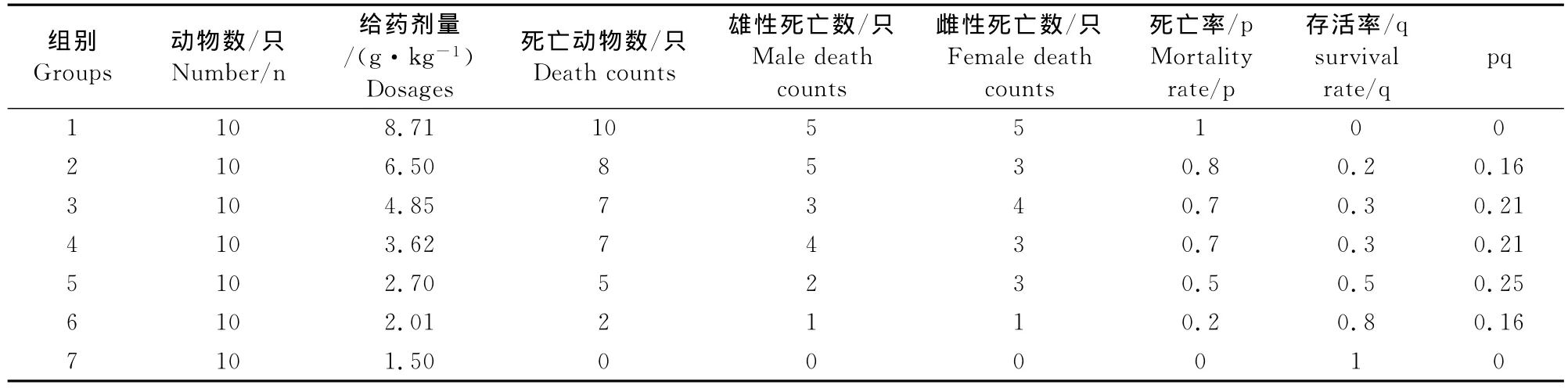
表3 伊维菌素微乳小鼠急性毒性试验结果Table 3 The results of acute toxicity test with ivermectin microemulsion in mice
3 讨论
药物特殊安全性试验是注射剂临床前安全性评价的重要组成部分,主要由肌肉刺激性试验、热原试验和急性毒性试验等组成。任何一项试验结果出现阳性,则表明该药安全性评价不符合标准,不宜用于注射途径给药。
肌肉刺激性试验是以肌肉注射类药物为主的新药开发研制和新药申报中重要的安全性评价检查项目之一。根据评分标准综合计算,日本大耳白兔股四头肌注射伊维菌素微乳注射液48h后平均反应级数为1(2级以下),表明伊维菌素微乳注射液肌注刺激性较小,符合规定,可供肌肉注射,用于寄生虫的防治与驱杀。家兔法检查热原是生物制品质量评价中的一项重要内容,家兔能客观反映各类药品和生物制品中热原在生物体内引起发热情况的特点[11]。经长期应用证明,其检测结果与临床应用基本一致[12-13]。本试验是将伊维菌素微乳制剂由静脉注入家兔体内,在规定的时间里观察家兔体温升高的情况,以判断伊维菌素微乳制剂中所含热原的限度是否符合规定。结果伊维菌素微乳制剂热原检查结果都呈阴性,符合热原试验要求,因此判定伊维菌素微乳不含引起机体发热的内毒素或致热源,对有机体不产生热原反应,符合规定,具有生物安全性。
伊维菌素微乳给大鼠、小鼠腹腔注射的LD50及其95%可信限分别为3.825 6(3.463 9~4.225 1)g/kg和3.220 0(1.819 7~5.697 9)g/kg。由于LD50值均在500mg/kg~5 000mg/kg之间,按毒性分级标准[14]伊维菌素微乳属于低毒性药物。伊维菌素微乳为所含伊维菌素10mg/mL的注射液,换算成伊维菌素原料药,则对大鼠、小鼠腹腔注射的LD50及其95%可信限分别为38.256(34.639~42.251)mg/kg 和32.200(18.197~56.979)mg/kg,为临床推荐用量(0.2mg/kg)的191.28倍和161.00倍,临床注射更安全。据徐霞报道[15],伊维菌素原料药注射液给小鼠腹腔注射的LD50为24.249 3mg/kg,伊维菌素微乳的LD50高于伊维菌素原料药的LD50,可以看出,伊维菌素微乳毒副作用低于伊维菌素原料药注射液,说明伊维菌素制成微乳之后,降低了药物的毒副作用,增加了用药的安全性。
伊维菌素具有广谱,高效,较高的安全性,不易产生耐药性,一次投药效果显著等优势,是兽医临床深受重视的高效抗寄生虫药物[16],但是近年来,偶有因用量过大引起动物中毒的报道[17],少数犬种敏感,正常用量即可出现中毒症状;也有个别犬种偶见过敏,引起死亡的报道[18]。因此,对伊维菌素进行安全性评价,探究伊维菌素微乳的安全性用药范围很有意义。
综上所述,伊维菌素微乳制剂毒性低、刺激性小,可安全用于临床,这为新剂型的研究开发奠定了基础,也为其临床应用提供理论依据。
参考文献:
[1] Szebeni J,Alving C R,Savay S,et al.Formation of complement activating particles in aqueous solutions of Taxol:possible role in hypersensitivity reactions[J].Int J Immunopharmacol,2001,1(4):721-735.
[2] 刘根新,张继瑜,吴培星,等.O/W型药用微乳的制备及评价[J].中国农业科学,2009,42(9):3328-3333.
[3] 刘根新,张继瑜,吴培星,等.伊维菌素纳米乳注射液的研制与质量安全性评价[J].畜牧兽医学报,2011,42(8):1161-1167.
[4] 冯明教,马满堂,岳 磊,等.伊维菌素研究进展[J].上海畜牧兽医通讯,2006(6):15-16.
[5] Courtney C H,Roberson E L.Antinematodal drugs,in Veterinary Pharmacology and Therapeutics[M],7th Edition.edited by H.R.Adams,Iowa State University Press,1995:916-825.
[6] 赵永星,张雪晓,孙倩,等.注射用伊维菌素亚微乳的制备及其稳定性研究[J].中国兽药杂志,2010,44(6):27-29.
[7] 符华林,吴 蕾.伊维菌素脂质体的制备及质量控制研究[J].动物医学进展,2004,25(6):102-104.[a2]
[8] 中国兽药典委员会.中华人民共和国兽药典:一部[M].北京:中国农业版社,2010.
[9] 《化学药物急性毒性试验技术指导原则》课题研究组.化学药物急性毒性试验技术指导原则[S].国家药物评审中心,2005:1-3.
[10] 陈 奇.中药药理研究方法学[M].2版.北京:人民卫生出版社,2005:1-3.
[11] 徐文瑜,任 珺,杜 颖,等.家兔性别与体温变化对热原检查结果的影响[J].实验动物科学与管理,2006,23(3):22-25.
[12] 刘素英,汪穗福.热原检查法的研究概况[J].中华临床医学与护理,2004,3(3):90-91.
[13] Kauffman C A,Jones P G,Kluger M J.Feyer and malnutrition:endogenous pyrogen/interleukin-1in malnourished patients[J].Am J CI in Nutr,1986,44:44.
[14] 沈建忠.动物毒理学[M].北京:中国农业出版社,2002.
[15] 徐 霞,匡光伟,邓 辉,等.伊维菌素脂质体的急性性试验[J].中国兽医寄生虫病,2006,14(4):11-13.
[16] 刘根新,王福厚,车清明,等.伊维菌素不同制剂在兽医临床的应用[J].中国兽药杂志,2011,42(12):53-55.
[17] 白 涛,李长安,雷武原.犬伊维菌素中毒的治疗[J].畜牧兽医杂志,2014,33(5):151.
[18] 杨 怀,简 嘉.一例犬伊维菌素中毒的治疗心得[J].湖北畜牧兽医,2006(1):33.
Safety Test of Ivermectin Microemulsion
XING Shou-ye1,2,ZHOU Xu-zheng2,LI Bing2,NIU Jian-rong2,WEI Xiao-juan2,ZHANG Ji-yu2
(1.College of Veterinary Medicine,Gausu Agricultural University,Lanzhou,Gansu,730050,China;2.Lanzhou Institute of Husbandry and Pharmaceutical Sciences,Chinese Academy of Agricultural Sciences/Key Laboratory of New Animal Drug Discovery,Ministry of Agriculture,Lanzhou,Gansu,730070,China)
Abstract:This experiment was conducted to evaluate the reliability of ivermectin microemulsion injection by testing the muscle stimulation,pyrogen test and acute toxicity test according to 2010edition of Chinese Veterinary Pharmacopoeia.In the muscle stimulation test,four rabbits were observed for 48hafter injecting ivermectin microemulsion injection.In the pyrogen test,temperature changes were detected in rabbits to test the pyrogen of ivermectin microemulsion;The different dosages of ivermectin microemulsion were used to mice and rats by intraperitoneal injection;then mice and rats were observed seven to fourteen days;the acute toxical symptoms,pathological lesions,death time were observed and the LD50and 95% confidence limit was calculated by simplify Karber method.The results showed that there were no significant stimulation to muscle;The pyrogen test of ivermectin microemulsion was negative and its pyrogen accords with the standard limitation;The LD50of ivermectin microemulsion by intraperitoneal injection in mice and rats are higher than that of ivermectin injection(24.249 3mg/kg).These results indicated that ivermectin microemulsion is safe and reliable based on the animal experiments.
Key words:ivermectin;microemulsion;muscle stimulation test;pyrogen test;acute toxicity;safety evaluation
通讯作者
作者简介:邢守叶(1988-),女,山东人,硕士研究生,主要从事兽医药理学与毒理学研究。*
基金项目:国家现代农业肉牛牦牛产业技术体系建设专项 (CARS-38);重点牧区生产生态生活保障技术集成与示范项目(2012BAD13BOO)
收稿日期:2014-09-26
中图分类号:S853.7
文献标识码:A
文章编号:1007-5038(2015)05-0069-05

