吗啡预处理对H9c2心肌细胞缺氧/复氧时microRNA表达的影响
韩正怡,何淑芳,程 洁,许士进,杨 婉,张 野
(安徽医科大学第二附属医院麻醉科,安徽合肥 230601)
吗啡预处理对H9c2心肌细胞缺氧/复氧时microRNA表达的影响
韩正怡,何淑芳,程 洁,许士进,杨 婉,张 野
(安徽医科大学第二附属医院麻醉科,安徽合肥 230601)
中国图书分类号:R-332;R322.11;R329.25;R342.2;R542.2;R845.22;R971.2
摘要:目的 探讨吗啡预处理(morphine preconditioning,MPC)对H9c2心肌细胞缺氧/复氧(hypoxia reoxygenation,H/R)时microRNA(miRNA)表达的影响,为明确其机制提供参考。方法 培养H9c2心肌细胞,随机分为3组(n=4):①正常对照组(CON):H9c2心肌细胞置于DMEM/F12细胞培养液常规培养;②缺氧/复氧组(H/R):对心肌细胞行缺氧5 h/复氧1 h处理;③吗啡预处理组(MPC+H/R):在H/R前,应用1 μmol·L-1吗啡预处理10 min。处理结束后,采用CCK-8法检测细胞增殖、化学比色法检测细胞培养液中乳酸脱氢酶(LDH)活性、Annexin-V-FITC/PI双染法检测细胞凋亡、Western blot法检测细胞内Fas蛋白表达、荧光定量RT-PCR法检测细胞miRNA表达水平。结果 与CON组比,H/R组细胞活力降低,LDH活性升高,细胞凋亡率增加,Fas蛋白水平升高(P<0.01);MPC可明显提高细胞活力,降低LDH活性,抑制细胞凋亡,降低Fas蛋白水平(P<0.01)。qRT-PCR结果显示,与CON组相比,H/R组miR-133a-5p、miR-133b-5p、miR-664-1-5p、miR-6216和let-7e-5p表达明显下调,而MPC能明显地抑制H/R对这些miRNA表达的下调作用(P<0.01)。结论 吗啡预处理减轻H9c2心肌细胞缺氧/复氧损伤可能与调控miR-133a-5p、miR-133b-5p、miR-664-1-5p、miR-6216和let7e-5p等miRNA表达有关。
关键词:吗啡预处理;H9c2心肌细胞;缺氧/复氧;凋亡;Fas;微小RNA
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.030.html
心肌缺血/再灌注损伤(ischemia reperfusion in-jury,IRI)常发生于急性心肌梗死溶栓治疗后、冠状动脉成形或搭桥术后,以及体外循环手术过程中等,严重影响缺血后心脏功能的恢复,威胁患者的生命安全。缺血预处理(ischemic preconditioning,IPC)是迄今为止最有效的内源性心肌保护方法[1]。本课题组前期研究表明,阿片类药物如吗啡、瑞芬太尼预处理可模拟IPC发挥心肌保护效应[2-4]。然而,阿片预处理(opioid preconditioning,OPC)的心肌保护机制可能涉及多种信号通路和分子,其确切分子机制尚不明确。
microRNA(miRNA)是近年来新发现的内源性、单链、非编码小RNA。已知miRNA参与调控心肌细胞凋亡,在心肌缺血、再灌注以及预处理过程中均发挥重要作用[5]。最近研究表明,miRNA还参与阿片相关的多种生物学过程,如药物成瘾与耐受、镇痛、免疫调节、病毒感染以及阿片受体调节等[6]。但OPC是否通过miRNA来调控相应的靶基因和信号通路发挥心肌保护作用,目前尚未见报道。本课题组前期利用miRNA芯片技术研究发现,吗啡预处理(morphine preconditioning,MPC)可诱导大鼠心肌细胞miRNA表达谱发生明显改变。在此基础上,本研究拟进一步探讨MPC对H9c2心肌细胞缺氧/复氧(hypoxia reoxygenation,H/R)时miR-133a-5p、miR-133b-5p、miR-664-1-5p、miR-6216和let-7e-5p表达的影响,为OPC的心肌保护作用机制研究提供新的理论依据。
1 材料与方法
1.1材料
1.1.1细胞株 大鼠H9c2(2-1)胚胎心肌细胞株
(中科院上海细胞库)。
1.1.2药物与试剂 盐酸吗啡注射液1 mL:10 mg(东北制药集团沈阳第一制药有限公司,批号:121206-2)。DMEM/F12细胞培养液购自美国Hy-clone公司;胎牛血清、0.25%胰酶消化液购自加拿大Wisent公司;TRIzol购自美国Invitrogen公司;细胞增殖检验试剂盒(cell counting kit-8,CCK-8)购自日本同仁化学研究所;乳酸脱氢酶(lactic acid dehy-drogenase,LDH)试剂盒购自南京建成生物工程研究所;Annexin-V-FITC/PI双染凋亡试剂盒购自美国铂优公司;PVDF膜购自美国Bio-Rad公司;鼠抗β-actin单克隆抗体、兔抗Fas多克隆抗体购自美国Santa Cruz生物技术公司;HRP标记羊抗兔、羊抗鼠抗体购自北京中杉生物技术公司;ECL发光试剂盒购自美国Pierce公司;All-in-OneTMmiRNA qRT-PCR Detection Kit及miRNA引物均购自广州复能基因有限公司。
1.1.3仪器 细胞培养箱(美国Thermo公司);缺氧小室(加拿大Stem Cell公司);KHB ST-360酶标仪(中国上海科华实验系统有限公司);Cytomics FC 500流式细胞仪(美国Beckman公司);CXY-6C型电泳仪(北京六一仪器厂);Tanon Fine Do X6全自动化学发光图像分析系统(上海天能科技有公司);荧光定量PCR仪(美国ABI公司)。
1.2方法
1.2.1细胞培养 大鼠H9c2(2-1)胚胎心肌细胞株置于37℃、5%CO2培养箱(95%空气)中,含10%胎牛血清的DMEM/F12完全培养液培养。细胞贴壁80%~90%时,用0.25%胰酶0.02%EDTA消化,计数,以1∶3的比例传代,每2~3天传代1次。取对数生长期的细胞用于后续实验。
1.2.2心肌缺氧/复氧损伤模型的建立 参照文献[7]并加以改良进行。心肌细胞生长达90%后,弃去含10%胎牛血清的DMEM/F12培养液,加入无血清无糖的缺氧液,并将细胞置于缺氧小室,通入95%N2+5%CO2的混合气饱和5 min,驱除氧气。置于37℃培养箱中培养5 h实施缺氧,用含10%胎牛血清的DMEM/F12正常培养1 h模拟复氧。
1.2.3实验分组及处理 依据不同的实验要求,对细胞进行如下分组处理:对照组(CON)细胞正常培养;缺氧/复氧组(H/R)细胞行缺氧5 h/复氧1 h处理;吗啡预处理组(MPC+H/R)细胞参照前期及预实验结果,以含吗啡(终浓度为1 μmol·L-1)的无血清DMEM/F12孵育细胞10 min,再进行H/R处理。每组4个复孔(n=4)。
1.2.4CCK-8法检测细胞增殖 取对数生长期心肌细胞,接种于96孔培养板内,每孔4×103个细胞,置于37℃、5%CO2培养箱培养。按上述方法进行分组及处理,结束后每孔加入10 μL CCK-8溶液(加入的体积为原来培养体积的10%),细胞培养箱内继续孵育4 h,置于酶标仪上450 nm测定各组吸光度。在不含细胞的培养液中加入等量CCK-8溶液,按相同方法测定吸光度作为空白对照孔。细胞增殖活力=测定的吸光度-空白对照孔吸光度,并计算平均值。实验独立重复4次。
1.2.5乳酸脱氢酶(LDH)活性的测定 接种于96孔培养板的心肌细胞,于H/R结束后,每组各取40 μL培养液,严格按照LDH试剂盒说明书操作,利用化学比色法检测LDH活性。实验独立重复4次。
1.2.6Annexin-V-FITC/PI双染法检测细胞凋亡取对数生长期的H9c2心肌细胞,调整细胞浓度为每孔2×106个细胞,接种到6孔板中,置于37℃、5%CO2培养箱培养。按上述方法进行分组及处理,H/R结束后,用不含EDTA的胰酶消化并收集细胞,1 500 r·min-1离心(离心半径16 cm)5 min,PBS漂洗2次,收集细胞。用500 μL的Annex-in-V Binding Buffer重悬细胞,每组加入5 μL的An-nexin-V-FITC混匀,再加入5 μL的PI混匀。室温下避光孵育10 min,转移入流式管中,采用流式细胞仪测定细胞凋亡率。以未染色细胞调零,以Annex-in-V-FITC单染管和PI单染管作为基准参照,测定每个上样管数据,每个样本均获取10 000个细胞,用FCS Express V 3.0软件进行分析。实验独立重复4次。
1.2.7Western blot法检测Fas蛋白水平 接种于6孔培养板的心肌细胞,H/R结束后,弃培养液。4℃预冷PBS清洗细胞,培养板中加入蛋白裂解液充分裂解细胞,15 000 r·min-14℃离心10 min,吸取上清,BCA法测定样品蛋白含量后分装保存。每组取10 μg蛋白行聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳后将蛋白转移至PVDF膜。将PVDF膜在封闭液(含5%脱脂牛奶的TBST溶液)中室温孵育1 h,随后置于兔抗Fas多克隆抗体或鼠抗β-actin单克隆抗体中,4℃摇床孵育过夜,TBST洗膜3次;再将膜置入辣根过氧化物酶(HRP)标记二抗中室温孵育1 h,TBST洗膜3次;采用ECL发光试剂盒,在Tanon全自动凝胶成像系统中自动曝光采集图像,并进行条带光密度分析。
1.2.8荧光定量RT-PCR检测心肌细胞miRNAs表达水平 接种于6孔培养板的心肌细胞,H/R结
束后,弃培养液收集细胞。按照RNA提取试剂TR-Izol的说明书进行操作,每孔加1 mL TRIzol置于冰上裂解15 min,提取细胞总RNA。经氯仿萃取,异丙醇法沉淀,75%无水乙醇洗涤法浓缩,DEPC水溶解后,用紫外分光光度计检测总RNA的浓度和纯度,制成RNA样品。按照All-in-OneTMmiRNA qRT-PCR Detection Kit试剂盒说明书,将RNA逆转录为cDNA后用于检测miR-133a-5p、miR-133b-5p、miR-664-1-5p、miR-6216、let-7e-5p及内参基因U6的表达量(引物序列保密)。逆转录反应条件为:37℃60 min,85℃5 min;PCR扩增条件为:95℃预变性10 min,95℃10 s,60℃30 s,重复45个循环进行扩增;反应结束后建立溶解曲线。同时设去离子水阴性对照,采用U6 RNA作为各组内标,进行归一化。采用StepOne Software v 2.3软件进行数据分析。同一实验重复4次,实验数据分析采用2-△△CT法计算[8]。
1.2.9统计学分析 采用SPSS 10.0统计软件进行分析,计量资料±s表示,多组间数据比较采用单因素方差分析(ANOVA),组间两两比较采用SNK检验。
2 结果
2.1MPC增加H9c2心肌细胞活力 各组经过处理后,心肌细胞活力分别为:CON组(1.43±0.08)、H/R组(0.69±0.10)、MPC+H/R组(1.11± 0.12)。与CON组相比,H/R可明显降低心肌细胞活力(P<0.01),而MPC则明显增加心肌细胞活力(P<0.01),见Fig 1。

Fig 1 Morphine preconditioning increased cell viability in H9c2 myocardial cells(±s,n=4)
2.2MPC降低H9c2心肌细胞LDH活性 心肌细胞培养液中的LDH水平可反映细胞损伤程度。与CON组(120±10)相比,H/R组LDH活性明显升高(281±10,P<0.01);而MPC则可以明显减轻H/R损伤,培养液中LDH活性明显降低(151±10,P<0.01)(单位:IU·L-1),见Fig 2。

Fig 2 Morphine preconditioning reduced LDH activity in H9c2 myocardial cells(±s,n=4)
2.3MPC抑制H9c2心肌细胞凋亡 在流式细胞散点分析图上划十字门,如Fig 3A所示,正常细胞显示为图中左下区细胞簇(FITC-PI-),早期凋亡细胞显示为图中右下区细胞簇(FITC+PI-),晚期凋亡及死亡细胞显示为图中右上区细胞簇(FITC+PI+)。从Annexin-V-FITC/PI荧光双参数点图观察到,CON组细胞主要分布在左下象限,细胞状态良好,右下象限为少量凋亡细胞(FITC+PI-:3.2%± 1.2%);H/R组右下象限出现大量凋亡细胞(FITC+PI-:25.4%±2.4%,P<0.01);而MPC+H/R组凋亡细胞明显减少(FITC+PI-:9.3%±1.6%,P <0.01)(Fig 3B),说明MPC可抑制H/R损伤诱导的心肌细胞凋亡。
2.4MPC降低H9c2心肌细胞Fas蛋白表达 Fas蛋白是细胞内重要的凋亡调控蛋白。Western blot结果显示,H/R损伤组细胞内Fas蛋白表达水平明显升高,是CON组的(1.7±0.2)倍(P<0.01);而MPC则下调细胞内Fas蛋白表达,与H/R组相比,差异具有统计学意义(1.2±0.4,P<0.01),见Fig 4。说明MPC可抑制凋亡蛋白Fas表达,减轻H/R损伤。
2.5MPC对H9c2心肌细胞miRNA表达水平的
影响 荧光定量RT-PCR结果显示,与CON组相比,H/R损伤组miR-133a-5p、miR-133b-5p、miR-664-1-5p、miR-6216、let-7e-5p的表达水平均明显下调,分别降低至(0.34±0.06)、(0.18±0.06)、(0.28±0.02)、(0.29±0.02)、(0.29±0.03)(P<0.05),而MPC减轻心肌细胞损伤的同时,也可明显上调上述miRNA在心肌细胞的表达水平,分别升高至(4.29±0.42)、(5.72±0.63)、(7.37±0.51)、(7.71±0.29)、(9.39±0.48)(P<0.01),见Fig 5。

Fig 3 Morphine preconditioning inhibited apoptosis in H9c2 myocardial cells(±s,n=4)

Fig 4 Morphine preconditioning decreased Fas protein expression in H9c2 myocardial cells(±s,n=4)
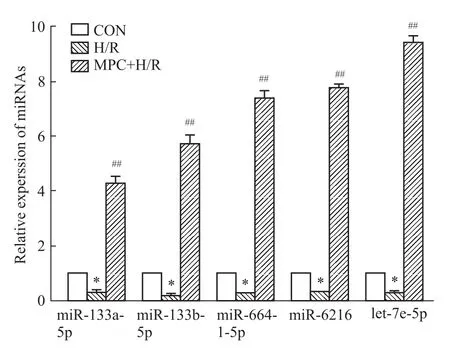
Fig 5 Expression of miRNAs in each group(±s,n=4)
3 讨论
吗啡是临床麻醉中常用的一种非选择性的阿片类镇痛药,常用于心血管手术麻醉和术后镇痛,以激动μ受体为主,同时也激动δ和κ阿片受体[9]。本实验根据参考文献[7]并加以改良,建立H9c2心肌细胞缺氧/复氧损伤模型,并参照前期及预实验结果,选择浓度为1 μmol·L-1的吗啡进行预处理。结果显示,MPC明显增强心肌细胞活力,降低H/R损伤导致的LDH活性升高,并抑制心肌细胞凋亡,说明MPC可以减轻心肌细胞H/R损伤,发挥心肌保护作用。Fas是一种分子质量为48 ku的跨膜糖
蛋白,它与FasL结合后介导的凋亡通路是经典的凋亡途径之一。Fas受体活化后可激活下游的caspase凋亡级联信号,导致心肌细胞凋亡,在心肌缺血/再灌注损伤中发挥关键作用[10]。本研究发现,MPC可降低H/R诱导的心肌细胞内Fas蛋白表达,提示了MPC可能通过抑制Fas介导的凋亡信号发挥心肌保护作用。
miRNA是生物体内长度约22个核苷酸的非编码小RNA,广泛表达于各个组织和器官。它们以不完全互补的方式与成熟mRNA结合,抑制mRNA的翻译或使mRNA降解,在转录后水平调节蛋白质的表达,参与调控细胞多个生物学过程。在miRNA与心肌损伤、凋亡的研究中,Yin等[11]发现,心肌缺血预处理时miR-21、miR-221、miR-224表达上调,于动物的心肌缺血区注射这些miRNA能减少心肌缺血/再灌注损伤。表明miRNA在心肌损伤、心肌细胞凋亡过程中起到了重要的调控作用,可能成为抗心肌缺血/再灌注损伤治疗的重要靶点。已有研究报道,吗啡可下调脑组织miR-133b表达,调节多巴胺神经元的功能[12];此外,let-7家族可与μ受体结合,转录后抑制阿片受体活性[13]。说明阿片类发挥生物学作用可能通过调控miRNA表达来实现。然而,阿片预处理发挥心肌保护作用是否涉及miRNA调控机制,目前尚未见报道。本实验通过荧光定量RT-PCR,检测各组miRNA表达水平的变化,结果显示,在H/R损伤组中明显下调的miR-133a-5p、miR-133b-5p、miR-664-1-5p、miR-6216、let-7e-5p均被MPC明显上调,提示MPC可能通过调控这些miR-NA表达,减轻H9c2心肌细胞H/R损伤,发挥心肌细胞保护作用。
这些受MPC调控的miRNA中,miR-133a与miR-133b同属miR-133家族。研究表明,在心肌梗死或心脏缺血/再灌注过程中,miR-133a、miR-133b表达均明显下降[14-15]。miR-133a已被证明具有抗心肌细胞凋亡作用,上调心肌内miR-133a表达可明显减轻缺血/再灌注损伤,改善心脏功能[16],可能与其负性调控促凋亡基因caspase-9有关[17]。miR-133b参与调控心肌细胞凋亡,但其具体作用机制尚不明确。我们通过靶基因预测软件对miR-133b-5p的靶基因进行分析,发现Fas基因的3’-UTR端与miR-133b-5p的种子序列匹配,可能是其关键靶基因之一。因此,我们推测MPC上调心肌细胞miR-133a和miR-133b的表达,可能与抑制凋亡信号通路Fas、caspase-9相关,进而抑制心肌细胞凋亡,减轻H/R损伤。其他miRNA如miR-664-1-5p、miR- 6216、let-7e-5p在心肌缺血/再灌注损伤或心肌细胞凋亡中的作用尚不清楚,在MPC介导的心肌保护效应中作用机制也有待进一步探讨。
综上所述,本研究证明吗啡预处理可明显减轻H9c2心肌细胞缺氧/复氧损伤,其机制可能与影响miR-133a-5p、miR-133b-5p、miR-664-1-5p、miR-6216 和let-7e-5p等miRNA表达有关,为进一步研究吗啡预处理的miRNA调控机制提供了基础。
(致谢:感谢安徽医科大学第二附属医院中心实验室为本课题研究提供仪器设备和技术支持。)
参考文献:
[1] Murry C E,Jennings R B,Reimer K A.Preconditioning with is-chemia:a delay of lethal cell injury in ischemic myocardium[J].Circulation,1986,74(5):1124-36.
[2] Liu C,Dai R,Yu R,et al.Morphine preconditioning,cardiopro-tection and left ventricular remodelling in rabbits[J].Acta Cardi-ol,2011,66(3):341-8.
[3] 胡 军,张 野,陆 姚,等.NO/cGMP信号通路在鞘内吗啡预处理减轻大鼠心肌缺血/再灌注损伤中的作用[J].中国药理学通报,2014,30(6):829-33.
[3] Hu J,Zhang Y,Lu Y,et al.Role of NO/cGMP in the cardiopro-tective effects of intrathecal morphine preconditioning against is-chemia-reperfusion injury in rats[J].Chin Pharmacol Bull,2014,30(6):829-33.
[4] 吴 昊,何淑芳,朱海娟,等.阿片受体,PI3K/Akt和ERK信号通路在瑞芬太尼预处理减轻大鼠心肌细胞缺氧/复氧损伤中的作用[J].中华麻醉学杂志,2013,33(9):1117-20.
[4] Wu H,He S F,Zhu H J,et al.Role of opioid receptors and PI3K/Akt and ERK signaling pathways in reduction of hypoxia/reoxygenation-induced injury to cardiomyocytes by remifentanil preconditioning in rats[J].Chin J Anesthesiol,2013,33(9):1117-20.
[5] Kukreja R C,Yin C,Salloum F N.MicroRNAs:new players in cardiac injury and protection[J].Mol Pharmacol,2011,80(4):558-64.
[6] Hwang C K,Wagley Y,Law P Y,et al.MicroRNAs in opioid pharmacology[J].J Neuroimmune Pharmacol,2011,7(4):808 -19.
[7] Sun L,Zhao M,Yu X J,et al.Cardioprotection by acetylcholine:a novel mechanism via mitochondrial biogenesis and function invol-ving the PGC-1α pathway[J].J Cell Physiol,2013,228(6):1238-48.
[8] 李 覃,王 伟,张 实,等.白藜芦醇调节STAT3与miR-21表达抗肝癌作用的初步研究[J].中国药理学通报,2014,30 (2):186-91.
[8] Li T,Wang W,Zhang S,et al.Effect of resveratrol on hepatocel-lular carcinoma by regulating STAT3 and miR-21[J].Chin Phar-macol Bull,2014,30(2):186-91.
[9] Ela C,Barg J,Vogel Z,et al.Distinct components of morphine effects on cardiac myocytes are mediated by the kappa and delta
opioid receptors[J].Mol Cell Cardiol,1997,29(2):711-20.
[10]Lee P,Sata M,Lefer D J,et al.Fas pathway is a critical mediator of cardiac myocyte death and MI during ischemia-reperfusion in vi-vo[J].Am J Physiol Heart Circ Physiol,2003,284(2):H456-63.
[11]Yin C,Salloum F N,Kukreja R C.A novel role of microRNA in late preconditioning:upregulation if endothelial nitric oxide syn-thase and heat shock protein 70[J].Circ Res,2009,104(5):572-5.
[12]Sanchez-Simon F M,Zhang X X,Loh H H,et al.Morphine regu-lates dopaminergic neuron differentiation via miR-133b[J].Mol Pharmacol,2010,78(5):935-42.
[13]He Y,Wang Z J.Let-7 microRNAs and opioid tolerance[J].Front Genet,2012,21(3):110-6.
[14]He B,Xiao J,Ren A J,et al.Role of miR-1 and miR-133a in myocardial ischemic postconditioning[J].J Biomed Sci,2011,18(1):22.
[15]Bostjancic E,Zidar N,Stajer D,et al.MicroRNAs miR-1,miR-133a,miR-133b and miR-208 are dysregulated in human myocar-dial infarction[J].Cardiology,2010,115(3):163-9.
[16]田轶魁,付 强,董福强,等.上调miRNA-133a表达对心肌缺血/再灌注损伤的保护作用[J].中华实验外科杂志,2012,29(2):270-2.
[16]Tian Y K,Fu Q,Dong F Q,et al.Protective effects of miR-133a against myocardial ischemia-reperfusion injury[J].Chin J Exp Surg,2012,29(2):270-2.
[17]Xu C,Lu Y,Pan Z,et al.The muscle-specific microRNAs miR-133 produce opposing effects on apoptosis by targeting HSP60,HSP70 and caspase-9 in cardiomyocytes[J].J Cell Sci,2007,120(17):3045-52.
Effects of morphine preconditioning on expression of microRNAs during hypoxia-reoxygenation in H9c2 myocardial cells
HAN Zheng-yi,HE Shu-fang,CHENG Jie,XU Shi-jin,YANG Wan,ZHAGN Ye
(Dept of Anesthesiology,the Second Affiliated Hospital of Anhui Medical University,Hefei 230601,China)
Abstract:Aim To evaluate the effects of morphine preconditioning(MPC)on the expression of microR-NAs(miRNAs)induced by hypoxia-reoxygenation (H/R)in H9c2 myocardial cells.Methods H9c2 cells were randomly divided into 3 groups(n=4 each)as follows:control group(CON),hypoxia/reoxygen-ation group(H/R)and morphine preconditioning group(MPC+H/R).The cells were cultured in nor-mal condition in CON group.The cells were subjected to 5 h hypoxia followed by 1 h reoxygenation in H/R group and MPC+H/R group.Specifically,the cells in MPC+H/R group were preconditioned with morphine with the final concentration of 1 μmol·L-1for 10 min before H/R.After the treatment,CCK-8 was used to detect cell viability and chemical colorimetry was used to detect lactate dehydrogenase(LDH)activity in the culture medium.Cell apoptosis was assessed by An-nexin-V-FITC/PI flow cytometry.Relative expression of Fas protein was detected by Western blot.The ex-pression of miRNA in myocardial cells was analyzed by quantitative reverse transcription polymerase chain re- action(qRT-PCR).Results Compared with CON group,the cell viability was significantly decreased,while the LDH activity,apoptotic rate and Fas protein expression were dramatically increased in group H/R (P<0.01).However,MPC significantly increased the cell viability,whereas it decreased the LDH activity,apoptotic rate and Fas protein expression induced by H/R injury(P<0.01).The expressions of miR-133a-5p,miR-133b-5p,miR-664-1-5p,miR-6216 and let-7e-5p were markedly down-regulated by H/R as compared to CON group(P<0.05),while MPC inhibited these miRNAs which were significantly down-regulated by H/R group(P<0.01).Conclusion Morphine preconditioning might protect H9c2 myocar-dial cells against H/R injury by regulating the expres-sion of miRNAs such as miR-133a-5p,miR-133b-5p,miR-664-1-5p,miR-6216 and let-7e-5p.
Key words:morphine preconditioning;H9c2 myocar-dial cells;hypoxia-reoxygenation;apoptosis;Fas;mi-croRNAs
作者简介:韩正怡(1991-),女,硕士,研究方向:麻醉药理学,E-mail:15155971268@163.com;张 野(1968-),男,博士,教授,主任医师,博士生导师,研究方向:麻醉药理学,通讯作者,Tel:0551-63869480,E-mail:zhangye_hassan@sina.com
基金项目:国家自然科学基金资助项目(No 81200171);安徽省科技厅年度重点项目(No 1301043030);安徽省高校省级自然科学研究重大项目(No KJ2014ZD16)
收稿日期:2015-06-13,修回日期:2015-07-18
文献标志码:A
文章编号:1001-1978(2015)11-1552-06
doi:10.3969/j.issn.1001-1978.2015.11.015