下调组蛋白赖氨酸特异性脱甲基酶1的表达引起人白血病Molt-4细胞的凋亡
许可珍,黄轶群,黄秀旺,马旭东
(福建医科大学附属漳州市医院1.药学部、2.血液内科,福建漳州 363000;3.福建医科大学药学院,福建福州 350004)
下调组蛋白赖氨酸特异性脱甲基酶1的表达引起人白血病Molt-4细胞的凋亡
许可珍1,黄轶群2,黄秀旺3,马旭东2
(福建医科大学附属漳州市医院1.药学部、2.血液内科,福建漳州 363000;3.福建医科大学药学院,福建福州 350004)
中国图书分类号:R341.27;R341.7;R329.25;R733.7;R977.4;R977.6
摘要:目的 观察LSD1基因对人类急性T淋巴母细胞性白血病Molt-4细胞增殖和凋亡的影响。方法 设计并筛选出针对LSD1基因的最佳siRNA片段,将其转染入Molt-4细胞后,MTS法观察LSD1 siRNA对Molt-4细胞增殖的影响;流式细胞术分析细胞凋亡;Western blot检测LSD1 siRNA作用后组蛋白H3K4、H3K9甲基化及组蛋白H3乙酰化状态,以及p15、DNA甲基化酶1(DNMT1)和凋亡相关蛋白Bcl-2、pro-caspase-3的表达变化。结果 沉默LSD1基因可抑制细胞增殖,LSD1 siRNA浓度为0、30、60、120 nmol·L-1作用48 h后,Molt-4细胞的增殖率分别为(99.65±1.21)%、(83.02± 1.69)%、(65.72±2.16)%、(41.15±2.23)%,差异具有统计学意义(P<0.05);LSD1 siRNA以60 nmol·L-1的浓度转染细胞0、24、48、72 h,增殖率分别为(99.86± 1.35)%、(65.72±2.16)%、(48.26±1.92)%、(37.86± 1.66)%,P<0.05,提示LSD1 siRNA可以抑制Molt-4细胞的增殖。LSD1 siRNA 0、30、60、120 nmol·L-1作用48 h后,细胞凋亡率分别为(3.35±1.26)%、(12.16±1.74)%、(32.74±2.47)%、(54.64±2.58)%,P<0.05,凋亡率随着LSD1 siRNA浓度的增加逐渐上升;同时出现凋亡相关蛋白Bcl-2、procaspase-3的表达下降;LSD1 siRNA抑制LSD1蛋白及LSD1 mRNA,上调组蛋白H3K4一甲基化、二甲基化及组蛋白H3的乙酰化水平,H3K4三甲基化、H3K9甲基化水平无明显变化;LSD1 siRNA下调DNA去甲基化酶DNMT1的表达,上调p15的表达。结论 LSD1 siRNA能抑制Molt-4细胞的增殖并诱导其凋亡,其机制可能与表观遗传学调控有关,有望成为白血病治疗的一个新的靶点。
关键词:急性白血病;LSD1;组蛋白;甲基化;乙酰化;表观遗传学
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.048.html
赖氨酸特异性组蛋白去甲基化酶1(lysine spe-cific demethylase 1,LSD1)是2004年被人们发现的第1个组蛋白赖氨酸去甲基化酶。LSD1定位于细胞核内,调控着基因转录的激活和抑制,在肿瘤发生和胚胎发育过程中起着重要的作用。它是一个黄素腺嘌呤二核苷酸(flavin adenine dinulcleotide,FAD)依赖性胺氧化酶,能够特异性地脱去组蛋白H3第4位赖氨酸(H3K4)和H3K9位点上的单甲基化和二甲基化甲基基团[1]。有研究发现,LSD1可通过多种途径参与肿瘤的发生,例如LSD1可能广
泛地调控基因表达并且参与前列腺癌的进展及恶化[2],与乳腺癌、卵巢癌、肝癌的发展也密切相关[3-5]。
目前H3K4去基化酶LSD1的研究不多,特别是用对RNAi沉默技术研究LSD1后肿瘤细胞的增殖及凋亡以及对组蛋白调控及DNA甲基化影响的报告少见。本研究通过RNAi沉默LSD1基因,探讨LSD1基因对急性T淋巴母细胞性白血病Molt-4细胞增殖、凋亡及组蛋白甲基化、乙酰化及DNA甲基化的影响,探讨LSD1基因在白血病靶向治疗中的可能性。
1 材料与方法
1.1试剂 RPMI 1640培养基(美国Gibco公司),胎牛血清(杭州四季青生物制品公司),siRNA及PCR引物委托上海吉玛制药技术有限公司合成,Li-pofectamineTM2000转染试剂、Opti-MEM RT-PCR试剂盒、DNA Marker试剂购自美国Invitrogen公司,细胞增殖检测(MTS)试剂盒(Promega公司),Annex-in V-FITC/PI双染试剂盒(BD公司),一抗:p15、Bcl-2、procaspase-3(美国Santa Cruz公司),Anti-ac-etyl-Histone H3、Anti-acetyl-Histone H4、Anti-trimeth-yl-Histone H3(Lys9)、Anti-acetyl-Histone H3 (Lys9)、Anti-acetyl-Histone H3(Lys14)、Anti-acetyl-Histone H3(Lys27)购自美国Upsate公司。羊抗兔、羊抗鼠二抗(Santa Cruz公司)。
1.2Molt-4细胞培养 Molt-4细胞购自中国科学院上海细胞库。Molt-4细胞培养条件:含10%胎牛血清的RPMI 1640细胞培养基(含青霉素105U· L-1+链霉素100 mg·L-1)并在37℃、5%CO2饱和湿度的孵育箱中培养。将Molt-4细胞复苏后,2~3 d规律传代。转染前选择对数生长期细胞,离心收集并接种于6孔培养板中,细胞数为2×106个/孔。
1.3靶序列的选择 siRNA的有关序列由上海吉玛制药技术有限公司设计及合成,为了避免只选择一个序列可能出现无效或低效的情况,我们根据确定序列的原则选择4条靶序列,并用RT-PCR法筛选最佳LSD1基因的siRNA片段为:上游5′-CCAC-GAGUCAAACCUUUAUTT-3′;下游5′-AUAAAGGU UUGACUCGUGGTT-3′。
1.4RT-PCR法观察LSD1 siRNA对Molt-4细胞LSD1 mRNA表达的影响 设定阴性对照组、0、30、60、120 nmol·L-1LSD1 siRNA处理组。每孔总体积为2 mL。37℃、5%CO2饱和湿度下培养48 h后,根据TRIzol试剂盒说明书提取总RNA,紫外分光光度法鉴定、定量,A260/A280比值均为1.8~2.0,经逆转录为cDNA。以反应所得cDNA进行PCR扩增。将β-actin(上游引物:5′-GAGACCTTCA AGAC-CCCAGCC-3′,下游引物:5′-TCGGGGCATCGGAAC-CGCTCA-3′)与LSD1引物按1∶2的比例混合。PCR反应条件:95℃5 min(预变性),95℃45 s(变性),61℃45 s(退火),72℃45 s(延伸),40个循环,最终延伸72℃10 min。将PCR产物与上样缓冲液以5∶1混合后,16 g·L-1琼脂糖凝胶电泳,于凝胶图像分析仪上自动分析成像,观察效果最佳LSD1 siRNA片段对Molt-4细胞LSD1 mRNA表达的影响。
1.5MTS法绘制细胞的生长曲线 取3个96孔板,每个96孔板中接种Molt-4细胞2×104个/孔,分别加入适量的LSD1 siRNA使终浓度分别为0、30、60、120 nmol·L-1,终体积为100 μL。每组设6个平行孔,转染后置于5%CO2饱和湿度、37℃的孵箱中继续培养。于24、48、72 h分别收获一个板内的4组细胞。将MTS和PMS按20∶1的体积比混合成混合液,每孔加20 μL的上述混合液,继续培养4 h,震荡10 min,充分溶解结晶物,在酶标仪上测吸光度即OD值(单波长492 nm),记录试验结果,并计算细胞增殖率。细胞增殖率/%=(OD实验-OD空白)/(OD对照-OD空白)×100%。以细胞增殖率为纵轴、时间为横轴绘制细胞增殖曲线。实验重复3次。
1.6流式细胞仪检测细胞早期凋亡 LSD1 siRNA使终浓度分别为0、30、60、120 nmol·L-1,分别培养48 h后离心收集细胞,在流式细胞仪检测细胞凋亡率,方法及步骤参照BD公司试剂盒说明书进行。实验重复3次。
1.7Western blot检测干扰后LSD1蛋白、凋亡相关蛋白、p15蛋白、组蛋白H3K4一、二甲基化、H3K9甲基化、H3乙酰化状态及DNA甲基化酶DNMT1的表达 用不同浓度的LSD1 siRNA处理Molt-4细胞48 h后,收集细胞,用PBS洗涤后,调整细胞数为1×106的浓度,加入裂解液与酶抑制剂(100∶1)100 μL充分裂解细胞;低温(4℃)12 000 r ·min-1离心15 min,吸取中间清亮层,收集蛋白,BCA法进行蛋白定量,-20℃保存备用。取备用蛋白,以12%SDS-PAGE电泳分离,电转移法转膜,室温下摇床封闭1 h;加入用TBS稀释的一抗4℃过夜,TBS洗涤液洗膜后分别加入二抗,室温下孵育1 h,TBS洗膜后加入化学发光工作液,在X射线胶片(KODAK)上曝光,以β-actin为内参,用AlphaDigi-Doc图像分析软件进行分析比较。
1.8统计学分析 采用SPSS 13.5统计学软件进
行结果处理,常规进行方差齐性检验、正态性检验。计量资料实验数据采用±s表示,并进行单因素方差分析。
2 结果
2.1LSD1 siRNA下调LSD1 mRNA及其蛋白的表达 分别将浓度为0、30、60、120 nmol·L-1的LSD1-2045 RNAi片段转染Molt-4细胞,48 h后提取细胞的mRNA进行RT-PCR试验。如Fig 1A所示,LSD1 siRNA转染后LSD1 mRNA受到抑制,且与浓度相关。各组LSD1 mRNA条带灰度值与β-actin比值分别为:0.967±0.124、0.302±0.083、0.153± 0.082、0.091±0.024,各组与β-actin比值统计学处理,P<0.05(Fig 1A)。与对照组相比,经LSD1 RNA干扰后,LSD1蛋白的表达量随着siRNA作用浓度的增加而逐渐减少,其中120 nmol·L-1组减少最明显,下降了67.67%(Fig 1B)。
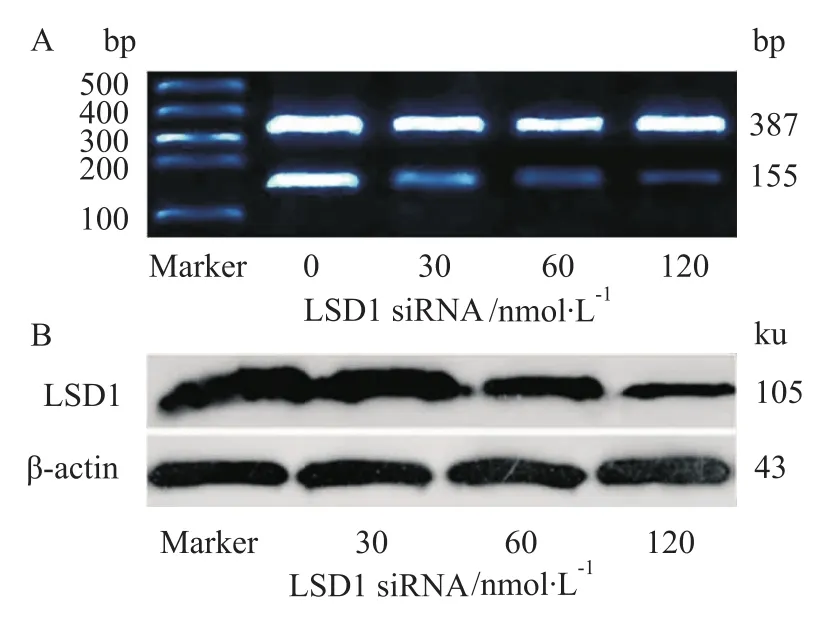
Fig 1 Transfection of LSD1 siRNA in Molt-4 cells
2.2LSD1 siRNA抑制Molt-4细胞增殖 经终浓度分别为0、30、60、120 nmol·L-1的LSD1 siRNA作用24、48、72 h后,Molt-4细胞的增殖率变化见Fig 2,随LSD1 siRNA浓度的增加和时间的延长,增殖率逐渐下降,呈现浓度和时间依赖性。
2.3LSD1 siRNA诱导Molt-4细胞凋亡 经30、60、120 nmol·L-1的LSD1 siRNA处理48 h后,Molt-4细胞的凋亡率分别为(12.16±1.74)%、(32.74±2.47)%、(54.64±2.58)%,而对照组为(3.35±1.26)%,细胞的凋亡率随着LSD1 siRNA浓度的增加逐渐上升(P<0.05)。LSD1 siRNA浓度与凋亡率有明显的量效关系(Fig 3)。
2.4LSD1 siRNA对Molt-4细胞的凋亡相关蛋白、DNMT1及p15的影响 经终浓度分别为0、30、60、120 nmol·L-1的LSD1的siRNA转染Molt-4细胞48 h后,抗凋亡蛋白Bcl-2的表达随着LSD1 siRNA终浓度的增加而逐渐减少,分别比对照组减少33.70%、55.62%、79.78%;procaspase-3随着siRNA处理浓度的增加表达量也逐渐下降,分别比对照组减少33.69%、54.35%、77.17%;同时,随着siRNA处理浓度的增加,抑癌基因p15的表达量逐渐增加,分别比对照组增加1.21倍、2.71倍、4.58倍;而DNMT1蛋白的表达则逐渐减弱,分别比对照组减少22.47%、71.35%、88.76%(P<0.05)(Fig 4)。

Fig 2 Deceased cell proliferation of Molt-4 cells after transfected with LSD1 siRNA in different concentrations and in different time

Fig 3 Induction of cells apoptosis after transfected with LSD1 siRNA Molt-4 cells for 48 hours
2.5LSD1 RNAi对Molt-4细胞组蛋白甲基化和乙酰化的影响 LSD1 siRNA终浓度为30、60、120 nmol·L-1处理Molt-4细胞48 h后,组蛋白H3K4
一甲基化和二甲基化表达随siRNA浓度增加而增强;组蛋白H3K4三甲基化水平不变;组蛋白H3K9一甲基化和二甲基化水平也几乎不变;组蛋白H3乙酰化水平随siRNA浓度增加而表达增强(Fig 5)。

Fig 4 Alteration of apoptosis-related protein and DNMT1,p15 protein in Molt-4 cells after transfected with indicated concentrations of LSD1 siRNA for 24 h
3 讨论
一般认为,肿瘤的发生与癌基因的异常激活或过度表达有关,而抑癌基因的失活也可能使细胞向恶性转化。表观遗传学的改变对肿瘤的发生和发展起了重要的作用。组蛋白H3K4去基化酶LSD1在表观遗传学中发挥了重要作用,其在多种肿瘤表达异常,说明它对肿瘤的发生有关。本研究以RNA干扰技术削减急性淋巴细胞白血病Molt-4细胞的LSD1表达,观察白血病细胞的表观遗传学的变化及增殖、凋亡的影响,探讨LSD1作为抗肿瘤靶点的可能性。
特异性地诱导肿瘤细胞凋亡已经成为治疗恶性肿瘤的主要策略之一。2010年Kontaki等[6]首先报告当DNA损伤时,set和LSD1分别对E2F1-K185me进行去甲基化修饰,使其更远的乙酰化和磷酸化,它主要作用于细胞周期的G1期到S期的过渡,并通过激活p53、p73等辅助因子,即p53依赖和非p53依赖细胞凋亡通路,激活大量凋亡前基因。本研究结果显示,LSD1 siRNA干扰LSD1基因后可促进Molt-4细胞凋亡相关蛋白Bcl-2、procaspase-3裂解,触发细胞凋亡,细胞凋亡率随着LSD1 siRNA浓度的增加逐渐上升(P<0.05);Wang等[7]鉴定出DN-MT1是LSD1的新底物。DNMT1可被LSD1去甲基化,引起DNA甲基化的失衡。p15(Ink4b)基因属于抑癌基因中周期蛋白依赖性激酶抑制因子(CK-Is)第二大家族,通过抑制CDK4/6,从而抑制Rb蛋白磷酸化,阻止细胞由G1期进入S期,从而减少细胞的异常生长及变异,阻止肿瘤发生和发展。沉默LSD1基因可下调DNA甲基转移酶1(DNMT1),使抑癌基因p15去甲基化而表达上调,从而抑制肿瘤细胞增殖。

Fig 5 Alteration of histone methylation and acetylation modification of Molt-4 cells after transfection with indicated concentrations of LSD1 siRNA for 24 h
本研究还发现沉默LSD1后,H3K4的一甲基化和二甲基化水平逐渐增强,组蛋白H3乙酰化水平上调,而H3K4的三甲基化及H3K9的一甲基化和二甲基化未发生改变。Shi等[1]和Nicholson等[8]的实验显示在FAD的参与下,LSD1在体外可以特异去除组蛋白H3第4位赖氨酸(H3K4)的二甲基和一甲基修饰。而三甲基则需要亚胺阳离子中间体才能介导对H3K4三甲基的去甲基化反应。LSD1不
是H3K9去甲基化酶,但有文献报告LSD1可在体内才能去除H3K9的二甲基和一甲基修饰[9]。Miao等[10]研究发现:组蛋白H3-K4Me2、H3-K4Me3、H3-K36Me2和H3-K79Me2与高度乙酰化和基因激活都有关系。因此,可以推导出:当组蛋白H3-K4Me2表达增加时,可引起组蛋白高度乙酰化,从而使组蛋白H3乙酰化增加。
本研究提示干扰LSD1基因后肿瘤细胞发生表观遗传学改变,进而促使细胞凋亡,肿瘤细胞受到抑制,有望成为肿瘤治疗的靶点。
(致谢:本文实验在闽南师范大学生物科学院中心实验室完成,感谢实验室的老师对本实验的支持。)
参考文献:
[1] Shi Y,Lan F,Matson C,et al.Histone demethylation mediated by the nuclear amine oxidase homolog LSD1[J].Cell,2004,119 (7):941-53.
[2] Naqasawa S,Sedukhina A S,Nakaqawa Y,et al.Relationship be-tween LSD1 expression and E-cadherin expression in prostate canc-er[J].J Int Urol Nephrol,2015,47(3):485-90.
[3] Naqasawa S,Sedukdina A S,Nakaqawa I,et al.LSD1 overex-pression is associated with poor prognosis in basal-like breast canc-er,and sensitivity to PARP inhibition[J].PLos One,2015,10 (2):e0118002.
[4] Chen C,Ge J,Lu Q,et al.Expression of Lysine-specific demeth-ylase 1 in human epithelial ovarian cancer[J].J Ovarian Res,2015,8(1):28.
[5] Lei Z J,Wang J,Xiao H L,et al.Lysine-specific dem ethylase 1 promotes the stemness and chemoresistance of Lgr5+liver cancer initiating cells by suppressing negative regulators of β-catenin sig-naling[J].J Oncogene,2015,34:3188-98.
[6] Kontaki H,Talianidis I.Lysine methylation regulates E2F1-in-duced cell death[J].J Molell,2010,39(1):152-60.
[7] Wang J,Hevi S,Kurash J K,et al.The lysine demethylase LSD1 (KDM1)is required for maintenance of global DNA methylation [J].J Nat Genet,2009,41(1):125-9.
[8] Nicholson T B,Chen T.LSD1 demethylates histone and non-his-tone proteins[J].J Epigenetics,2009,4(3):129-32.
[9] Lan F,Nottke A C,Shi Y.Mechanisms involved in the regulation of histone lysine demethylases[J].J Curr Opin Cell Biol,2008,20 (3):316-25.
[10]Miao F,Natarajan R.Mapping global histone methylation patterns in the coding regions of human genes[J].J Mol Cell Biol,2005,25(11):4650-61.
Effects of silencing LSD1 gene on Molt-4 cells apoptosis
XU Ke-zhen1,HUANG Yi-qun2,HUANG Xiu-wang3,MA Xu-dong2
(1.Dept of Pharmacy,2.Dept of Hematology,Zhangzhou Affiliated Hospital of Fujian Medical University,Zhangzhou Fujian 363000,China;3.School of Pharmacy,Fujian Medical University,Fuzhou 350004,China)
Abstract:Aim To observe the effect of the LSD1 gene on the proliferation and apoptosis of Molt-4 cells,a kind of human acute T-lymphoblastic leukemia cells.Methods siRNA fragment based on LSD1 gene was designed,filtered out and then transfected into Molt-4 cells.The effects of LSD 1 siRNA on Molt-4 cell prolif-eration were observed by the method of MTS.The cell apoptosis was analyzed by flow cytometry.The states of histone H3K4,H3K9 methylation,histone H3 acetyla-tion,p15,DNA methyltransferase 1(DNMT1),and apoptosis-related proteins like Bcl-2,procaspase-3 were evaluated by Western blot.Results Silencing LSD1 gene inhibited cell proliferation.Molt-4 cell pro-liferation rate was(99.65±1.21)%,(83.02± 1.69)%,(65.72±2.16)%,and(41.15±2.23)% respectively after the treatment of Molt-4 cells with 0,30,60,120 nmol·L-1of LSD1 siRNA after 48 hours (P<0.05).Cell proliferation rate was(99.86± 1.35)%,(65.72±2.16)%,(48.26±1.92)%,and (37.86±1.66)%respectively after the transfection of Molt-4 cells with 60 nmol·L-1of LSD1 siRNA after 0,24,48,72 hours(P<0.05).Cell apoptosis rate was(3.35±1.26)%,(12.16±1.74)%,(32.74 ±2.47)%,(54.64±2.58)%respectively after transfection of LSD1 siRNA in indicated concentrations for 48 hours(P<0.05).At the same time,the ex-pression levels of apoptosis-related proteins like Bcl-2,procaspase-3 decreased.LSD1 siRNA inhibited LSD1 and LSD1 mRNA,and accumulated histone mono-,and di-methylation H3K4 and histone H3 acetylation.However,alteration of H3K4 trimethylation,H3K9 methylation was not detected.LSD1 siRNA downregu-lated DNA demethylase DNMT1 and upregulated p15.Conclusions LSD1 siRNA can inhibit Molt-4 cell proliferation and induce apoptosis.Its mechanism may be associated with epigenetic regulation.In addition,it is expected to become a new target for leukemia treat-ment.
Key words:acute leukemia;LSD1;histone;methyla-tion;acetylation;epigenetics
作者简介:许可珍(1979-),女,硕士,主管药师,研究方向:临床药学,Tel:0596-2082381,E-mail:xkz868@163.com;马旭东(1957-),女,硕士,主任医师,教授,博士生导师,研究方向:血液肿瘤学,通讯作者,Tel:0596-2082021,Fax:0596-2593904,E-mail:maxudong005@hotmail.com
基金项目:福建省自然科学基金资助项目(No 2012J01420);漳州市科学研究发展计划基金资助项目(No 20100080);福建省引进重大项目计划基金(No 2012I2004);福建医科大学重点科研项目(No FZS13004Z);福建省医学创新课题(No 2012-CX-32)
收稿日期:2015-06-13,修回日期:2015-07-15
文献标志码:A
文章编号:1001-1978(2015)11-1603-05
doi:10.3969/j.issn.1001-1978.2015.11.024

