积雪草酸通过改变自噬作用促进胶质瘤细胞T98G凋亡的实验研究
李 欢,管福琴,陈 雨,印 敏,孙 浩,王 鸣,冯 煦,单 宇
(江苏省中国科学院植物研究所,南京中山植物园,江苏省农业种质资源保护与利用平台,江苏南京 210014)
积雪草酸通过改变自噬作用促进胶质瘤细胞T98G凋亡的实验研究
李 欢,管福琴,陈 雨,印 敏,孙 浩,王 鸣,冯 煦,单 宇
(江苏省中国科学院植物研究所,南京中山植物园,江苏省农业种质资源保护与利用平台,江苏南京 210014)
中国图书分类号:R284.1;R329.24;R329.25;R730.264;R916.4
摘要:目的 研究积雪草酸对T98G细胞凋亡及自噬的影响。方法 MTT法分析积雪草酸对T98G细胞增殖的影响;Hoechst 33258染色观察细胞形态;流式细胞术检测细胞凋亡和细胞自噬;Western blot检测凋亡和自噬通路相关因子的表达。结果 积雪草酸对T98G细胞增殖有抑制作用,IC50值为46.3 μmol·L-1。Annexin-V/7-AAD双染和West-ern blot结果显示,积雪草酸可引起Akt表达下调、线粒体膜电位下降和Caspase-3激活,进而诱导T98G细胞凋亡。同时,AA可抑制T98G细胞自噬,表现为降低MDC荧光强度,抑制Beclin-1、LC3-Ⅱ、Atg表达。通过氯喹上调Beclin-1和LC3-Ⅱ的表达,积雪草酸抑制自噬作用被阻断,同时促凋亡作用也明显降低。结论 积雪草酸可同时诱导T98G细胞凋亡和抑制自噬,并且抑制自噬作用能够促进细胞凋亡,进而抑制T98G细胞增殖。
关键词:积雪草酸;T98G细胞;凋亡;自噬;机制;相互作用
网络出版时间:2015-9-14 14:53 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150914.1453.016.html
积雪草酸(asiatic acid,AA)又名亚细亚酸,属于五环三萜类化合物中的乌苏烷型。1971年积雪草酸被发现具有治疗皮肤创伤的作用,随后研究表明,AA具有广泛的药理活性,如治疗慢性溃疡、护肝、抗抑郁、防治心脑血管疾病、抗阿尔茨海默病等[1],还具有较强的抗肿瘤作用。目前国内外研究发现,AA对结肠癌细胞、肺癌细胞、黑色素瘤细胞、人神经胶质瘤细胞、肝癌细胞、乳腺癌细胞、骨髓瘤细胞等具有明显的抑制作用[2-7]。本文拟AA作用于T98G胶质瘤细胞株,研究其抑制脑癌的作用,并探讨其作用机制。
1 材料
1.1细胞株和主要试剂 T98G细胞购自中国科学院上海细胞库;高糖型DMEM、胎牛血清(fetal bo-vine serum,FBS)、青霉素和链霉素为Gibco/Invitro-gen产品;积雪草酸(AA,分子式:C30H48O5,分子质量:488.7,白色结晶,溶于水、甲醇、DMSO)由本实验室从灰毡毛忍冬中分离得到;氯喹(chloroquine,CQ)、二甲基亚砜(dimethylsulfoxide,DMSO)、十二烷基硫酸钠(sodiumdodecyl sulfate,SDS)购自Sigma-Aldrich;RIPA裂解液(RIPA lysis buffer)和BeyoECL Plus化学发光试剂盒购自碧云天公司;所有免疫印迹抗体均购自Cell Signaling Technology公司。
1.2仪器 Thermo-6500 CO2培养箱、Thermo Nap-flow超净工作台(美国Thermo公司);Centrifuge 5804 R高速离心机(德国Eppendorf公司);IX5倒置显微镜(日本Olympus公司);Infinite M200型酶标仪(美国TECAN公司);Accuri C6流式细胞仪(美国BD公司);MS3 digital定时微量振荡器(德国IKA公司);LIBROR AEL-200电子天平(日本Shi-madzu公司)。
2 方法
2.1细胞培养 T98G细胞用含有10%FBS、10% F10、100 kU·L-1青霉素和100 mg·L-1链霉素的DMEM培养基培养,置于37℃、5%CO2湿度饱和的培养箱中,每2~3天换液传代。取对数生长期的细胞用于实验。
2.2MTT测定细胞的增殖活性 将对数生长期的细胞用胰酶消化后按5 000个/孔接种于96孔板,每孔加100 μL,培养24 h;次日加入含不同浓度药物及相应溶剂对照的新鲜培养基,每孔加100 μL,设6个剂量组,阿霉素(ADM)1 μg·L-1为阳性对照,溶剂为空白对照。培养72 h后,每孔加10 μL新鲜配制的5 μg·L-1MTT液,继续培养4 h。去上清,每孔加100 μL DMSO,微型振荡器振荡混
匀。酶标仪570 nm测定光密度值(A),计算细胞存活率,并按中效方程计算IC50。实验重复3次。
细胞抑制率/%=(对照组平均A值-给药组平均A值)/对照组平均A值×100%。
2.3Hoechst 33258染色法检测细胞凋亡 取状态良好的T98G细胞,胰酶消化后接种于2 mL圆盘培养板中,贴壁后加药,根据MTT结果,设空白对照组和实验组(含有40 μmol·L-1AA),培养48 h后,弃培养液,冰冷PBS洗1遍,加入Hoechst 33258染液(终浓度5 mg·L-1),染色15 min,荧光显微镜下观察拍照。实验重复3次。
2.4Western blot检测凋亡相关蛋白质表达 AA处理T98G细胞48 h后,提取蛋白,12%SDS-PAGE分离,转移到PVDF膜上,质量体积比为5%的牛血清白蛋白(BSA)封闭,一抗(1∶1 000)封闭过夜,二抗(1∶1 000)室温孵育2 h,最后用BeyoECL Plus化学发光试剂盒显色,暗盒中胶片曝光,显影、定影后扫描图像。
2.5Annexin-V/7-AAD双标记染色检测凋亡 根据MTT结果,设低、中、高(20、40、80μmol·L-1)浓度实验组,检测不同浓度AA对T98G细胞凋亡率的影响。此外,设对照(0.1%DMSO)组、AA(60 μmol ·L-1)组、CQ(5μmol·L-1)组、AA(60 μmol· L-1)+CQ(5 μmol·L-1)组检测细胞自噬对T98G细胞凋亡的作用。给药48 h后,离心收集细胞,PBS洗涤,Annexin V Binding Buffer重悬细胞,加入An-nexin V-FITC和7-AAD(7-Amino-Actinomycin D),室温避光孵育15 min,流式细胞仪检测细胞凋亡。分布于散点图左下象限散点代表正常细胞,右下象限的散点代表早期凋亡细胞,右上象限的散点代表晚期凋亡细胞。实验重复3次。
2.6MDC荧光染色检测细胞自噬 丹酰戊二胺(MDC)能选择性地结合到自噬囊泡膜上而被用来检测自噬的发生。实验设对照(0.1%DMSO)组、AA(60 μmol·L-1)组、CQ(5 μmol·L-1)组、AA (60 μmol·L-1)+CQ(5 μmol·L-1)。收集细胞加入0.05 mmol·L-1MDC于37℃避光孵育20 min,弃培养液,PBS悬浮,流式细胞仪检测细胞自噬。实验重复3次。
2.7Western blot检测自噬相关蛋白水平 收集细胞用RIPA试剂裂解,细胞裂解上清液经SDS-PAGE电泳分离,转至PVDF膜上,5%BSA封闭后加入相应抗体孵育过夜,加入二抗室温孵育2 h,最后用BeyoECL Plus化学发光试剂盒显色,暗盒中胶片曝光,显影、定影后扫描图像。
3 结果
3.1AA对T98G细胞增殖的影响 如Fig 1所示,胶质瘤细胞T98G经不同浓度积雪草酸处理后,细胞生长明显受到抑制(P<0.01),且随着给药剂量的增加,细胞生长抑制率逐渐增大,说明AA对T98G细胞有明显的生长抑制作用,并且具有良好的剂量依赖关系。药物处理72 h,半数抑制浓度(IC50)为46.3 μmol·L-1。

Fig 1 Effect of asiatic acid(AA)on T98G cell proliferation(±s,n=3)
3.2AA对T98G细胞形态的影响 对照组细胞生长情况较好,贴壁较牢固,细胞间紧密相连,细胞核被Hoechst 33258均匀的染成蓝色。AA处理细胞48 h后,镜下清晰可见细胞变圆,脱落,Hoechst 33258染色呈亮蓝色。见Fig 2。

Fig 2 Morphological change of T98G cells after AA treatment(×400)
3.3细胞凋亡率检测结果 药物作用48 h后,流式细胞术检测发现,AA明显诱导T98G凋亡(P<0.05,P<0.01),且凋亡率(含早期凋亡和晚期凋亡)随着药物浓度增加而升高,分别达到9.3%、17.2%和48.7%。见Fig 3。

Fig 3 Effects of AA on apoptosis in T98G cells(±s,n=3)
3.4AA对T98G细胞内凋亡相关因子表达的影响 不同浓度AA处理T98G细胞48h后PARP、Cleaved Caspase-3、Cleaved Caspase-7以及Akt、P-Akt的表达明显上调,而Mcl-1、Bcl-xl的表达被下调,且均呈明显的剂量依赖效应。见Fig 4。

Fig 4 Expression of apoptosis-related factors in T98G cells treated with AA
3.5AA对T98G细胞自噬的影响 蛋白印迹法检测显示,不同浓度AA作用细胞48 h后,自噬相关基因(autophagy related gene,ATG)Atg16L1、Atg3的表达明显降低(Fig 5A)。以60 μmol·L-1AA处理细胞不同时间后,Beclin-1和LC3-Ⅰ/LC3-Ⅱ蛋白的表达量均明显降低,且呈时间依赖性(Fig 5B)。结果提示,AA可抑制T98G细胞自噬,该作用具有时间和浓度依赖性。流式细胞术结果表明,AA和氯喹(CQ)联合用药后可明显降低氯喹诱导的细胞自噬水平(Fig 6),这进一步验证AA具有抑制T98G细胞自噬作用。

Fig 5 Expression of autophagy-related factors in T98G cells treated with AA
3.6AA抑制细胞自噬作用对细胞凋亡的影响进一步研究AA和CQ联用后对细胞凋亡作用的影响,结果发现,AA单独作用时T98G细胞凋亡率为19.3%,AA与CQ联用后,凋亡率降至17.2%,这表明AA抑制细胞自噬作用阻断后AA诱导细胞凋亡作用也被部分抑制,AA抑制细胞自噬作用可以促进AA诱导细胞凋亡作用。见Fig 7。
4 讨论
已有研究表明,AA可抑制人类神经胶质瘤细胞U-87MG和LN18的增殖,主要作用机制为诱导细胞凋亡,但是否有自噬作用在AA诱导胶质瘤细胞死亡中的作用尚未见报道。细胞自噬是一种机体的保护性行为,与人类肿瘤的发生、发展密切相关。有学者认为,自噬作用可以为肿瘤细胞提供能量,有效缓解肿瘤细胞面临的营养邪僻,促进肿瘤细胞存活并扩增[8-9]。也有证据表明,化疗药物在诱导肿瘤细胞发生凋亡的同时,可导致细胞自噬活性增强,产生耐药性,而自噬抑制剂可以减弱这种耐药性[10]。这些研究为我们提供了研发抗肿瘤药物的新策略。
本研究初步表明,Akt是AA抑制T98G细胞增殖的重要靶点。Akt是原癌基因c-Akt的表达产物,
在细胞凋亡、细胞增殖、细胞分化、生理代谢、衰老及疾病和癌症等细胞生理病理活动的调控中起着至关重要的作用[11]。AA通过抑制Akt表达,进而激活线粒体凋亡通路,抑制Bcl-xl和Mcl-1表达,导致线粒体膜电位下降,Caspase-3、7和PARP活化,促使细胞凋亡。

Fig 6 Autophagy ratios of T98G cells in different groups(±s,n=3)
Beclin1是细胞自噬过程中最重要的正调节因子,通过与Vps34/PI3K形成复合物促进自噬[12],本研究证实Beclin1是启动自噬的关键蛋白。AA作用T98G细胞后,Beclin1的表达明显降低,使得Atg蛋白失活,从而阻碍自噬前体结构(PAS)的形成;同时LC3-II-PE泛素样蛋白系统的作用减弱,进而导致自噬体的形成受阻,抑制细胞自噬。
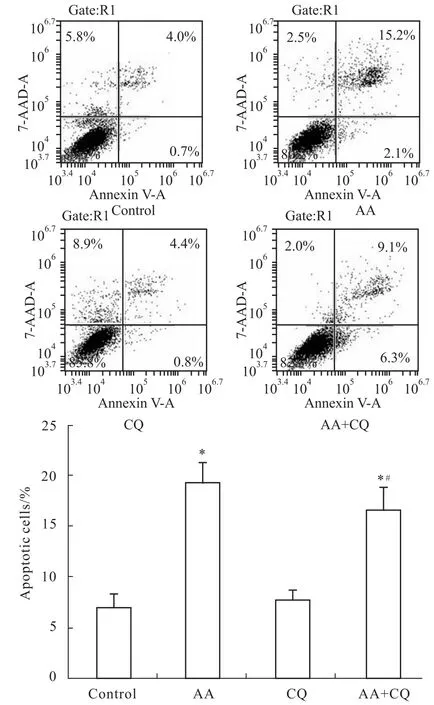
Fig 7 Apoptotic ratios of T98G cells in different groups(±s,n=3)
近年来大量的研究结果已开始揭示自噬与肿瘤发生发展的密切联系,自噬在肿瘤预防及治疗中的重要性已初露端倪[13]。普遍认为在不同的细胞中、不同的条件下,自噬和凋亡之间的关系也随之不同。李彩丽等[14]发现自噬在As2O3诱导的Burkitt淋巴瘤Raji细胞凋亡中具有重要作用,自噬促进凋亡。曾蓉等[15]则发现自噬对冬凌草甲素诱导的多发性骨髓瘤细胞凋亡具有拮抗作用,抑制自噬后,细胞凋亡率增加。在本实验中,AA诱发T98G细胞凋亡和抑制细胞自噬并存,为了更好解释AA抑制自噬作用在抑制肿瘤发生发展中的角色,我们采用AA与CQ联用法检测其对细胞凋亡的影响,结果表明阻断了AA抑制细胞自噬的作用后会明显降低其促进细胞凋亡的作用,初步表明自噬在AA诱导T98G细胞
凋亡的机制中可能发挥着重要作用。
(致谢:本文实验于江苏省中国科学院植物研究所天然产物化学研究中心完成。单宇、管福琴、陈雨、印敏、孙浩、王鸣、冯煦老师对本项工作提出宝贵的建议,并进行细致的指导。在此致谢!)
参考文献:
[1] 孟艳秋,王 楠,张良锋.积雪草酸生物活性的研究进展[J].化学通报,2013,76(8):721-4.
[1] Meng Y Q,Wang N,Zhang L F.Advances in studies on biological activity of asiatic acid[J].Chem Bull,2013,76(8):721-4.
[2] Wang L,Xu J,Zhao C H,et al.Antiproliferative,cell-cycle dys-regulation effects of novel asiatic acid derivatives on human non-small cell lung cancer cells[J].Chem Pharm Bull,2013,61 (10):1015-23.
[3] Chen J Y,Xu Q W,Xu H,Huang Z H.Asiatic acid promotes p21WAF1/CIP1 protein stability through attenuation of NDR1/2 dependent phosphorylation of p21WAF1/CIP1 in HepG2 human hepatoma cells[J].Asian Pac J Cancer Prev,2014,15(2):963 -7.
[4] Parka B C,Bosirea K O,Lee E S,et al.Asiatic acid induces ap-optosis in SK-MEL-2 human melanoma cells[J].Cancer Lett,2005,218:81-90.
[5] Cho C W,Choi D S,Cardone M H,et al.Glioblastoma cell death induced by asiatic acid[J].Cell Biol Toxicol,2006,22:393-408.
[6] Hsu Y L,Kuo P L,Lin L T,Lin C C.Asiatic acid,a triterpene,induces apoptosis and cell cycle arrest through activation of extra-cellular signal-regulated kinase and p38 mitogen-activated protein kinase pathways in human breast cancer cells[J].Cancer Lett,2005,313(1):333-44.
[7] 吕婷婷,刘 芳,陈 燕,姜旭东.积雪草酸对多发性骨髓瘤细胞增殖活性的影响及其机制探讨[J].中草药,2010,41 (9):1484-8.
[7] Lyu T T,Liu F,Chen Y,Jiang X D.Effect of asiatic acid on pro-liferation of multiple myeloma cells and its mechanism[J].Chin Tradit Herbal Drugs,2010,41(9):1484-8.
[8] Nagelkerke A,Sweep F C,Geurts-Moespota A,et al.Therapeutic targeting of autophagy in cancer.Part I:Molecular pathways con-trolling autophagy[J].Semin Cancer Biol,2015,31:89-98.
[9] Nagelkerke A,Bussink J,Geurts-Moespota A,et al.Therapeutic targeting of autophagy in cancer.Part II:Pharmacological modula-tion of treatment-induced autophagy[J].Semin Cancer Biol,2015,31:99-105.
[10]Sui X B,Zhu J,Zhou J C,et al.Epigenetic modifications as regu-latory elements of autophagy in cancer[J].Cancer Lett,2015,360:106-13.
[11]王 秀,张竞竞,张 配,等.雷公藤甲素诱导鼻咽癌细胞凋亡作用[J].中国药理学通报,2014,30(8):1147-50.
[11]Wang X,Zhang J J,Zhang P,et al.Effect of triptolide on apopto-sis of nasopharynx cancer[J].Chin Pharmacol Bull,2014,30 (8):1147-50.
[12]王 宠,张 萍,朱卫国.细胞自噬与肿瘤发生的关系[J].
中国生物化学与分子生物学报,2010,26(11):988-97.
[12]Wang C,Zhang P,Zhu W G.Relationship between autophagy and tumorigenesis[J].Chin J Biochem Mol Biol,2010,26(11):988 -97.
[13]Guo J Y,Xia B,White E.Autophagy-mediated tumor promotion [J].Cell,2013,155(6):1216-9.
[14]李彩丽,陈 静,王 蓓,等.自噬在As2O3诱导Burkitt淋巴瘤Raji细胞死亡中的作用及机制研究[J].中国药理学通报,2014,30(5):719-24.
[14]Li C L,Chen J,Wang B,et al.Effect of triptolide on apoptosis of nasopharynx cancer[J].Chin Pharmacol Bull,2014,30(5):719-24.
[15]曾 蓉,陈 燕,崔国惠.抑制自噬促进冬凌草甲素诱导的多发性骨髓瘤细胞凋亡涉及胞内ROS产生[J].中国组织化学与细胞化学杂志,2011,20(4):295-300.
[15]Zeng R,Chen Y,Cui G H.Inhibition of autophagy enhances ap-optosis involved with intracellular ROS generation in multiple mye-loma cells exposed to oridonin[J].Chin J Histochem Cytochem,2011,20(4):295-300.
Asiatic acid induces apoptosis in T98G human glioblastoma cells by changing autophagy
LI Huan,GUAN Fu-qin,CHEN Yu,YIN Min,SUN Hao,WANG Ming,FENG Xu,SHAN Yu
(Institute of Botany,Jiangsu Province and Chinese Academy of Sciences,Nanjing Botanical Garden Mem Sun Yat-sen,The Jiangsu Provincial Platform for Conservation and Utilization of Agricultural Germplasm,Nanjing 210014,China)
Abstract:Aim To investigate the effect of asiatic acid on apoptosis and autophagy in human glioblastoma T98G cells.Methods MTT colorimetry was employed to assay the cellular proliferating activity.The fluores-cence microscope and Hoechst 33258 staining were used to detect the morphological changes.The cell ap- optosis and autophagy were analyzed by flow cytometry with Annexin-V/7-AAD and MDC staining respective-ly.The expressions of associated proteins were detected by Western blot to analyze the mechanism of apoptosis and autophagy.Results MTT assay showed that the growth of T 9 8 G cells was inhibited by asiatic acid
(IC50=46.3 μmol·L-1).Annexin V/7-AAD stai-ning and Western blot revealed that asiatic acid in-duced apoptosis in T98G cells by reducing the expres-sion of Akt,decreasing the mitochondrial membrane potential,and increasing the expression of Caspase-3.MDC staining and Western blot showed that the per-centage of MDC-positive cells was decreased and the expressions of Beclin-1,LC3-II and Atgs were inhibi-ted by asiatic acid treatment.5 μmol·L-1chloroquine was used to up-regulate the expressions of LC3-Ⅱand Beclin-1.Asiatic acid-inhibited autophagy was blocked and the total apoptotic rate was reduced remarkably.Conclusion Asiatic acid suppresses T98G cells pro-liferation by inducing apoptosis and inhibiting cell au-tophagy,and the very role of inhibiting autophagy could promote apoptosis to a certain extent.
Key words:asiatic acid;T98G cells;apoptosis;au-tophagy;mechanism;interaction
作者简介:李 欢(1990-),女,硕士生,研究方向:天然产物活性成分研究与开发,E-mail:lihuan405@sina.cn;单 宇(1979-),男,博士,副研究员,研究方向:天然产物活性成分研究与开发,通讯作者,Tel:025-84347116,E-mail:shanyu79@126.com
基金项目:国家自然科学基金资助项目(No 81402829);江苏省自然科学基金资助项目(No BK20131338);江苏省盐土生物资源研究重点实验室开放课题(No JKLBS2013003);江苏省药用植物研究开发中心开放基金(No药201201)
收稿日期:2015-05-07,修回日期:2015-07-28
文献标志码:A
文章编号:1001-1978(2015)10-1363-06
doi:10.3969/j.issn.1001-1978.2015.10.008