高产漆酶真菌菌株的筛选及酶学性质研究
马现成,任国莉,刘宇,刘淑静,王忠超,张跃华*
(1.佳木斯大学理学院,黑龙江佳木斯154007;2.黑龙江省汤原波巴布生物科技有限公司)
高产漆酶真菌菌株的筛选及酶学性质研究
马现成1,任国莉1,刘宇1,刘淑静1,王忠超2,张跃华1*
(1.佳木斯大学理学院,黑龙江佳木斯154007;2.黑龙江省汤原波巴布生物科技有限公司)
从6株野生真菌和5株食用真菌中筛选出高产漆酶菌株,并对筛选出的野生菌株漆酶酶学性质进行初步探究。使用G-PDA确定菌株的产漆酶能力,然后通过液体发酵对产生的粗酶液进行酶活力测定,确定高产漆酶菌株,最后分别在不同pH和温度下进行酶学性质探究。 初步筛选结果:第7天时,05号菌丝直径最大89.1mm,08号显色圈直径最大76.8mm,04号的显色圈颜色最深,09号显色反应最不明显。对于漆酶活力:04号活力最高262.7U/mL,其次是08号和05号分别为255.3 U/mL、203.9 U/mL。01和06号酶活力达到最大所需时间最短。 酶学性质方面,08号的最适pH是3.2、最适温度是40℃;在不同pH、温度下分别保温2h, pH=4.0酶活力残余率为94.20%;温度在20~40℃内,酶活力残余率在99.00%以上。结果表明,0.04%G- PDA最适作为产漆酶真菌的初筛培养基;高产漆酶能力的菌株有 04、05和08号菌株,且08号菌株漆酶的最适应用条件是pH=4.0、温度为40℃。
真菌;漆酶;筛选;酶学性质
漆酶(Laeease)是一种含铜多酚氧化酶,主要存在于植物和微生物体内,能够催化氧化多种芳香族和非芳香族化合物,同时氧气被还原为水[1]。日本学者Yoshida在1883年于漆树汁液中首次发现漆酶[2];1895年,Bertrand 第一次将其以生漆固化的活性物质分离出来,并首次将其命名为漆酶[1]。
19世纪末,研究人员发现一些高等真菌也能分泌漆酶[4]。经过一个多世纪的研究发现漆酶广泛存在于担子菌、多孔菌及子囊菌等菌中,其中最主要的漆酶生产者是担子菌的白腐真菌[5]。由于漆酶作用底物的广泛性和非底物特异性,因而漆酶可以广泛地运用于造纸业、酒类制造、食用菌生产和饮料制造等行业。随着漆酶的应用研究取得更大的突破性成果和显著性成就,漆酶对染料等污染物降解及环境生物修复等更多领域也有着重要的应用价值。因而,真菌漆酶的生产也越来越受到人们的关注,大量的研究工作围绕如何提高真菌漆酶的产量而展开。本文主要研究的是高产漆酶菌株筛选及漆酶酶学性质。
1 材料与方法
1.1 材料
本次筛选实验共选用了11种真菌菌株,其中5株为佳木斯大学环境微生物实验室保存的食用菌,分别是香菇(Lentinusedodes)01号菌株、金针菇(Flammulinavelutipes)02号菌株、鸡腿菇(Coprinuscomatus)03号菌株、杏鲍菇(Pleurotuseryngii)04号菌株、侧耳(Pleurotusostreatus)05号菌株;另外6株为伊春市仙翁山国家森林公园采集分离,分别是毛木耳(Auriculariapolytricha)06号菌株、香栓菇(Trametessuaveloens)07号菌、桦褶孔菌(Lenzitesbetulina)08号菌株、红乳菇(Lactariusacris)09号菌株、淡黄木层孔菌(Phellsnusgilvus)10号菌、杨树菇(Agrocybeaegerita)11号菌株。
1.2 培养基
PDA培养基(g/L):马铃薯200,葡萄糖20,琼脂 16~20,pH 自然。
愈创木酚PDA选择培养基(G-PDA):PDA培养基中添加0.04%的愈创木酚[6]。
液体发酵培养基(g/L):在液体PDA的基础上,KH2PO42,MgSO41.5,VB1微量[7]。
1.3 操作方法
1.3.1 愈创木酚浓度对显色圈的影响。取28℃恒温培养箱中活化培养7天直径为8.5mm的08号菌株菌片,分别转接到添加愈创木酚浓度为0.02%、0.03%、0.04%、0.05%、0.06%的PDA平板培养基上。置于30℃恒温培养箱中倒置培养,每个梯度5个重复。
1.3.2 G-PDA培养基初筛。取活化培养7天直径为8.5mm的菌片,转接到G-PDA平板培养基中心位置,置于30℃恒温培养箱中倒置培养。每隔24h观察记录一次显色圈变化情况,每个菌株5个重复。
1.3.3 液体发酵复筛。在200mL锥形瓶中加入100mL的液体发酵培养基,接入活化培养7天直径为8.5mm的菌片3个。在28℃、130r/min条件下摇瓶培养,从第5天开始测定酶活力。
1.3.4 粗酶液提取及活性测定。发酵液在4℃、5000r/min条件下离心15min,取上清液即为粗酶液[8]。取粗酶液、0.5mmol/L的ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)及pH为4.8的柠檬酸-磷酸氢二钠缓冲液各1mL,分别在30℃保温5mins,混合反应30s后,在波长420nm的紫外-可见分光光度计中测定吸光度变化。定义每分钟转化1μmol的底物所需的酶量为一个酶活力单位,用U/mL表示[9]。
1.3.5 酶的最适pH及pH稳定性[10]。在不同pH的缓冲液中按标准方法测定酶活,以酶活力最高时的pH为最适反应pH。将酶液在30℃不同pH的缓冲液中保存2h,按标准方法测定残余酶活,以未经保存处理的酶液酶活力为100%。
1.3.6 酶的最适温度及温度稳定性[11]。在不同温度条件下按标准方法测定酶活,以酶活力最高时的温度为最适反应温度。酶液在不同温度下保温2h,快速冷却至室温,按标准方法测定残余酶活,以未经保温处理的酶液酶活力为100%。
2 结果分析
2.1 不同浓度愈创木酚对显色圈影响结果
08号菌株在不同浓度G-PDA平板培养基上的生长情况及显色圈(氧化圈)颜色深度(见表1,见图1)。实验结果表明,在第7天时,0.02%的G-PDA上的08号菌丝长满整个平板;当愈创木酚的浓度大于0.04%时,虽然显色圈的颜色比较深,但是对菌株的生长会产生比较明显的抑制作用;而当愈创木酚浓度小于0.04%时,显色圈的颜色会比较浅且出现显色圈所需的时间较长。菌株在0.04%的G-PDA上培养24h就明显出现显色圈,且没有明显抑制作用,故在真菌菌株具有产漆酶能力的初步确定时,选用0.04%的G-PDA最为合适。
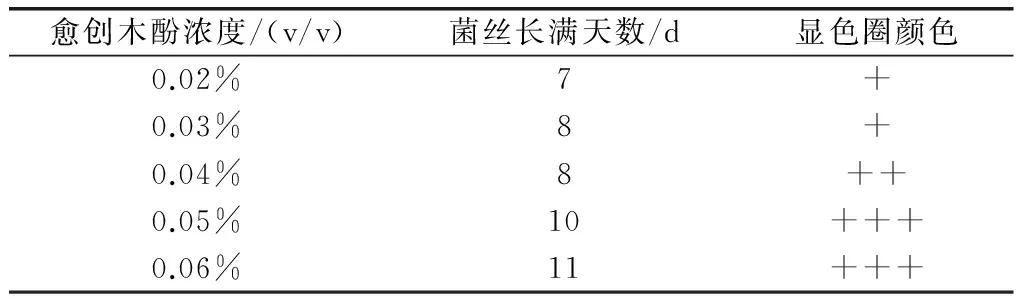
表1 不同浓度愈创木酚对08号的影响
注:+浅;++深;+++很深。
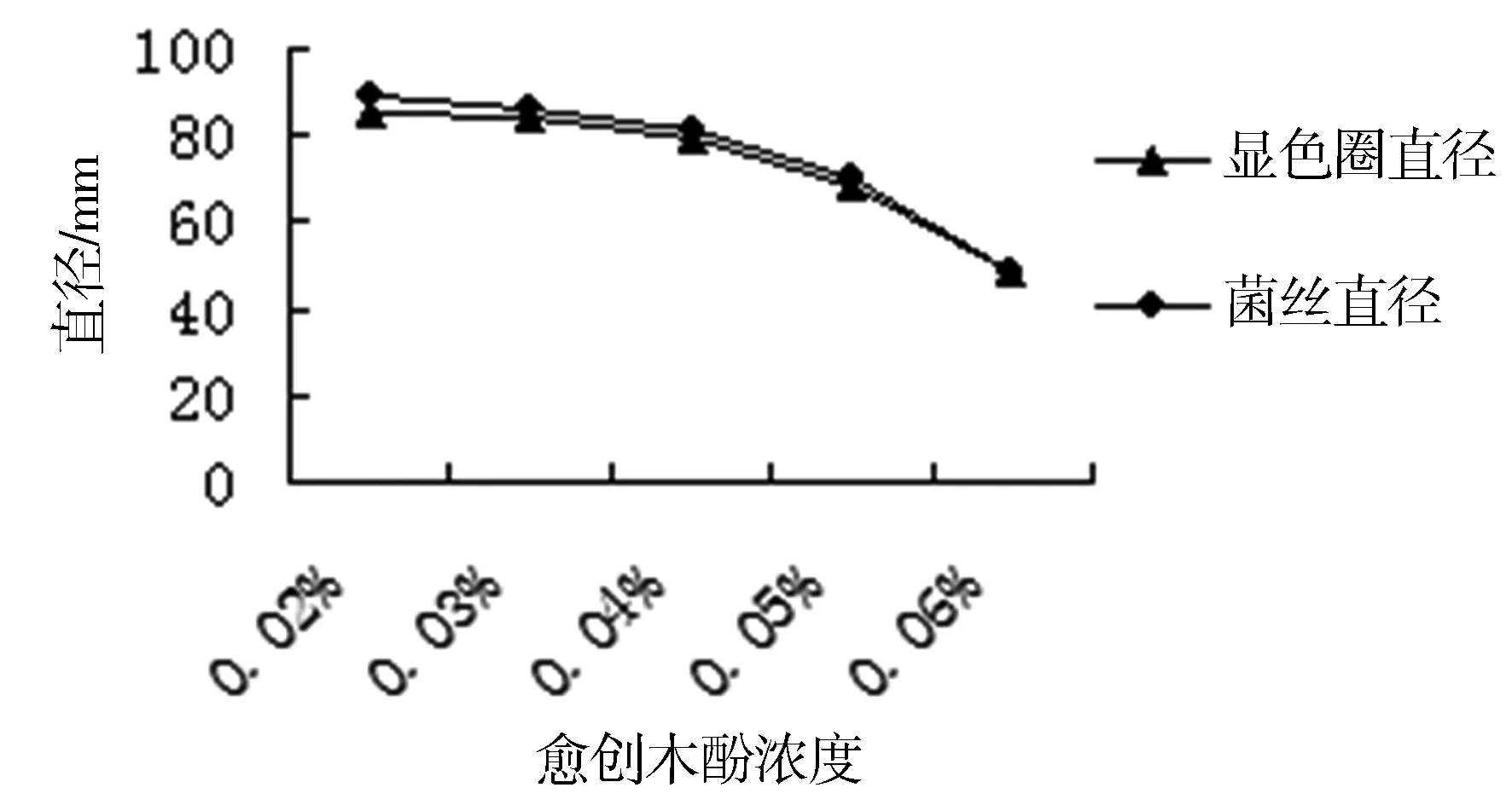
图1 不同浓度G-PDA上菌株的长势情况
2.2 初筛结果
各菌株在G-PDA上的显色反应结果表明(见表2),11种真菌在G-PDA上均有一定程度的显色反应。05号菌株菌丝生长速度最快,在第7天直径达到89.1mm(平板直径90mm);而第7天时,08号菌株的显色圈最大,达到76.8mm;04号菌株的显色圈颜色最深。直到第5天以后,09号菌株才出现颜色很浅的显色圈,菌丝的生长速度也明显落后于其他菌株,其产漆酶能力可以忽略,而其他10种菌株均具有一定产漆酶能力。
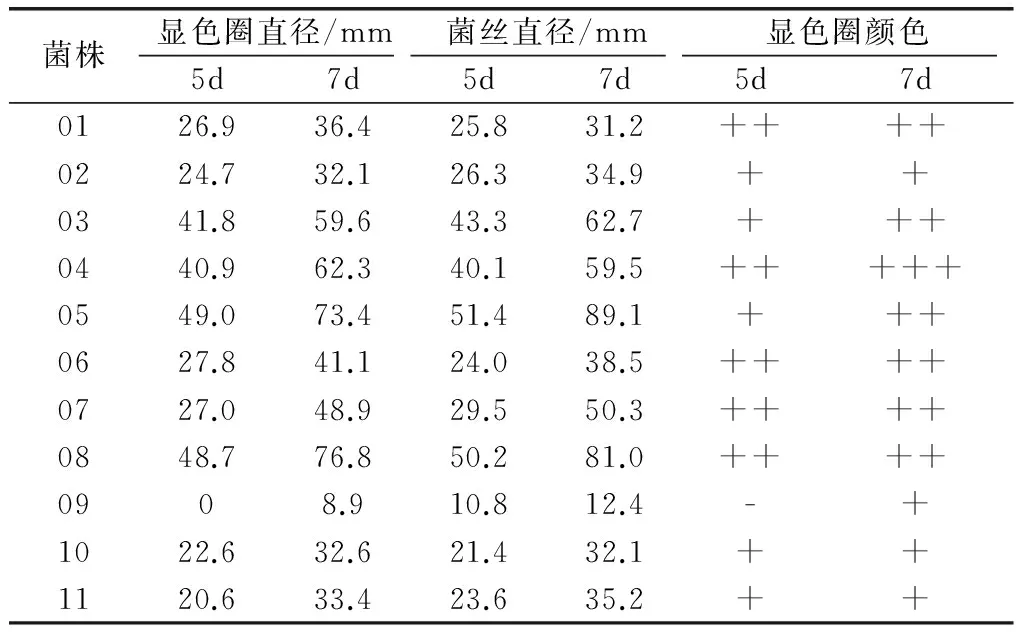
表2 菌株在G-PDA上的显色反应结果
注:-无;+浅;++深;+++很深。
2.3 复筛结果
对菌种进行液体发酵实验结果表明(图2,图3):食用菌的酶活力普遍比较高,而野生菌的酶活力普遍较低。除部分菌株在第7天酶活力达到最大值,其他菌株酶活力达到最大值的时间主要集中在10~13天。食用菌中酶活力最高的是04号菌株,在第11天达到最高262U/mL;其次为05号菌株,在第13天达到203 U/mL。01号菌株酶活力最大值最先出现。野生菌中酶活力最高的是08号菌株,在第11天达到最大255 U/mL,其他的菌株的酶活力均集中100 U/mL以下,酶活力最先出现最大值的是06号菌株。
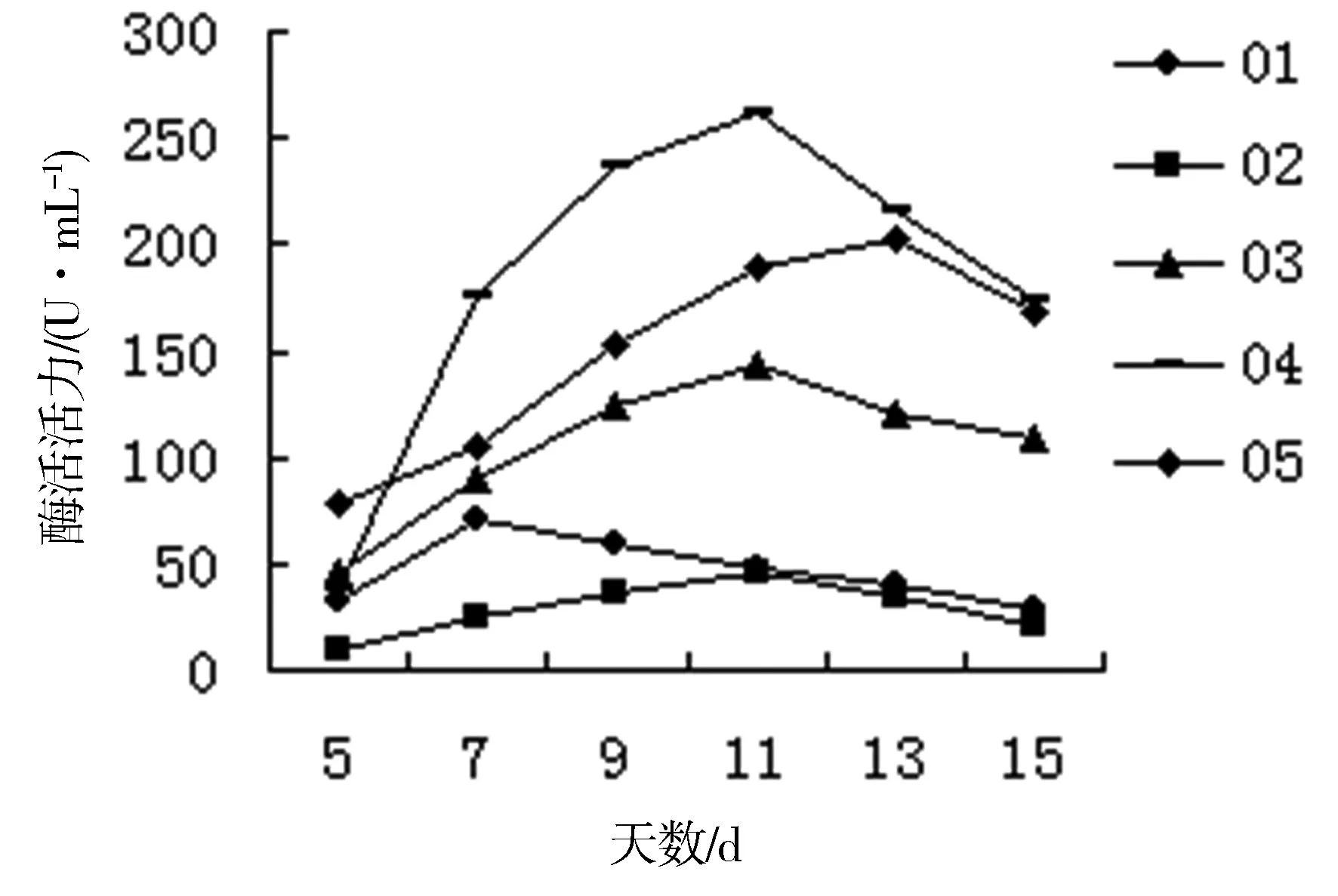
图2 食用菌液体发酵产漆酶酶活情况
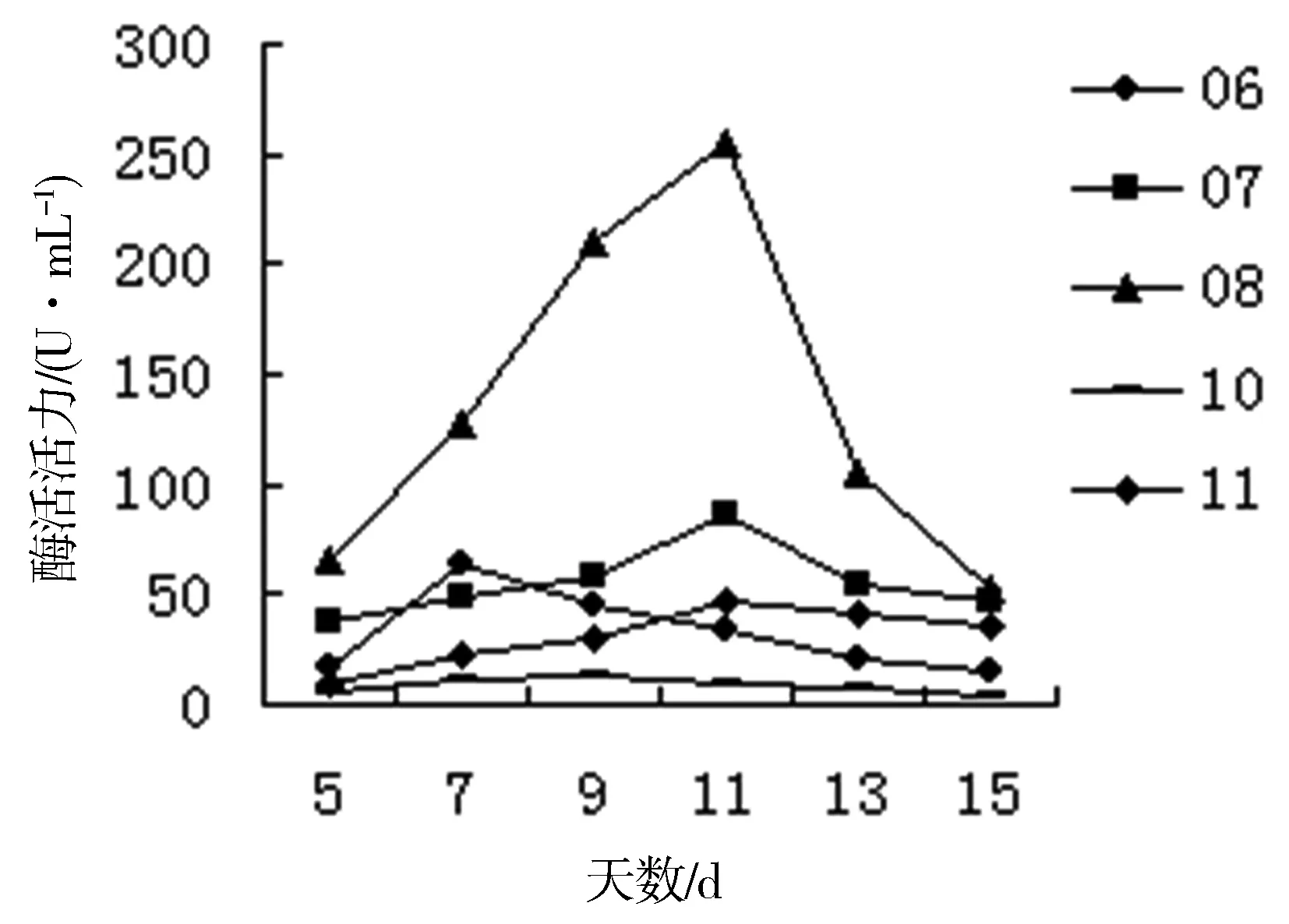
图3 野生菌液体发酵产漆酶酶活情况
结合显色反应发现,酶活力较高的菌株不仅显色反应出现较早,而且显色强烈或显色圈直径较大。最终确定04、05和08号3种菌株为高产的漆酶菌株,而01和06号菌株的酶活力出现最大值所需的时间最短,在实际的生产应用中也有着比较重要的意义。
2.4 酶的最适pH及pH稳定性
不同pH对08号菌株酶活力的影响及pH稳定性的实验结果表明(图4),pH=3.2时08号菌株的漆酶活性最高。随着pH值得增加到4.0以后,酶活力开始大幅度的下降。30℃条件下,酶液在不同pH的缓冲液中保存2h,残余的酶活力均在40%以上,在pH4.0~4.8范围内,酶活力残余率超过90%。pH=4.0时,酶活力残余率最高94.20%,而pH=3.2时,酶活力残余率仅有68.50%。因此08号菌株的漆酶应用最适pH为4.0。
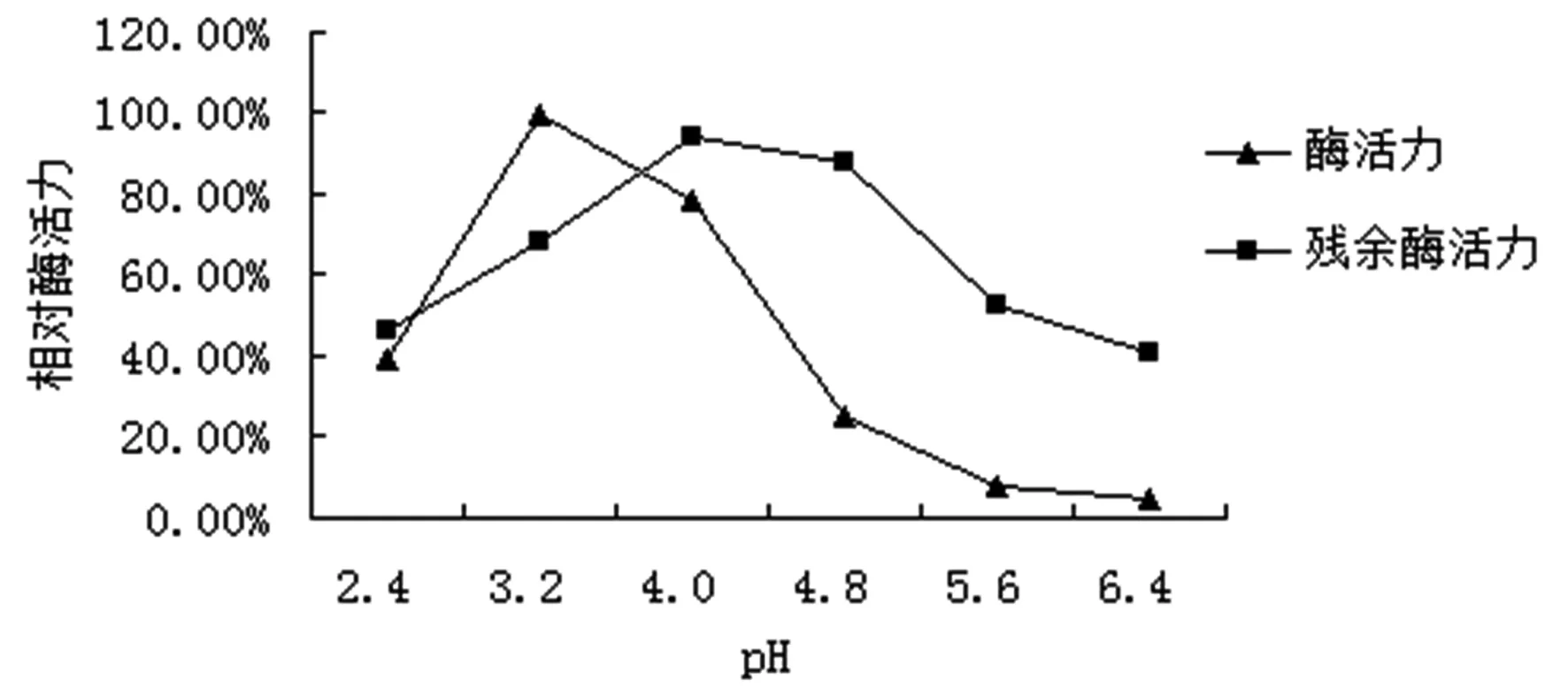
图4 pH对08号菌株漆酶活力影响及pH稳定性
2.5 酶的最适温度及温度稳定性
不同温度对08号菌株酶活力的影响及温度稳定性的实验结果表明(图5),08号菌株酶活力的最适温度为40℃。随着温度超过40℃,酶活力逐渐下降,且当温度达到70℃时酶活力残余率仅有9.17%。在20~40℃范围内,酶液保存2h对酶活力影响很小,酶活力残余率在99.00%以上。故08号菌株漆酶的最适应用温度为40℃。
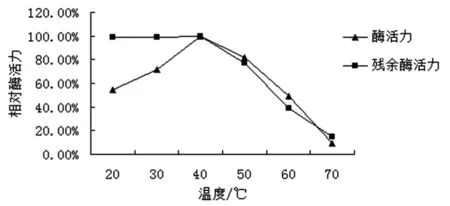
图5 温度对08号菌株的漆酶酶活影响及温度稳定性
3 讨论与展望
在产漆酶菌株的初筛中,以愈创木酚为底物进行显色反应能够确定菌株是否具有产漆酶能力,但不能判断产漆酶能力大小。故需要通过液体摇瓶发酵,提取粗酶液进行精确的酶活力检测。通过部分野生菌和食用菌的产漆酶能力比较发现,野生菌的漆酶生产能力相对较弱。因为食用菌通过研究人员的驯化、选育或基因改造,能够很好地适应于含有大量木质素和纤维素的木屑等做的菌袋并且生长速度很快,所以具有较好的产漆酶能力。在实际生产中应用漆酶降解作用时,不仅需要了解漆酶的最适pH和温度,更需要了解漆酶活性在不同pH和温度下的稳定情况。
在环境问题日益恶化的今天,将漆酶应用于污染物治理有着重要的应用价值和实际意义。因此在产漆酶菌株的筛选中,不仅需要具有高产能力的菌株,更需要能够在最短时间中达到最大酶活力的菌株。所以对于筛选出的高产菌株还要进一步的探索,以便缩短出现最大酶活所需的时间和提高漆酶活力。如:(1)在液体发酵培养基的制备中,选择合适的碳源和氮源;(2)在发酵培养基中加入Cu2+等有促进产酶作用的诱导因子;(3)对漆酶活性最大值出现较早的菌株和漆酶活力较大的菌株利用细胞融合技术处理;(4)利用基因工程方法,对产漆酶菌株进行基因改造。
[1]傅恺. 一株新型白腐菌产漆酶规律及其酶学性质的研究[D].广州:华南理工大学, 2010.
[2]Manolopoulos V G, Samet M M, Dr. P I L. Regulation of the adenylyl cyclase signaling system in various types of cultured endothelial cells [J]. Journal of Cellular Biochemistry, 1995, 57(4): 590-598.
[3]Mayer A.M., Staples R.C. Laccase: new functions for an old enzyme[J]. Phytochemistry, 2002, 60(6): 551-565.
[4]Cordi L, Minussi R.C, Freire R.S, et al. Fungal laccase: copper induction,semi-purification, immobilization, phenolic effluent treatment and electro chemical measurement[J]. African Journal of Biotechnology. 2007, 6(10).
[5]周蕊. 滑菇(pholiota namek)漆酶的诱导、纯化、cDNA克隆及表达[D]. 南京:南京林业大学, 2007.
[6]王宜磊, 朱陶, 邓振旭,等. 愈创木酚法快速筛选漆酶产生菌[J].生物技术, 2007, 17(2):40-42.
[7]郭梅, 蒲军, 梁鹏,等. 白腐菌Trametes versicolor产漆酶发酵条件的优化[J]. 食品研究与开发, 2006, 27(6):9-12.
[8]邹建炫. 白腐真菌产漆酶对染料废水降解的研究[D].南京:南京理工大学, 2004.
[9]Bourbonnais R&Paice M G. Oxidation of non-phenolic substrates. An expanded role for laccase in lignin biodegradation [J]. FEBS Lett,1990, 267: 99-102.
[10]肖楚, 刘佳, 许修宏. 黑木耳漆酶酶学性质的研究[J].中国农学通报, 2011, 27(25):158-161.
[11]肖楚. 黑木耳漆酶高产菌株筛选及发酵条件、酶学性质的研究[D].哈尔滨:东北农业大学,2012.
Screening of High-yield Laccase Fungal Strains and Enzymatic Characteristics Study
Ma Xiancheng1, Ren Guoli1, Liu Yu1, Liu Shujing1, Wang Zhongchao2, Zhang Yuehua1*
(1.College of Science, Jiamusi University, Jiamusi, Heilongjiang 154007;2.Tangyuan Bo Ba-bu Biotechnology Co. Ltd. Heilongjiang)
Object: Laccase High-yielding strains are screened from 6 wild fungi and 5 edible fungi. And a preliminary study of laccase enzymatic characteristics of screened wild yield laccase strains. Method: The use of G-PDA identified 11 kinds of fungal laccase production capacity. Then, the crude enzyme solution generated by liquid fermentation activity,which was measured, and got High-yielding strains of laccase. At last,Laccase put separately at different pH and temperature measurement of enzyme activity. Results: Preliminary screening results: In the first 7 days, No.05 mycelium largest diameter is 89.1mm, No.08 color-circle diameter is 76.8mm, No.04 color-circle color is the deepest, The color reaction No.09 is the most obvious. For laccase activity: No.04 highest enzyme activity is 262.7U/mL. Secondly, No.08 , No.05 are 255.3U/mL, 203.9U/mL respectively. Enzyme activity reached maximum shortest is No.01 and No.06. In terms of the enzymatic properties ,the optimum pH is 3.2, the optimum temperature is 40℃ of No.08 strain. At pH=4.0, the residual of enzyme activity was 94.20%; In the 20~40 ℃, the lowest rate of residual enzyme activity was 99.00%. Conclusion: 0.04% G-PDA as the optimal screening fungal laccase production medium. Strain has the ability to determine the High - yielding of laccase for No.04, No.05 and No.08 strains. And 08 strains of Laccase optimal utilization conditions is pH=4.0, and temperature is 40℃.
Fungi; Laccase; Screening;Enzymatic characteristics
2015-04-30
佳木斯大学大学生科技创新项目(xslz2014-006);佳木斯大学科学技术校级面上项目(L2013-076)
马现成(1993-)男,本科在读,环境科学专业,E-mail: 15945886494@163.com;*
TQ920.6
A
DOI.:10.13268/j.cnki.fbsic.2015.04.003

