硫酸盐浆酶解液中LCC的提取及性质研究
夏 青 姚 兰,2 张宏伟 杨海涛,2,*
(1.湖北工业大学轻工学部制浆造纸工程学院,湖北武汉,430068;2.绿色轻工材料湖北省重点实验室,湖北武汉,430068;3.武汉联合工程顾问咨询有限公司,湖北武汉,430071)
硫酸盐浆酶解液中LCC的提取及性质研究
夏 青1姚 兰1,2张宏伟3杨海涛1,2,*
(1.湖北工业大学轻工学部制浆造纸工程学院,湖北武汉,430068;2.绿色轻工材料湖北省重点实验室,湖北武汉,430068;3.武汉联合工程顾问咨询有限公司,湖北武汉,430071)
为了探究硫酸盐浆在酶解过程中是否有小分子LCC溶出及其性质,以麦草为原料,通过硫酸盐法制浆得到硫酸盐麦草浆,并依次进行聚木糖酶、纤维素酶酶解。利用凝胶渗透色谱柱分离出酶解液中的小分子LCC,然后对LCC进行FT-IR、2D-HSQC(二维异核单量子碳氢相关)核磁共振分析。结果表明,从麦草浆聚木糖酶酶解液(XHL)中可分离出小分子LCC,但在纤维素酶酶解液(CHL)中只存在纤维素;2D-HSQC分析表明,从XHL中分离得到的小分子LCC主要是聚木糖和木素通过苯基配糖体键、苯甲醚键和γ-酯键连接在一起的,说明聚木糖酶能同时对纸浆中残余的聚木糖和木素与聚木糖之间的化学连接键进行降解。
麦草浆;聚木糖酶;纤维素酶;2D-HSQC
硫酸盐法制浆是一种常用的制浆方法,通常是在高温下加入氢氧化钠和硫化钠以去除和降解原料中的木素,但硫酸盐法制浆后会有部分木素残留在纸浆中[1- 4]。大量理论研究[5- 6]表明,植物中木素与部分碳水化合物通过化学键相结合并以木素-碳水化合物复合体(Lignin-Carbohydrate Complexes,LCC)的形式存在于植物纤维的细胞壁中。LCC的存在是木素无法被完全脱除的主要原因。
为了探究硫酸盐浆残余木素的性质,需要对木素进行提取,最常用的提取方法是酶解法。通过该方法可以去除纸浆的纤维素和半纤维素。在纸浆酶解过程中,酶究竟是仅对纸浆中残留的聚糖进行了降解,还是对LCC中部分聚糖进行了降解,以及这个过程是否有小分子LCC伴随溶出和是否有LCC的降解产物存在,至今仍然没有统一的定论[7-14]。
本实验以麦草为原料,对其进行硫酸盐法制浆,对得到的硫酸盐麦草浆依次进行聚木糖酶和纤维素酶的酶解,再利用凝胶渗透色谱柱分别处理聚木糖酶酶解液(XHL)和纤维素酶酶解液(CHL),并对分离出的物质进行紫外光谱、红外光谱和二维异核单量子碳氢相关(2D-HSQC)核磁共振谱图分析,即通过实验探究酶解过程中是否有小分子LCC伴随溶出及是否有LCC的降解产物存在。
1 实 验
1.1 麦草浆的制备
实验纸浆为硫酸盐麦草浆。硫酸盐法制浆条件:用碱量17%(以Na2O计),硫化度25%,液比1∶4,最高蒸煮温度160℃,升温90 min,保温60 min。
1.2 麦草浆的聚木糖酶酶解
将20.5 g乙酸钠溶解在500 mL蒸馏水中,再将14.3 mL乙酸(冰醋酸)溶解在500 mL蒸馏水中,最后按照乙酸钠与乙酸体积比59∶41的比例混合,调节pH值至4.8,制得乙酸/乙酸钠缓冲溶液,贮存于冰箱备用。
在500 mL三角瓶内,称取5 g(绝干)麦草浆,加入200 mL 0.5 mol/L乙酸/乙酸钠缓冲溶液、0.4 g聚木糖酶、0.1%的叠氮化钠,在50℃条件下酶解48 h。酶解反应完成后,将三角瓶中的物质离心分离,固体用蒸馏水反复冲洗后放置冰箱保存,记为XHS(聚木糖酶酶解后的麦草浆);液体减压旋转蒸发至一定体积得到XHL。
1.3 麦草浆的纤维素酶酶解
称取13.12 g乙酸钠,量取乙酸溶液9.28 mL,加入蒸馏水调至8 L,调节pH值至4.5,制得乙酸/乙酸钠缓冲溶液。取2 g纤维素酶加入到20 mL乙酸/乙酸钠缓冲溶液中溶解,得到的溶液用100 mL具塞三角瓶装好放入冰箱储存备用。
称取4 g(绝干)XHS放入250 mL的三角瓶中,加入已配好的纤维素酶溶液4.8 mL、0.1%的叠氮化钠,再加入乙酸/乙酸钠缓冲溶液调至120 mL,最后将配制好的三角瓶在45℃条件下酶解48 h。将酶解后的溶液离心分离,残留物重复以上操作2次。最后,将3次离心分离的清液收集起来并减压旋转蒸发至一定体积得到CHL。
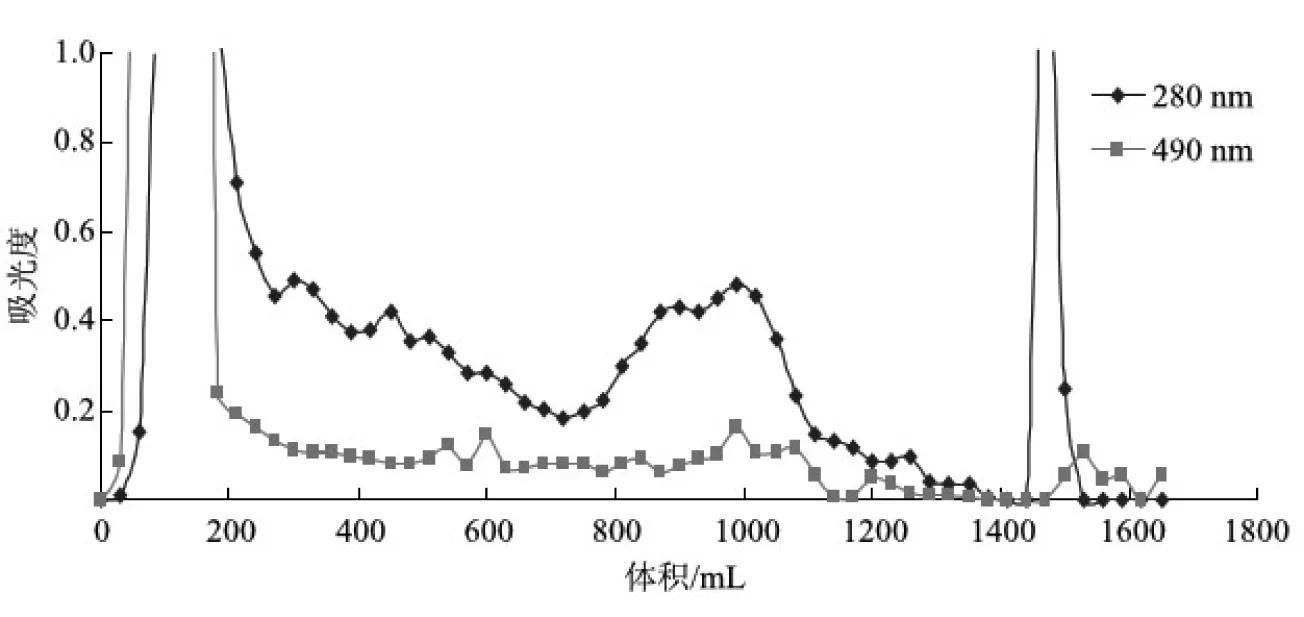
图1 硫酸盐麦草浆XHL凝胶渗透色谱分离谱图
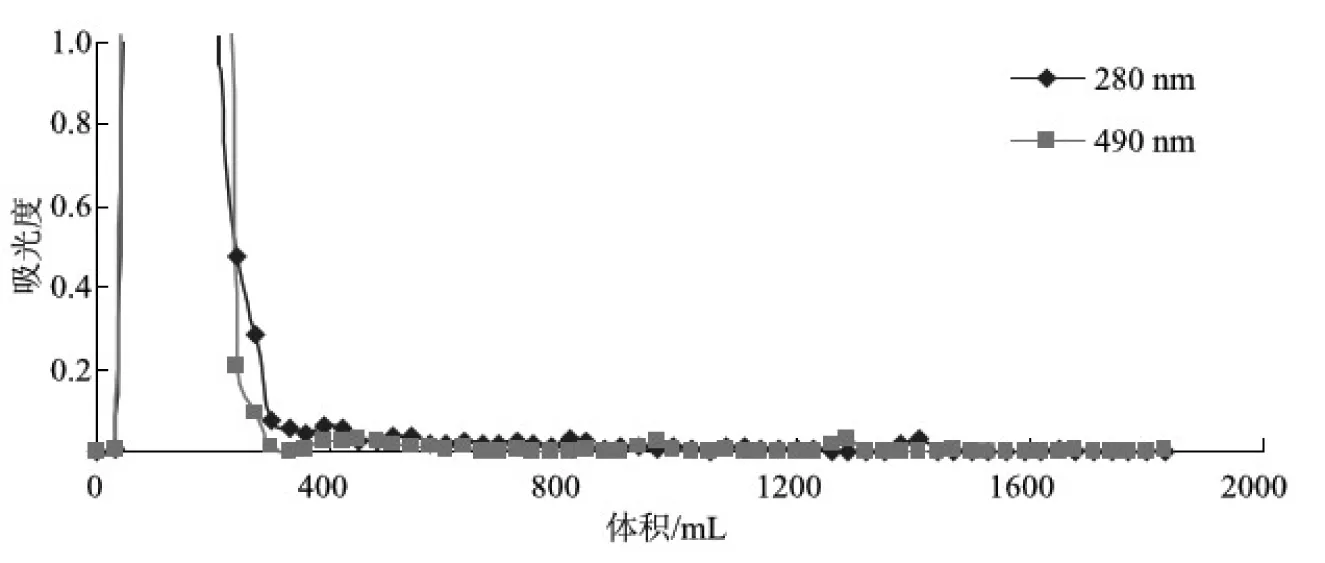
图2 硫酸盐麦草浆CHL凝胶渗透色谱分离谱图
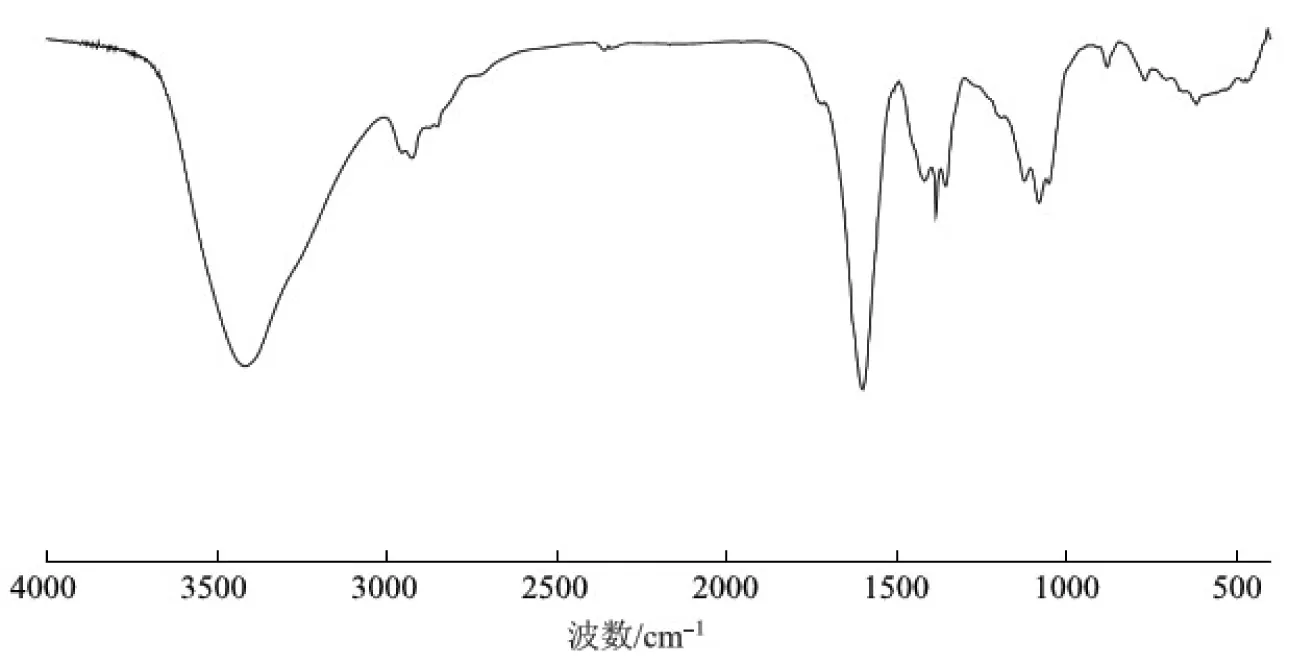
图3 硫酸盐麦草浆CHL凝胶渗透色谱分离物FT-IR谱图
1.4 酶解液中LCC的分离
用水作为流动相,将XHL通过Toyopearl HW- 40S(4.0 cm×45.0 cm)型凝胶渗透色谱柱,每30 mL作为1个组分。从每一组分中取1 mL样品进行苯酚-浓硫酸染色实验后,利用Shimadzu UV-vis 2201型紫外分光光度计在490 nm波长下进行可见光扫描以测其糖含量[15],再从每一组分中取1 mL样品在280 nm波长下进行扫描以测其木素含量[16],直至样品中多糖组分几乎全部被水洗出后,再改用二氧六环-水溶液(前者与后者体积比为1∶1)作为流动相,将吸附在凝胶表面的物质洗出,并继续进行紫外分光光度检测至分离结束。最后,将收集到的富含LCC的组分减压旋转蒸发、冷冻干燥即可得到目标产物。CHL中LCC的分离方法同上。
1.5 红外光谱分析
取1~2 mg样品与10倍于样品的无水KBr混合,混合后倒入压片模具中压片,采用美国Thermo Nicolet 360型傅里叶红外光谱仪用透过法测定傅里叶变换红外光谱图(FT-IR)。
1.6 2D-HSQC核磁共振谱图分析
将60 mg分离得到的LCC溶于0.5 mL二甲亚砜(DMSO-d6),用直径5 mm的核磁管在BREKER- 600核磁共振仪对每个样品进行1H、13C连续扫描得到HSQC谱图。实验条件为:碳氢耦合常数145 Hz,1H和13C 2个维度谱宽分别为5000 Hz和20000 Hz,1H维度采样点数量1024、13C维度采样点数量256。
2 结果与讨论
2.1 凝胶渗透色谱分离结果分析
图1和图2分别为麦草浆XHL和CHL中LCC分离时的凝胶渗透色谱分离谱图。从图1和图2可以清楚地看到,XHL和CHL在280 nm和490 nm 处都有吸收。分离后期,当多糖组分几乎全被蒸馏水洗出后,改用二氧六环-水溶液作为流动相,将残留在凝胶中的物质洗出。从图1可知,流出组分(1500 mL左右)在280 nm和490 nm处均有吸收,说明该组分中既有木素,又有碳水化合物,可能为木素-碳水化合物复合体(LCC),但这需要利用核磁共振进行进一步分析。改用二氧六环-水溶液作流动相时分离出来的组分中,木素含量比碳水化合物含量高,这表明麦草浆在聚木糖酶酶解过程中,更多的碳水化合物降解成水溶性的多糖组分,在分离初期被水洗出。图2表明,流出组分在280 nm和490 nm处均有微弱吸收,为了确定流出组分的结构,需要进行进一步分析。
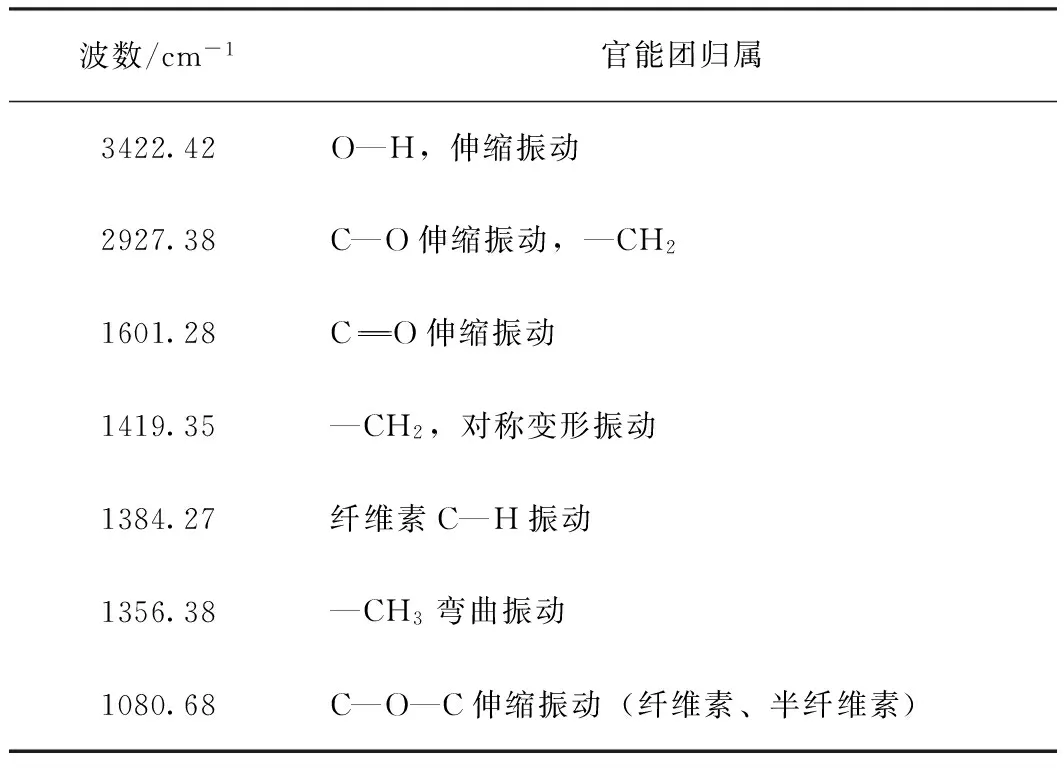
表1 硫酸盐麦草浆CHL凝胶渗透色谱分离物FT-IR谱图官能团归属
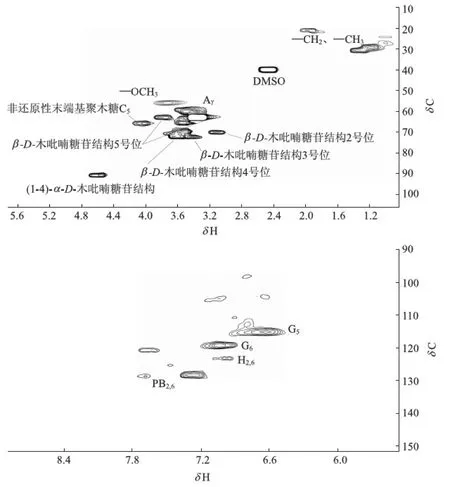
图4 硫酸盐麦草浆XHL凝胶渗透色谱分离物2D-HSQC核磁共振谱图
2.2 红外光谱分析
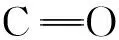
2.3 2D-HSQC核磁共振谱图分析
图4为硫酸盐麦草浆XHL凝胶渗透色谱分离物的2D-HSQC核磁共振谱图,其主要的13C-1H相关归属见表2。
从2D-HSQC谱图的侧链区和碳水化合物异头碳区可知木素和与木素相连的碳水化合物的相关信号。硫酸盐麦草浆XHL凝胶渗透色谱分离物中β-O- 4′结构Cγ-Hγ位于δC/δH 60.17/3.43[18],而芳香环内的愈创木基(G)型结构单元C5-H5和C6-H6分别位于δC/δH 115.06/6.64和δC/δH 119.19/7.04[19],对羟苯基(H)型结构单元C2,6-H2,6的相关信号在δC/δH 123.12/7.00,其对应的C3,5-H3,5相关信号与G型结构单元C5-H5的相关信号重叠。
除了上述木素分子的主要相关信号外,与木素相连的碳水化合物的信号十分明显。其中,β-D-木吡喃糖苷结构2、3、4、5号位的相关信号分别位于δC/δH 69.95/3.15、δC/δH 72.16/3.41、δC/δH 72.02/3.54、δC/δH 62.86/3.40和δC/δH 62.87/3.74[20]。(1- 4)-α-D-木吡喃糖苷结构异头碳的相关信号出现在δC/δH 90.61/4.56,还发现聚木糖基C4、非还原性末端基聚木糖基C5的相关信号分别位于δC/δH 69.78/3.52和δC/δH 66.65/4.02。上述相关信号峰的出现表明,硫酸盐麦草浆在聚木糖酶酶解过程中,聚木糖酶不仅对纸浆中残余的聚木糖进行降解,还对木素与聚木糖之间的化学连接键进行了降解。得到的小分子LCC主要是由聚木糖和木素形成的,且根据来自于δC/δH 97.46/4.25、δC/δH 78.96/3.25和δC/δH 61.28/4.29处的信号峰可以判断聚木糖和木素之间是通过苯基配糖体键、苯甲醚键和γ-酯键连接在一起的[21],并且通过信号峰的强弱判断连接键以苯基配糖体键为主。

表2 硫酸盐麦草浆XHL凝胶渗透色谱分离物2D-HSQC核磁共振谱图主要13C-1H相关归属
注 X1为木糖的1号碳原子。
3 结 语
硫酸盐法麦草浆纤维素酶酶解液(CHL)中没有分离出小分子木素-碳水化合物复合体(LCC),而聚木糖酶酶解液(XHL)经过凝胶渗透色谱柱分离得到的物质中含有LCC。2D-HSQC(二维异核单量子碳氢相关)核磁共振谱图分析表明,硫酸盐法制浆过程中,聚木糖酶不仅对纸浆中残余聚木糖进行降解,还对木素与聚木糖之间的化学连接键进行了降解,而且,得到的小分子LCC主要是聚木糖和木素通过苯基配糖体键连接在一起。
[1] 聂国兴, 王俊丽, 明 红. 聚木糖酶的应用现状与研究[J]. 工业微生物, 2008, 38(1): 53.
[2] Viikari L, Ranva M, Kantelinen A. Bleaching with enzymes[C]//Third International Conference in Biotechnology in Pulp and Paper Industry. Stockholm, Sweden, 1986: 67.
[3] Wong K KY, Tan L U L, Saddler J N. Multiplicity ofβ-1,4-xylanase in microorganisms: function and applications[J]. Microbiol Rev, 1988, 52(3): 305.
[4] 葛培锦, 赵 建, 曲音波, 等. 热水和聚木糖酶预处理制备麦草碱法化机浆的研究[J]. 中国造纸学报, 2004, 19(2): 25.
[5] Wang Xuan, Cui Xiaoxia, Zhang Liping. Preparation and characterization of lignin-containing nanofibrillar cellulose[J]. Procedia Environmental Sciences, 2012, 16: 125.
[6] 叶育敏. 浅谈纸浆漂白技术的发展[J].西南造纸, 2006, 35(5): 24.
[7] ZHAO Jian, LI Xue-zhi, QU Yin-bo, et al. Alkaline peroxide mechanical pulping of wheat straw with enzyme treatment[J]. Applied Biochemistry and Biotechnology, 2004, 112(1): 13.
[8] Zhan Huaiyu, Yue Baozhen, Hu Weijian, et al. Kraft reed pulp TCF bleaching with enzyme pretreatment[J]. Cellulose Chemistry and Technology, 1999, 33(1): 53.
[9] Bissoon S, Christov L, Singh S. Bleach boosting effects of purified xylanase from Thermomyces Lanuginosus SSBP on bagasse pulp[J]. Process Biochemistry, 2002, 37(6): 567.
[10] Roncero M B, Torres A L, Colom J F, et al. TCF bleaching of wheat straw pulp using ozone and xylanase. Part A: Paper quality assessment[J]. Bioresource Technology, 2003, 87(3): 305.
[11] 詹怀宇, 黄 方, 李建军, 等. 马尾松硫酸盐浆聚木糖酶辅助漂白生产试验[J]. 中国造纸, 2001, 20(4): 37.
[12] 崔学全, 许志晔, 张桂兰, 等. 聚木糖酶在麦草浆漂白中的应用[J]. 中国造纸, 2005, 24(11): 64.
[13] 刘 杰. AU-PE聚木糖酶在草木混合浆漂白中的应用[J]. 国际造纸, 2008, 20(1): 37.
[14] Manji A H. Extended usage of xylanase enzyme to enhance the bleaching of softwood kraft pulp[J]. Tappi J, 2006, 5(1): 23.
[15] 王 鹏, 谢益民, 范建云. 果胶-木素复合体化学结构13C同位素示踪法的研究[J]. 陕西科技大学学报: 自然科学版, 2006, 24(5): 17.
[16] 杨海涛. 碳-13同位素示踪法研究木素与LCC的化学结构及形成机理[D]. 广州: 华南理工大学, 2004.
[17] Kacurakova M, Belton P S, Wilson R H,et al. Hydration properties of xylan-type structures: an FT-IR study of xylo-oligosaccharides[J]. Journal of the Science of Food and Agriculture, 1998, 77: 38.
[18] Rencoret J, Marques G, Gutierrez Ana, et al. HSQC-NMR analysis of lignin in woody (EucalyptusglobulusandPiceaabies)and non-woody (Agavesisalana) ball-milled plant materials at the gel state[J]. Holzforschung, 2009, 63(6): 691.
[19] Yuan T Q, Sun S N, Xu F, et al. Characterization of Lignin Structures and Lignin Carbohydrate Complex (LCC) Linkages by Quantitative13C and 2D HSQC NMR Spectroscopy[J]. Journal of agricultural and food chemistry, 2011, 59(19): 10604.
[20] 袁同琦. 三倍体毛白杨组分定量表征及均相改性研究[D]. 北京: 北京林业大学, 2012.
[21] Min D Y, Jameel H, Chang H M, et al. The structural changes of lignin and lignin-carbohydrate complexes in corn stover induced by mild sodium hydroxide treatment [J]. RSC Adv, 2014(4): 10845.
(责任编辑:关 颖)
Isolation and Characteristic Research of LCC from Enzymatic Hydrolysis Liquor of Kraft Wheat Straw Pulp
XIA Qing1YAO Lan1,2ZHANG Hong-wei3YANG Hai-tao1,2,*
(1.InstituteofPulpandPapermakingEngineering,HubeiUniversityofTechnology,Wuhan,HubeiProvince, 430068;2.HubeiProvincialKeyLabofGreenMaterialsforLightIndustry,Wuhan,HubeiProvince, 430068;3.WuhanUnionEngineeringConsultingCo.,Ltd.,Wuhan,HubeiProvince, 430071)
(*E-mail: yaolislan1982@aliyun.com)
In the study, wheat straw kraft pulp was prepared, then it was treated by xylanase and cellulase sequentially. The low molecular weight LCC was isolated from the enzymatic hydrolysis liquor using Gel Penetration Chromatography column. FT-IR and 2D-HSQC were employed to study the characteristic of the LCC. The results showed that LCC existed only in xylanase hydrolysis liquor (XHL).The analysis results of 2D-HSQC indicated that the LCC was formed by xylan and lignin connected by benzyl ether, phenyl glycoside andγ-ester bonds.It could also conclude that in xylanase hydrolysis process, xylan and the linkages of lignin-xylan in the kraft pulp could be degraded.
wheat straw pulp; xylanase; cellulase; 2D-HSQC
2014-12-10
国家自然科学基金(31500496);绿色轻工材料湖北省重点实验室2013年开放基金。
夏 青,女,1989年生;在读硕士研究生;主要从事生物质能源化工的研究工作。
*通信联系人:杨海涛,E-mail:yaolislan1982@aliyun.com。
TS71+1;
A
1000- 6842(2015)03- 0005- 05

