三黄糖肾康对2型糖尿病并发骨质疏松症大鼠瘦素表达的影响研究
王静怡,奚 悦
·中医·中西医结合研究·
三黄糖肾康对2型糖尿病并发骨质疏松症大鼠瘦素表达的影响研究
王静怡,奚 悦
目的 探讨三黄糖肾康对2型糖尿病并发骨质疏松症大鼠瘦素表达的影响。方法 2013年6月—2014年11月取雌性Wistar大鼠,采用随机数字表法分为正常对照组10只,骨质疏松症模型组10只和糖尿病模型组50只。糖尿病模型组大鼠进一步按血糖水平随机分为糖尿病模型对照组、中药预防组、中药高剂量组、中药低剂量组和西药组(每组10只)。7组大鼠分别给予相应干预,喂养20周后取材检测大鼠空腹血糖、血清瘦素、骨密度、骨组织瘦素mRNA和瘦素表达水平、下丘脑瘦素长型受体(LRb)、磷酸化信号转导与转录激活因子3(p-STAT3)和磷酸化信号转导与转录激活因子5(p-STAT5)的表达水平。结果 中药预防组、中药高剂量组、中药低剂量组和西药组大鼠空腹血糖水平、骨组织瘦素mRNA和瘦素表达水平、下丘脑LRb表达水平较正常对照组和骨质疏松症模型组升高,较糖尿病模型对照组下降(P<0.05);血清瘦素水平、下丘脑p-STAT3和p-STAT5表达水平较正常对照组升高,较骨质疏松症模型组和糖尿病模型对照组下降(P<0.05);骨密度较骨质疏松症模型组升高(P<0.05)。结论 三黄糖肾康可能通过改善瘦素抵抗,直接或间接调节瘦素对骨代谢的影响,从而对2型糖尿病并发骨质疏松症起到治疗作用。
糖尿病;骨质疏松症;瘦素;大鼠;三黄糖肾康
王静怡,奚悦.三黄糖肾康对2型糖尿病并发骨质疏松症大鼠瘦素表达的影响研究[J].中国全科医学,2015,18(24):2966-2970,2975.[www.chinagp.net]
Wang JY,Xi Y.Effects of Sanhuangtangshenkang on the expression of leptin in rats with type 2 diabetes mellitus complicated with osteoporosis[J].Chinese General Practice,2015,18(24):2966-2970,2975.
骨质疏松症是糖尿病慢性并发症之一,流行病学调查资料显示,糖尿病患者骨质疏松症发病率为40%~66%[1]。骨质疏松症易导致骨折,致残率较高,严重影响糖尿病患者的生活质量。2型糖尿病并发骨质疏松症的发病机制尚未明确,临床上也缺乏有效药物治疗,因此迫切需要寻找高效低毒的药物用于骨质疏松症的防治。2型糖尿病患者常合并肥胖,瘦素的高表达与肥胖和2型糖尿病有高度相关性[2]。众多研究表明,瘦素参与能量代谢和骨代谢的调节[3-5]。由此推测,瘦素在糖尿病并发骨质疏松症中可能发挥一定作用。本课题组前期研究发现,中药三黄糖肾康具有良好的防治糖尿病肾病发生与发展的作用[6],但其对糖尿病并发骨质疏松症的影响尚未见文献报道。本实验测定糖尿病并发骨质疏松症大鼠血清、骨组织瘦素及下丘脑中瘦素长型受体(LRb)表达水平,并观察三黄糖肾康对瘦素及其受体后信号转导通路的影响。
1 材料与方法
1.1 实验动物 2013年6月—2014年11月,3月龄健康雌性Wistar大鼠90只购于辽宁长生生物技术有限公司,SPF级,体质量(280±20)g,动物合格证号:SCDK2010-0001。自由进食饮水,室温21~24 ℃。
1.2 药品及试剂 三黄糖肾康方剂组成:黄精40 g,黄芪40 g,黄连6 g,虎杖30 g,泽兰20 g,水蛭粉6 g。以上诸药为成人1 d服用量,常规水冲煮。免煎颗粒为江苏省江阴制药厂生产。钙尔奇D3片(产品编号:C1320203236)购自惠氏制药有限公司。普通饲料、高糖高脂饲料(沈阳市前民饲料加工厂),链脲佐菌素(STZ)(Sigma公司),血清瘦素试剂盒(中国人民解放军总医院科技开发中心),免疫组化染色试剂盒(武汉博士德生物技术有限公司)。
1.3 实验方法
1.3.1 造模 90只Wistar大鼠采用随机数字表法分为正常对照组10只,骨质疏松症模型组15只,糖尿病模型组65只。骨质疏松症模型组大鼠于正常饲料喂养1周时行双侧卵巢切除术,5周时处死3只取股骨测骨密度确定骨质疏松症大鼠模型成功。糖尿病造模组大鼠于高糖高脂饲料喂养5周时,按35 mg/kg一次性尾静脉注射溶于枸橼酸盐缓冲液(pH值4.2)的STZ,3 d后取尾血测定空腹血糖≥16.7 mmol/L为糖尿病造模成功,9只未成功造模及死亡大鼠淘汰出组。该造模方法以参考文献[7]为依据。
1.3.2 实验分组与给药 骨质疏松症模型组和糖尿病模型组大鼠造模成功后,从12只骨质疏松症模型大鼠中随机选取10只入骨质疏松症模型组,从56只糖尿病模型大鼠中随机选取50只,按血糖水平随机分为:糖尿病模型对照组10只、中药预防组10只、中药高剂量组10只、中药低剂量组10只、西药组10只。中药预防组大鼠自造模成功日起即开始给药,连续给药20周;其余各组造模成功2周后,分别给予相应药物灌胃,连续给药18周。每100 g三黄糖肾康颗粒溶于384 ml蒸馏水,混匀成浓度为3.84 g/ml的药液,供中药高剂量组使用,给药量为1 ml,将其稀释3倍至1.28 g/ml,供中药预防组和中药低剂量组使用,给药量为1 ml。钙尔奇D3片制成粉末18 mg溶于100 ml蒸馏水中,混匀成浓度为0.18 mg/ml的药液,供西药组使用,给药量为1 ml。正常对照组、骨质疏松症模型组和糖尿病模型对照组均给予1 ml·100 g-1·d-1蒸馏水灌胃。
1.4 取材 实验完全结束,禁食 12 h后,处死各组大鼠。1%氯胺酮麻醉后,心尖取血约5 ml,3 000 r/min离心10 min(离心半径12.5 cm),取上层血清液,-20 ℃保存。取血后用0.9%氯化钠溶液对大鼠进行心脏灌注,取下丘脑,将所取标本迅速放入多聚甲醛固定液中固定。然后完整离断腰椎(L3~L6)、左侧股骨,仔细剥离软组织,用0.9%氯化钠溶液浸湿的纱布包裹,-20 ℃保存。右侧胫骨近端置于70%乙醇溶液中,4 ℃保存。1.5 观察指标和测定方法 空腹血糖采用全自动生化仪检测,血清瘦素采用酶联免疫吸附试验(ELISA)试剂盒检测,骨密度采用双能X线骨密度仪(DXA)测定。骨组织瘦素mRNA表达水平采用反转录聚合酶链式反应(RT-PCR)法测定,瘦素上游引物:5′-CCTGTGGCTTTGGTCCTATCTG-3′,下游引物:5′-CTGCTCAGAGCCACCACCTCTG-3′,扩增产物长度420 bp;β-actin上游引物:5′-CCAAGGCCAACCGCGAGAAGATGAC-3′,下游引物:5′-AGGGTACATGGTGGTGGCGCCAGAC-3′,扩增产物长度577 bp。结果用扩增靶基因产物的表达水平与内参β-actin表达水平积分吸光度的比值表示。骨组织瘦素表达水平采用Western blotting 法检测,蛋白条带的灰度值与相应内参β-actin条带灰度值比值即为相对蛋白表达水平。下丘脑LRb、磷酸化信号转导与转录激活因子3(p-STAT3)和磷酸化信号转导与转录激活因子5(p-STAT5)表达水平采用免疫组化染色试剂盒检测,操作步骤严格按照试剂盒说明书进行,显微镜观察并拍照,利用真彩色CMIAS医学图像分析系统测定阳性染色区域。每只大鼠下丘脑核团区各取5个高倍视野(×40),测定单位面积阳性染色区域的平均吸光度作为下丘脑LRb、p-STAT3和p-STAT5表达情况。
2 结果
2.1 各组大鼠空腹血糖、血清瘦素和骨密度比较 与正常对照组和骨质疏松症模型组比较,糖尿病模型对照组、中药预防组、中药高剂量组、中药低剂量和西药组大鼠空腹血糖水平升高,差异均有统计学意义(P<0.05);与糖尿病模型对照组比较,中药预防组、中药高剂量组、中药低剂量组和西药组大鼠空腹血糖水平下降,差异均有统计学意义(P<0.05);与中药预防组比较,中药高剂量组、中药低剂量组大鼠空腹血糖水平升高,差异均有统计学意义(P<0.05)。与正常对照组比较,其余各组大鼠血清瘦素水平升高,差异均有统计学意义(P<0.05);与骨质疏松症模型组和糖尿病模型对照组比较,中药预防组、中药高剂量组、中药低剂量组和西药组大鼠血清瘦素水平下降,差异均有统计学意义(P<0.05)。与正常对照组比较,骨质疏松症模型组、糖尿病模型对照组、中药高剂量组和西药组大鼠骨密度降低,差异均有统计学意义(P<0.05);与骨质疏松症模型组比较,糖尿病模型对照组、中药预防组、中药高剂量组、中药低剂量组和西药组大鼠骨密度升高,差异均有统计学意义(P<0.05);与糖尿病模型对照组比较,中药低剂量组大鼠骨密度升高,差异有统计学意义(P<0.05,见表1)。
2.2 各组大鼠骨组织瘦素mRNA、瘦素表达水平及下丘脑LRb、p-STAT3、p-STAT5表达水平比较 与正常对照组比较,骨质疏松症模型组骨组织瘦素mRNA、瘦素表达水平降低,糖尿病模型对照组、中药预防组、中药高剂量组、中药低剂量组和西药组骨组织瘦素mRNA、瘦素表达水平升高,差异均有统计学意义(P<0.05);与骨质疏松症模型组比较,糖尿病模型对照组、中药预防组、中药高剂量组、中药低剂量组和西药组骨组织瘦素mRNA、瘦素表达水平升高,差异均有统计学意义(P<0.05);与糖尿病模型对照组比较,中药预防组、中药高剂量组、中药低剂量组和西药组骨组织瘦素mRNA、瘦素表达水平下降,差异均有统计学意义(P<0.05);与中药预防组比较,西药组骨组织瘦素mRNA表达水平下降,中药低剂量组和西药组骨组织瘦素表达水平下降,差异均有统计学意义(P<0.05)。
下丘脑LRb阳性细胞位于弓状核、视上核等核团区,细胞膜着色黄褐色。p-STAT3和p-STAT5阳性细胞,细胞核着色棕黄色(见图1~3)。与正常对照组比较,骨质疏松症模型组下丘脑LRb表达水平下降,糖尿病模型对照组、中药预防组、中药高剂量组、中药低剂量组、西药组下丘脑LRb表达水平升高,差异均有统计学意义(P<0.05);与骨质疏松症模型组比较,糖尿病模型对照组、中药预防组、中药高剂量组、中药低剂量组、西药组下丘脑LRb表达水平升高,差异均有统计学意义(P<0.05);与糖尿病模型对照组比较,中药预防组、中药高剂量组、中药低剂量组和西药组下丘脑LRb表达水平下降,差异均有统计学意义(P<0.05);与中药预防组比较,中药高剂量组和西药组下丘脑LRb表达水平下降,差异均有统计学意义(P<0.05)。与正常对照组比较,骨质疏松症模型组、糖尿病模型对照组、中药预防组、中药高剂量组、中药低剂量组、西药组下丘脑p-STAT3、p-STAT5表达水平升高,差异均有统计学意义(P<0.05);与骨质疏松症模型组比较,糖尿病模型对照组、中药预防组、中药高剂量组、中药低剂量组、西药组下丘脑p-STAT3表达水平下降,糖尿病模型对照组下丘脑p-STAT5表达水平升高,中药预防组、中药高剂量组、中药低剂量组、西药组下丘脑p-STAT5表达水平下降,差异均有统计学意义(P<0.05);与糖尿病模型对照组比较,中药预防组、中药高剂量组、中药低剂量组、西药组下丘脑p-STAT3、p-STAT5表达水平下降,差异均有统计学意义(P<0.05);与中药预防组比较,中药高剂量组、中药低剂量组、西药组下丘脑p-STAT3、p-STAT5表达水平升高,差异均有统计学意义(P<0.05,见表2)。
Table 1 Comparison of fasting blood glucose,serum leptin and bone density among different groups of rats
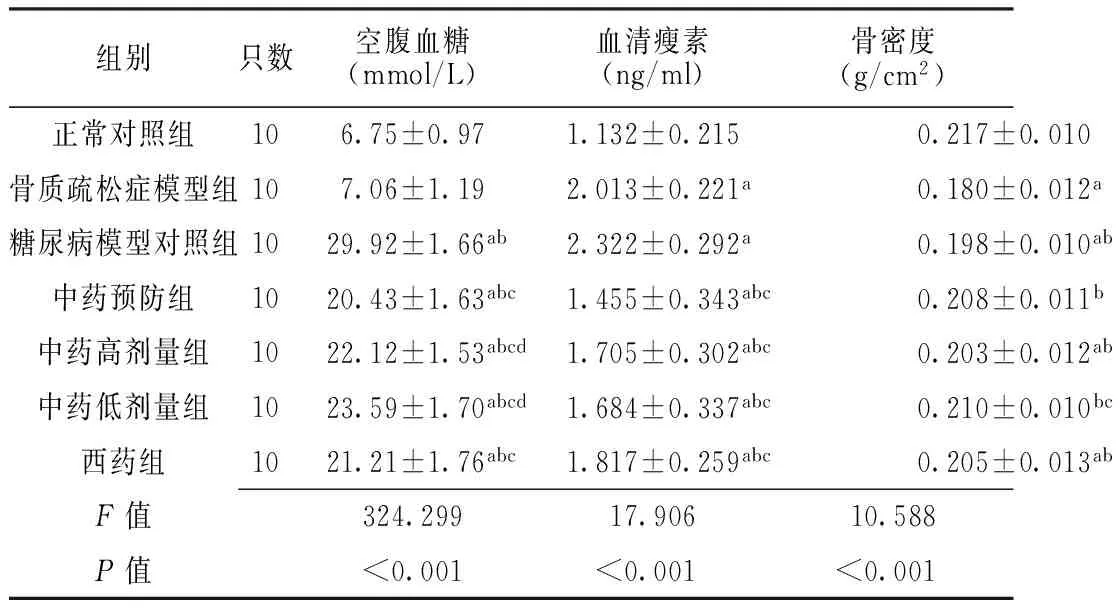
组别只数空腹血糖(mmol/L)血清瘦素(ng/ml)骨密度(g/cm2)正常对照组106.75±0.971.132±0.2150.217±0.010骨质疏松症模型组107.06±1.192.013±0.221a0.180±0.012a糖尿病模型对照组1029.92±1.66ab2.322±0.292a0.198±0.010ab中药预防组1020.43±1.63abc1.455±0.343abc0.208±0.011b中药高剂量组1022.12±1.53abcd1.705±0.302abc0.203±0.012ab中药低剂量组1023.59±1.70abcd1.684±0.337abc0.210±0.010bc西药组1021.21±1.76abc1.817±0.259abc0.205±0.013abF值324.29917.90610.588P值<0.001<0.001<0.001
注:与正常对照组比较,aP<0.05;与骨质疏松症模型组比较,bP<0.05;与糖尿病模型对照组比较,cP<0.05;与中药预防组比较,dP<0.05
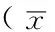
Table 2 Comparison of the expression levels of mRNA and bone tissue leptin and the expression levels of LRb,p-STAT3 and p-STAT5 in hypothalamus among different groups of rats
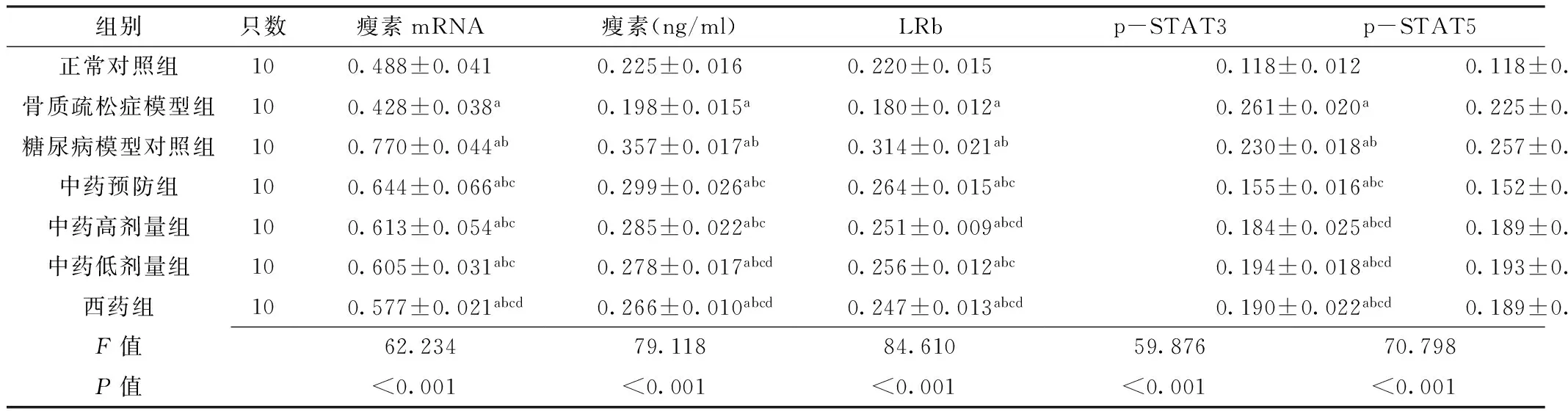
组别只数瘦素mRNA瘦素(ng/ml)LRbp-STAT3p-STAT5正常对照组100.488±0.0410.225±0.0160.220±0.0150.118±0.0120.118±0.012骨质疏松症模型组100.428±0.038a0.198±0.015a0.180±0.012a0.261±0.020a0.225±0.015a糖尿病模型对照组100.770±0.044ab0.357±0.017ab0.314±0.021ab0.230±0.018ab0.257±0.021ab中药预防组100.644±0.066abc0.299±0.026abc0.264±0.015abc0.155±0.016abc0.152±0.016abc中药高剂量组100.613±0.054abc0.285±0.022abc0.251±0.009abcd0.184±0.025abcd0.189±0.022abcd中药低剂量组100.605±0.031abc0.278±0.017abcd0.256±0.012abc0.194±0.018abcd0.193±0.017abcd西药组100.577±0.021abcd0.266±0.010abcd0.247±0.013abcd0.190±0.022abcd0.189±0.046abcdF值62.23479.11884.61059.87670.798P值<0.001<0.001<0.001<0.001<0.001
注:LRb=瘦素长型受体,p-STAT3=磷酸化信号转导与转录激活因子3,p-STAT5=磷酸化信号转导与转录激活因子5;与正常对照组比较,aP<0.05;与骨质疏松症模型组比较,bP<0.05;与糖尿病模型对照组比较,cP<0.05;与中药预防组比较,dP<0.05
3 讨论
目前,2型糖尿病并发骨质疏松症的发病机制尚不十分明确,研究表明,与肥胖、高血糖、胰岛素缺乏、各种血管神经病变引起的氧化应激、炎性因子和激素水平变化相关[8],其中瘦素表达水平升高引起人们的关注。瘦素是由脂肪细胞分泌的肽类激素,主要在白色脂肪组织中表达,而瘦素受体几乎在所有组织中有表达。LRb主要位于下丘脑多个核团区表达神经肽Y的细胞膜上。瘦素与下丘脑的LRb结合后可激活酪氨酸蛋白激酶(JAK)活性,使瘦素受体上的酪氨酸磷酸化,从而激活下游信号转导与转录激活因子(STAT)3和STAT5,STAT3、STAT5 被磷酸化后形成同源或异源二聚体后转移到细胞核内,调控靶基因如c-fos等的表达,最终导致骨细胞功能的改变,抑制骨形成[3,9]。成骨细胞、破骨细胞和软骨细胞均表达瘦素受体,瘦素可作用于骨骼局部刺激骨髓基质细胞向成骨细胞分化,而抑制其向破骨细胞及脂肪细胞分化[10]。由此可知,瘦素与其受体结合在中枢与外周均可发挥其对骨代谢的调节作用。而且瘦素可使神经肽Y 产生减少而抑制食欲,从而减少食物摄入,增加能量消耗,抑制脂肪合成。研究证实了“脂肪-胰岛”内分泌轴的存在[11],通过这一内分泌轴,瘦素和胰岛素之间存在负反馈调节。可见瘦素在糖尿病并发骨质疏松症中发挥一定的作用。
本研究结果显示,糖尿病模型对照组大鼠伴随血糖水平的升高出现血清瘦素水平升高,骨密度下降,骨组织瘦素mRNA和瘦素表达水平升高,下丘脑LRb上调,p-STAT3和p-STAT5表达水平升高,表明2型糖尿病大鼠并发骨质疏松症同时发生瘦素抵抗,机体内源性瘦素不能有效地发挥其生物学效应。Ritchie 等[12]研究发现,经过4周高脂膳食,雌性SD大鼠骨骼肌瘦素水平上升,瘦素敏感性下降,本研究结果与其一致。本研究中,骨质疏松症模型组大鼠与正常对照组相比,血糖水平无明显变化,骨密度下降,而血清瘦素水平上升,骨组织瘦素mRNA和瘦素表达水平下降,下丘脑LRb下调,p-STAT3和p-STAT5表达水平升高,提示雌激素对于维持骨代谢稳定是必需的,也进一步说明瘦素参与骨代谢的调节。
糖尿病并发骨质疏松症属于祖国医学中“消渴”合并“骨痿”,消渴日久,肾精亏虚,发为骨痿。中华中医药学会糖尿病分会在《糖尿病合并骨质疏松症中医诊疗标准》[13]中将其分为肝肾亏损证、阴阳两虚证、气滞血瘀证3型。三黄糖肾康是由多味中药构成的验方,具有补肾通络,活血化瘀,益气养阴等功效。经三黄糖肾康治疗后的大鼠(中药预防组、中药高剂量组、中药低剂量组)血糖和血清瘦素水平下降。由此推测三黄糖肾康可发挥中药降糖作用,减轻瘦素抵抗,提高瘦素敏感性,负反馈地促进胰岛素的分泌。与糖尿病模型对照组大鼠比较,中药高剂量组、中药低剂量组大鼠骨组织瘦素mRNA和瘦素表达水平下降,而下丘脑LRb、p-STAT3和p-STAT5表达水平亦下降。据此推测,在骨组织,三黄糖肾康提高瘦素敏感性,从而促进成骨细胞的分化,延缓骨质疏松症的发生。在下丘脑,三黄糖肾康通过下调下丘脑瘦素受体的表达,抑制瘦素与其受体结合,从而减少信号通路下游p-STAT3和p-STAT5表达水平。与中药高剂量组和中药低剂量组比较,中药预防组大鼠血糖水平下降,下丘脑p-STAT3和p-STAT5表达水平下降,说明早期进行三黄糖肾康干预,可对2型糖尿病并发骨质疏松症发挥防治作用。
综上所述,糖尿病并发骨质疏松症的发病机制复杂,可能与瘦素抵抗相关。本研究在瘦素及其受体介导的信号通路中所测定的蛋白及相关细胞因子较少,故瘦素在糖尿病并发骨质疏松症发生发展中具体的分子作用机制还需要进一步研究。三黄糖肾康可能通过改善外周瘦素抵抗,提高瘦素敏感性,同时抑制瘦素通过JAK-STAT信号转导通路发挥的对骨代谢的负性中枢影响,从而对2型糖尿病并发骨质疏松症发挥防治作用。
利益冲突声明:本课题未涉及任何厂家及相关雇主或其他经济组织直接或间接的经济或利益的赞助。无利益冲突。
伦理要求:实验大鼠符合动物福利和伦理,实验方案获医院伦理委员会批准。
[1]Fang MZ.The research progress in relationship between leptin and diabetic osteoporosis[J].Medical Recapitulate,2011,17(2):275-277.(in Chinese) 方妙贞.瘦素与糖尿病相关性骨质疏松的研究进展[J].医学综述,2011,17(2):275-277.
[2]Zhang S,Zhang Q,Zhang L,et al.Expression of ghrelin and leptin during the development of type 2 diabetes mellitus in a rat model[J].Mol Med Rep,2012,7(1):223-228.
[3]Di CX,Wang ZJ.Recent progress of leptin and bone metabolism[J].Int J Endocrinal Metab,2012,32(3):200-202.(in Chinese) 邸彩霞,王战建.瘦素与骨代谢研究进展[J].国际内分泌代谢杂志,2012,32(3):200-202.
[4]de Queiroz KB,Guimarães JB,Coimbra CC,et al.Endurance training increases leptin expression in the retroperitoneal adipose tissue of rats fed with a high-sugar diet[J].Lipids,2014,49 (1):85-96.
[5]Karsenty G,Ferron M.The contribution of bone to whole-organism physiology[J].Nature,2012,481(7381):314-320.
[6]奚悦.三黄糖肾康对早期DN大鼠微炎症状态影响的实验研究及临床疗效观察[D].沈阳:辽宁中医药大学,2013.
[7]You TT,Wu T,Zhang ZP,et al.Rat model of diabetes mellitus combined with osteoporosis established by intralipid and small-dose streptozotocin[J].Chinese Journal of Clinical Rehabilitation,2006,10(24):106-107.(in Chinese) 尤婷婷,吴铁,张志平,等.高脂饲料与小剂量链脲佐菌素建立糖尿病合并骨质疏松的大鼠模型[J].中国临床康复,2006,10(24):106-107.
[8]Ruan Y,Ma JH.The progress on relationship between osteoporosis and type 2 diabetes mellitus[J].Progress in Modern Biomedicine,2011,11(23):4778-4779.(in Chinese) 阮园,马建华.2 型糖尿病与骨质疏松相关因素研究进展[J].现代生物医学进展,2011,11(23):4778-4779.
[9]Ladyman SR,Grattan DR.JAK-STAT and feeding[J].JAKSTAT,2013,2(2):e23675.
[10]Turner RT,Kalra SP,Wong CP,et al.Peripheral leptin regulates bone formation[J].J Bone Miner Res,2013,28(1):22-34.
[11]Yadava A,Katariaa MA,Saini V,et al.Role of leptin and adiponectin in insulin resistance[J].Clin Chim Acta,2013,417:80-84.
[12]Ritchie IR,Gulli RA,Stefank LE,et al.Restoration of skeletal muscle leptin response does not precede the exercise-induced recovery of insulin-stimulated glucose uptake in high-fat-fed rats[J].Am J Physiol Regul Integr Comp Physiol,2011,300(2):R492-500.
[13]中华中医药学会糖尿病分会.糖尿病合并骨质疏松中医诊疗标准[J].世界中西医结合杂志,2011,6(3):265-269.
(本文编辑:陈素芳)
Effects of Sanhuangtangshenkang on the Expression of Leptin in Rats With Type 2 Diabetes Mellitus Complicated With Osteoporosis
WANGJing-yi,XIYue.
TheThirdAffiliatedHospitalofLiaoningMedicalUniversity,Jinzhou121000,China
Objective To explore the effects of Sanhuangtangshenkang on the expression of leptin in rats with type 2 diabetes mellitus complicated with osteoporosis.Methods Female Wistar rats were taken as the study subjects from June 2013 to November 2014.Assigned 10 rats into normal control group,10 rats into osteoporosis model group and 50 rats into diabetes model group.The diabetes model group was further divided into diabetes model control group,TCM prevention group,high-dose TCM group,low-dose TCM group and western medicine group,with 10 rats each group.After the corresponding intervention for 20 weeks,samples were taken and tested to determine fasting blood glucose (FBG),the expression of serum leptin,bone density,the mRNA and expression of bone tissue leptin,the expression of leptin receptor(LRb),p-STAT3 and p-STAT5 in hypothalamus.Results TCM prevention group,high-dose TCM group,low-dose TCM group and western medicine group were higher (P<0.05) than normal control group and osteoporosis model group and were lower (P<0.05) than diabetes model control group in FBG,the mRNA and expression of bone tissue leptin and the expression of LRb in hypothalamus; TCM prevention group,high-dose TCM group,low-dose TCM group and western medicine group were higher (P<0.05) than normal control group and were lower (P<0.05) than osteoporosis model group and diabetes model control group in the expression level of serum leptin and the expression levels of p-STAT3 and p-STAT5 in hypothalamus; TCM prevention group,high-dose TCM group,low-dose TCM group and western medicine group were higher (P<0.05) than osteoporosis model group in bone density.Conclusion Sanhuangtangshenkang can probably directly or indirectly regulate the effect of leptin on bone metabolism by improving leptin resistance,thus being effective in the treatment of type 2 diabetes mellitus complicated with osteoporosis rats.
Diabetes mellitus;Osteoporosis;Leptin;Rats;Sanhuangtangshenkang
辽宁省自然科学基金资助项目(201202147)
121000 辽宁省锦州市,辽宁医学院附属第三医院
奚悦,121000 辽宁省锦州市,辽宁医学院附属第三医院;E-mail:xiyue-ln@163.com
R 587.1 R 681.4
A
10.3969/j.issn.1007-9572.2015.24.019
2015-02-14;
2015-06-04)

