重组人粒细胞集落刺激因子对脑出血大鼠神经功能及外周血CD34+细胞、脑组织MAP-2的影响
冯春国
(山东省垦利县人民医院 重症医学科, 山东 垦利, 257500)
重组人粒细胞集落刺激因子对脑出血大鼠神经功能及外周血CD34+细胞、脑组织MAP-2的影响
冯春国
(山东省垦利县人民医院 重症医学科, 山东 垦利, 257500)
摘要:目的探讨重组人粒细胞集落刺激因子(rhG-CSF)对脑出血大鼠神经功能外周血CD34+细胞及脑组织中组织微管相关蛋白-2(MAP-2)的影响。方法将36只雄性Wistar大鼠随机分为假手术组、模型组和rhG-CSF组。后2组采用注射自体不凝血法建立脑出血模型。术后rhG-CSF组皮下注射rhG-CSF 60 μg/(kg·d), 共8 d。模型组与假手术组皮下注射等量生理盐水, 1次/d, 共8 d。结果术后1 d, rhG-CSF组和模型组均有不同程度神经功能缺损,NSS评分无显著差别(P>0.05), rhG-CSF组术后4、8 d均较前一时间点显著改善(P<0.01), 且评分显著低于模型组(P<0.01), 显著高于假手术组(P<0.01)。术后4 d, rhG-CSF组与模型组动员的外周血CD34+含量显著升高(P<0.05或P<0.01), 术后8 d, rhG-CSF组与模型组大鼠外周血CD34+含量均均较术后4 d时显著下降(P<0.05); 术后4、8 d时组间比较,3组间均有统计学差异(P<0.05或P<0.01)。术后8 d, 假手术组MAP-2蛋白表达量最高,模型组最低,rhG-CSF组显著高于模型组,但仍低于假手术组(P<0.05或P<0.01)。结论rhG-CSF可促进脑出血区神经元的增生和修复,增加外周血CD34+细胞含量,改善脑出血后神经功能。
关键词:重组人粒细胞集落刺激因子; 脑出血; 神经功能; CD34+细胞; 组织微管相关蛋白-2
脑出血是指非外伤性脑动脉、静脉及各毛细血管自发破裂引起的脑内出血,又称自发性脑出血,其发病率、致残率及死亡率高,临床发生率占全部脑卒中的35%[1]。传统治疗降低了脑出血病死率,而致残率却未得改善。目前,干细胞移植治疗坏死脑神经元,恢复损伤的神经元功能已取得一定疗效。重组人粒细胞集落刺激因子(rhG-CSF)可动员内源性骨髓基质干细胞(BMSC)释放至外周血中,介导受损神经细胞再生[2]。CD34抗原选择性地表达于人类及其他哺乳动物造血干细胞表面,增强造血干细胞的定植,促进造血干细胞的植入、造血功能恢复以及免疫功能重建。微管相关蛋白-2(MAP-2)是一种神经元骨架蛋白,参与神经元的生长和损伤后修复过程,是表达成熟的神经元标志物[3]。本研究主要观察了rhG-CSF对脑出血大鼠的神经功能、外周血CD34+细胞及脑组织MAP-2的影响,现报告如下。
1材料与方法
1.1 实验动物
SPF级雄性Wistar大鼠36只,10~12周龄,体质量200~250 g, 由山东省实验动物中心提供,合格证号SCXK(鲁)20130004。
1.2 药物与试剂
rhG-CSF注射液购自山东齐鲁制药有限公司,国药准字S20063065。鼠源CD34单克隆抗体购自美国SantaCruz公司。MAP-2多克隆抗体购自美国Sigma公司。SABC免疫组化染色试剂盒和DAB显色试剂盒购自武汉博士德生物工程有限公司。
1.3 方法
1.3.1分组、脑出血模型建立及给药方法: 36只SD大鼠随机分为假手术组、模型组和rhG-CSF组,每组12只。以10%水合氯醛按3 mL/kg腹腔注射麻醉。模型组和rhG-CSF组采用自体血注入法制备脑出血模型[4]。立体定向仪固定,头部正中纵形切口,暴露前囟和冠状缝,冠状缝前0.2 mm、中缝向右旁开0.4 cm处开颅骨至硬脑膜。取0.1 mL尾动脉血,将头皮针刺入脑内,进针深度为6 mm。将75 μL自体不凝血(肝素抗凝)缓慢注入基底节区,留针10 min后缓慢拔针。造模后根据Berderson等[5]方法进行模型评价,抗侧方推力减弱伴爬行时向对侧划圈,或意识丧失不能行走说明大鼠脑出血模型建立成功。术后1 h开始给药, rhG-CSF组皮下注射rhG-CSF 60 μg/(kg·d), 共8 d。模型组和假手术组皮下注射等量生理盐水, 1次/d,共8 d。
1.3.2神经行为学评价:以神经功能缺损评分(NSS)评价大鼠神经功能缺损情况: 0分,神经功能正常; 1分,轻度,即提尾时左前肢屈曲; 2分,中度,即行走时向左侧转圈; 3分,中度,向左侧倾斜; 4分,无自发行走,意识减退; 5分,与缺血有关的死亡。评分越高表明神经功能缺损越严重。
1.3.3外周血CD34+细胞含量检测:治疗第1、4、8天,麻醉大鼠,腹主动脉取血1 mL,使用溶血素裂解红细胞, 1 500转/min, 离心半径3.5 cm, 离心5 min后弃上清,加入PBS制成有核细胞悬液,使用CD34+单抗标记并用流式细胞仪进行计数。细胞含量用CD34+细胞占外周血白细胞百分比表示。
1.3.4MAP-2含量检测:采用免疫组织化学法检测,术后第8天,神经功能缺损评分及腹主动脉取血后,大鼠以4 ℃ 40 g/L多聚甲醛溶液经左心室至主动脉灌注,然后取距离前额2 mm至视交叉处部位剥取鼠脑,脱水,石蜡包埋。脑组织石蜡切片常规脱蜡水化。采用SABC法行免疫组化染色检测MAP-2阳性细胞。每例标本取4张片子,在400倍视野下每张片子上在出血病灶区随机取5个视野, Image-Pro Plus 5.0软件进行图像分析平均吸光度值。
1.4 观察指标
观察3组手术后1、4、8 d的NSS评分和外周血CD34+细胞含量,以及术后8 d各组MAP-2蛋白表达水平。
2结果
2.1 各组NSS评分比较
假手术组未出现神经功能缺损情况, rhG-CSF组和模型组均有不同程度神经功能缺损,表明脑出血模型建立成功。模型组术后各时间点评分无显著改善, rhG-CSF组术后4、8 d均较前一时间点显著改善(P<0.01)。术后1 d, rhG-CSF组和模型组评分无显著差别(P>0.05), 但均高于假手术组(P<0.01); 术后4 d和8 d时rhG-CSF组评分显著低于模型组(P<0.01), 显著高于假手术组(P<0.01)。见表1。
2.2 各组外周血CD34+细胞含量比较
术后1 d时,各组CD34+细胞含量无显著差异(P>0.05)。术后4 d时,假手术组无显著变化, rhG-CSF组与模型组动员的外周血CD34+含量显著升高(P<0.05或P<0.01); 术后8 d, rhG-CSF组与模型组大鼠外周血CD34+含量均较术后4 d时显著下降,差异有统计学意义(P<0.05)。术后4、8 d时组间比较, 3组比较有显著差异(P<0.05或P<0.01)。见表2。
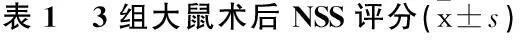

分
与同时期假手术组比较, **P<0.01; 与同时期模型组比较, ##P<0.01; 与本组前一时刻比较, △△P<0.01。
表2 3 组大鼠术后外周血CD34+细胞含量 %

表2 3 组大鼠术后外周血CD34+细胞含量 %
组别例数术后1d术后4d术后8d假手术组120.16±0.050.15±0.070.15±0.06模型组120.16±0.040.29±0.16*△0.19±0.01*△rhG-CSF组120.15±0.060.58±0.16**##△△0.42±0.14**##△
与同时期假手术组比较, *P<0.05, **P<0.01; 与同时期模型组比较, ##P<0.01;
与本组前一时间点比较,△P<0.05, △△P<0.01。
2.3 各组MAP-2蛋白表达水平
术后8 d,假手术组免疫组化染色结果显示染色强,排列整齐均匀,形态规则。rhG-CSF组出血灶周边则染色均匀,形态较规则,突起排列呈束状,这意味着神经轴突和树突增生活跃。模型组出血灶周边有少量MAP-2表达,染色程度较低,排列稀疏。见图1。
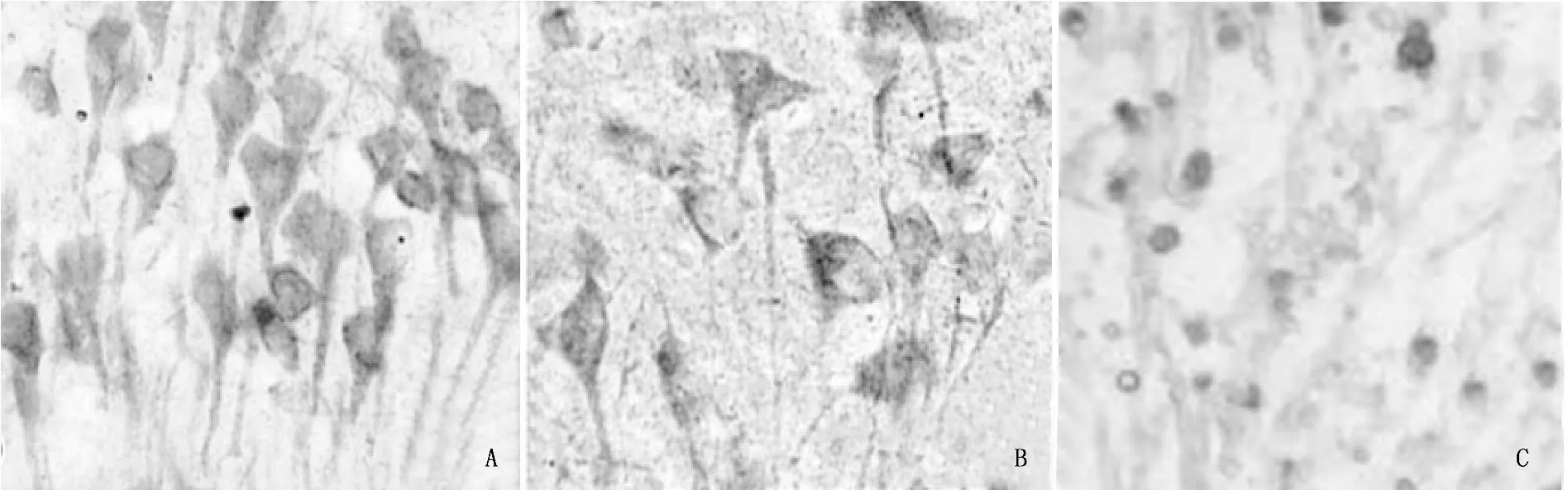
A. 假手术组; B: rhG-CSF组; C. 模型组
图1神经元MAP-2免疫组化染色结果
假手术组、rhG-CSF组和模型组MAP-2蛋白表达量分别为(0.33±0.18)、(0.21±0.05)、(0.13±0.09),两两比较,差异有统计学意义(P<0.05或P<0.01)。
3讨论
脑出血可导致神经功能受损,如何减轻神经功能损伤,是目前脑出血研究的重点[6]。越来越多的证据[7]表明,高度分化的脑神经细胞是可再生的,脑出血可诱导内源性干细胞的增殖分化,但数量极少,自身修复能力有限。rhG-CSF可动员自身BMSC迁移到受损的脑组织区域,重塑受损神经元,是一种新兴干细胞移植疗法[8-9]。研究[10]显示大鼠皮下注射rhG-CSF动员BMSC, 可加速损伤血管段的内皮再生,动员BMSC归巢至脑缺血损伤区,免疫染色证实BMSC可分化成胶质细胞以及神经元细胞等, MRI检查可见病灶明显缩小。本研究用发现rhG-CSF组给药后NSS评分逐渐降低,且低于同时间点模型组(P<0.01), 表明rhG-CSF可有效改善脑出血大鼠神经功能。
CD34抗原选择性地表达于哺乳动物造血干细胞表面,是造血干细胞的表面标志,检测外周血CD34+细胞含量可反映外周血干细胞的含量[11-12]。Ponte[13]研究表明G-CSF可促进基质金属蛋白酶-2依赖性CD34+细胞的迁移。有研究表明急性脑缺血后神经功能的修复程度与外周血CD34+细胞的水平呈正相关[14]。本研究中,尽管rhG-CSF组术后8 d外周血CD34+细胞较术后4 d有所下降,提示rhG-CSF可有效促进CD34+细胞迁移,加快神经功能修复。
MAP-2是主要表达于神经元树突及胞体内微管,参与神经元的生长和修复过程,是成熟神经元的标志性蛋白。MAP-2在缺血中心几乎无丧失,而在完整的神经元和缺血半暗带则会表达升高。本研究免疫组化结果显示模型组MAP-2表达最低,rhG-CSF组出血灶周边则染色均匀,形态较规则,突起排列呈束状, MAP-2蛋白表达显著高于同时间点模型组,这意味着rhG-CSF可有效促进神经树突和胞体增生。
综上所述, hG-CSF治疗急性脑出血大鼠可动员BMSC归巢至出血部位,参与损伤脑缺血组织部位神经元修复及功能恢复,与夏明武等[15]报道基本一致,为临床应用hG-CSF治疗脑出血提供了依据。
参考文献
[1]Zhang LF, Yang J, Hong Z, et al. Proportion ofdifferent subtypes ofstroke in China[J]. Stroke, 2003, 34(9): 2091.
[2]戴杰, 陈蓝, 黄志东, 等. 骨髓间质干细胞移植治疗大鼠脑出血模型的实验研究[J]. 现代生物医学进展, 2011, 11(21):4030.
[3]Mondello S, Gabrielli A, Catani S, et al. Increased levels of serum MAP-2 at 6-months correlate with improved outcome in survivors of severe traumatic brain injury[J]. Brain Inj, 2012, 26(13-14): 1629.
[4]张昊, 马晓依, 吕妍, 等. 大鼠脑出血模型[J]. 中国医药指南, 2012, 10(34): 89.
[5]孙建军, 刘勇, 张蓬勃, 等. 大鼠脑出血后行为学改变和室管膜下区细胞增殖规律[J]. 中南大学学报: 医学版, 2009, 34(3): 236.
[6]Cao H, Ju K, Zhong L, et al. Efficacy of hyperbaric oxygen treatment for depression in the convalescent stage followingcerebral hemorrhage[J]. ExpTher Med, 2013, 5(6): 1609.
[7]Riquelme P A, Drapeau E, Doetsch F. Philos Trans R Soc Lond B[J]. Biol Sci, 2008, 363(1489): 123.
[8]Xia J, Luo M, Ni N, et al. Bone marrow mesenchymal stemcellsstimulate proliferation andneuronaldifferentiationof retinal progenitorcells[J]. PLoS One, 2013, 8(9): e76157.
[9]谭位华, 张慧利. G-CSF对脑复苏的最新进展[J]. 江西医药, 2009, 14(11): 1145.
[10]吴俊, 陈绍良, 刘志忠, 等. 重组人粒细胞集落刺激因子修复大鼠动脉损伤[J]. 中国组织工程研究与临床康复, 2007, 11(23): 4630.
[11]Clevers H. The cancer stem cell: premises, promises and challenges[J]. Nature medicine, 2011, 17(3): 313.
[12]Anjos-Afonso F, Currie E, Palmer H G, et al. CD34-Cells at the apex of the human hematopoietic stem cell hierarchy have distinctive cellular and molecular signatures[J]. Cell Stem Cell, 2013, 13(2): 161.
[13]Ponte AL, Ribeiro-Fleury T, Chabot V, et al. Granulocyte-colony-stimulating factorstimulation of bone marrowmesenchymal stromal cellspromotes CD34+cell migration via a matrix metalloproteinase-2-dependent mechanism[J]. StemCellsDev, 2012, 21(17): 3162.
[14]Hirano K, Wagner K, Mark P, et al. Erythropoietin attenuates the sequels of ischaemic spinal cord injury with enhanced recruitment of CD34+cellsin mice[J]. J Cell Mol Med, 2012, 16(8): 1792.
[15]夏明武, 赵昊, 郭茜, 等. 重组人粒细胞集落刺激因子对脑出血大鼠神经功能的影响[J]. 中华神经医学杂志, 2013, 12(9): 891.
Influence of rhG-CSF on the neurological function and peripheral blood CD34+cells and MAP-2 in brain tissues of rats with ICH
FENG Chunguo
(DepartmentofIntensiveMedicine,ThePeople′sHospitalofKenliCounty,Kenli,Shandong, 257500)
ABSTRACT:ObjectiveTo explore the influence of recombinant human granulocyte-colony stimulating factor (rhG-CSF) on the neurological function, peripheral blood CD34+cells and microtubule associated protein-2 (MAP-2) in brain tissues of rats with intracerebral hemorrhage (ICH). MethodsA total of 36 male Wistar rats were randomly divided into sham-operation group, model group and rhG-CSF group. The model group and the rhG-CSF group were established by injecting autologous un-coagulated blood. After operation, subcutaneous injection of rhG-CSF 60 μg/(kg·d) was given to the rhG-CSF group for 8 days. The model group and the sham-operation group were injected subcutaneously with equivalent normal saline, 1 time per day for totally 8 days. ResultsOne day after operation, the rhG-CSF group and the model group had different degrees of neurological functional deficits, but neurological severity score(NSS) showed no significant difference (P>0.05). Four and eight days after operation, the neurological function significantly improved when compared with the previous time point in the rhG-CSF group (P<0.01), and NSS score in the rhG-CSF group was significantly lower than that in the model group (P<0.01), and was significantly higher than that in the sham-operation group (P<0.01). The peripheral blood CD34+cell level increased apparently 4 days after operation in the rhG-CSF group and the model group, and there was significant difference (P<0.05 or P<0.01). Eight days after operation, the peripheral blood CD34+cell level in the rhG-CSF group and the model group decreasedsignificantly when compared with that 4 days after operation(P<0.05).There were significant differences among three groups at each time point (P<0.05 or P<0.01). Eight days after operation, MAP-2 level was the highest in the sham-operation group and the lowest in the model group, which was still significantly lower in the model group and higher in the sham-operation group when compared with the rhG-CSF group (P<0.05 or P<0.01). ConclusionThe rhG-CSF can improve the hyperplasia and repair of neurons, increase peripheral blood CD34+cell level and improve the neurological function after hemorrhage in ICH.
KEYWORDS:recombinant human granulocyte-colony stimulating factor; intracerebral hemorrhage; neurological function; CD34+cells; microtubule associated protein-2
基金项目:中国高校医学期刊临床专项资金(11321453)
收稿日期:2014-12-09
中图分类号:R 722.15
文献标志码:A
文章编号:1672-2353(2015)07-025-04DOI: 10.7619/jcmp.201507006

