中药土贝母活性成分总皂苷的含量测定
朱海鸥,王立新,侯文彬,单 淇,周福军
(1. 天津市第二人民医院,天津 300192; 2. 天津药物研究院,天津 300193)
中药土贝母活性成分总皂苷的含量测定
朱海鸥1,王立新1,侯文彬2*,单 淇2,周福军2
(1. 天津市第二人民医院,天津 300192; 2. 天津药物研究院,天津 300193)
目的:建立土贝母总皂苷的含量测定方法。方法:对比色法测定土贝母总皂苷的各因素进行单因素考查以及正交试验,优化比色条件,确定最佳测定方法。结果:土贝母总皂苷的最佳测定条件为显色剂(5%香草醛-冰醋酸溶液)0.2 ml,高氯酸0.4 ml,70 ℃下反应30 min,立即冰水浴冷却5 min,取出后加入4 ml冰醋酸溶液,再冰水浴冷却10 min,取出室温放置35 min后进行紫外测定。土贝母总皂苷在0.049~0.293 mg范围内线性良好。结论:本法对土贝母总皂苷进行含量测定准确稳定,可作为评价土贝母药材以及土贝母皂苷原料药和制剂的重要质量控制方法之一。
土贝母,总皂苷,比色法,含量测定
疣病是一种病毒性皮肤病,是由病毒引起的一种皮肤表面赘生物,多见于儿童及青少年,常见的有寻常疣、扁平疣、尖锐湿疣、传染性软疣等。前三者是由乳头瘤病毒引起,后者是由传染性软疣病毒引起。疣病好发于面部、手背部等暴露部位,有一定传染性,给身边亲人的身心健康带来巨大的威胁。土贝母为葫芦科植物土贝母[Bolbostemmapaniculatum(Maxim)Franquet]的干燥块茎,味苦,性微寒,归肺、脾经,有散结、消肿、解毒之功。土贝母水煎液对各种疣类疾病均取得满意的治疗效果。现代药理学研究发现其皂苷成分具有很好的抗病毒作用[1],抗病毒谱主要包括乳头多瘤空泡病毒中人疣病毒、痘病毒中传染性软疣病毒和HSV-1[2]。因此,土贝母对各种疣病都有很好的疗效,目前大多用于医院内部制剂[3]。本文拟制定土贝母总皂苷的质量控制方法,作为评价土贝母药材以及土贝母皂苷原料药和制剂的质量控制方法。
1 仪器与试药
香草醛(天津市清华津英科技有限公司,分析纯),冰醋酸(天津市凯信化学工业有限公司,分析纯),高氯酸(天津化学试剂二厂,分析纯)。UV-1601紫外-可见分光光度仪(日本岛津公司),恒温水浴锅(天津泰斯特仪器有限公司)。土贝母药材(购自河北省安国市药材市场,经天津药物研究院侯文彬研究员鉴定),土贝母苷甲对照品(中国药品生物制品检定所,批号1536-200001 )。
2 方法与结果
2.1 溶液的配制
2.1.1 对照品溶液的配制 精密称取土贝母苷甲标准品加甲醇定容制成每1 ml含约1 mg的标准品溶液。
2.1.2 供试品溶液的配制 取土贝母药材粗粉2.5 kg,以 60%的乙醇20倍体积(8∶6∶6),提取3次,每次1.5 h,浓缩药液后以0.2 g/ml的药材浓度上样于处理好的NKA-9树脂(体积约为4 L),以7 BV水洗脱除杂后,再用3 BV的95%乙醇洗脱即得到土贝母总皂苷,上样、洗脱流速为3 BV/h,制得土贝母总皂苷样品。精密称取土贝母总皂苷样品加甲醇定容制成每1 ml含0.5 mg的供试品溶液。
2.2 最大吸收波长的确定 分别吸取标准溶液和供试品溶液适量,至具塞试管中,挥干溶剂,各加入0.2 ml 5%香草醛-冰醋酸溶液和0.1 ml高氯酸,摇匀于70 ℃水浴下反应20 min,取出冰浴1 min中止反应,精密加入冰醋酸4 ml,摇匀后冷却10 min,于400~800 nm波长下进行扫描,在472 nm波长下出现最大吸收,选取472 nm为测定波长。
2.3 显色条件的选择
2.3.1 香草醛浓度的考查 精密吸取土贝母苷甲标准溶液0.5 ml,分别置10 ml具塞试管中,精密加入新配制的不同浓度香草醛-冰醋酸溶液0.2 ml和高氯酸溶液0.1 ml,摇匀,密塞,置70 ℃水浴中加热20 min,取出,立即放入冷水中冷却1 min,精密加入冰醋酸4 ml,摇匀,继续冷却10 min,以试剂作空白,在472 nm下测定吸收度,结果当香草醛浓度大于5%后,吸光值变化不大,所以本实验选择5%浓度的香草醛-冰醋酸溶液作为显色剂。
2.3.2 显色反应稳定性的考查 取0.5 ml土贝母苷甲标准溶液,按上述方法显色反应后,进行紫外检测,每隔5 min记录一下吸光值。结果在显色反应结束后,室温下放置35 min后,吸光值变化幅度较小,趋于稳定。
2.3.3 最佳反应温度的选择 吸取0.5 ml甲醇溶液于具塞试管中挥干后,按上述方法分别在60、70、80和90 ℃不同温度下进行显色反应,观察空白溶液的吸收值。结果当温度超过70 ℃以后,空白溶液的吸光值增加明显,对实验数据干扰增大,本实验选择70 ℃作为显色反应的反应温度。
2.3.4 比色条件的优化 考虑显色剂与高氯酸用量之间可能存在交互作用,本实验选择以香草醛-冰醋酸溶液体积、高氯酸体积、交互作用项、加热时间、中止反应时间为考查因素,每个因素下选择3个水平进行正交试验设计,做一L18(37)正交表(见表1),分别精密吸取土贝母苷甲标准溶液0.2 ml,结果如表2和表3。

表1 比色条件优化正交设计表
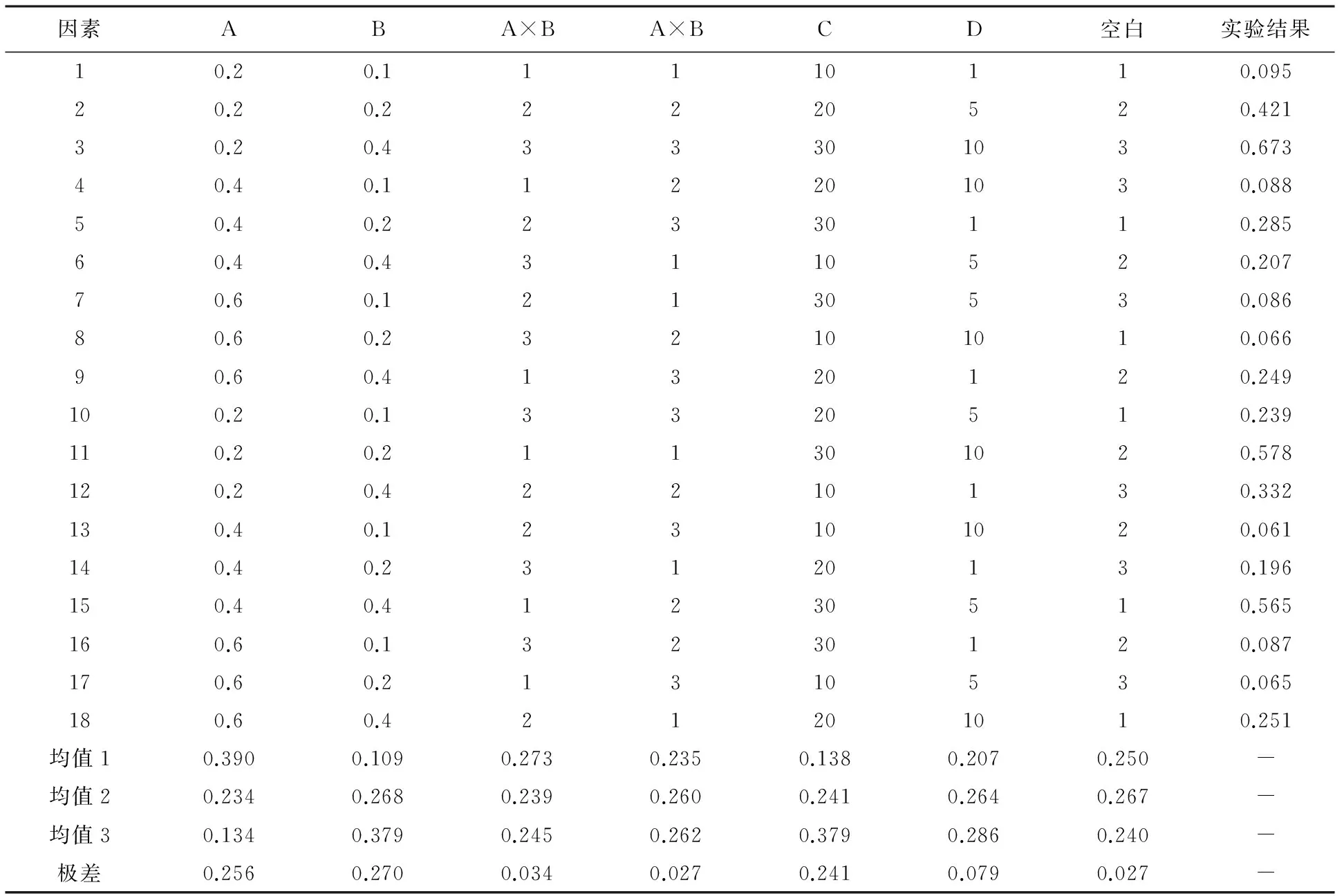
表2 比色条件优化数据表

表3 方差分析数据表
*表示P<0.05
对正交试验数据进行方差分析,只有显色剂体积、高氯酸体积和加热时间具有显著性差异。由直观分析可知,三者的主次顺序为B(高氯酸体积)>A(显色剂体积)>C(加热时间),再由分析结果的均值大小可确定优化实验条件为:B3A1C3D2, 即显色剂(5%香草醛-冰醋酸溶液)0.2 ml,高氯酸0.4 ml,70 ℃下反应30 min,立即冰水浴冷却5 min,取出后加入4 ml冰醋酸溶液,再冰水浴冷却10 min,取出室温放置35 min,进行紫外测定。
2.4 标准曲线的绘制 分别精密吸取苷甲标准溶液0.05、0.10、0.15、0.20、0.25和0.30 ml至6支具塞试管中挥干溶剂,按照正交试验优选比色条件进行显色反应,以土贝母苷甲量与吸光度进行回归,回归方程为Y=2.882 1X+ 0.116(r=0.999 5)。表明土贝母苷甲在0.049~0.293 mg范围内线性良好。
2.5 精密度试验 分别精密吸取土贝母苷甲标准溶液0.2 ml,按照测定方法显色后连续测定6次,RSD为0.12%, 仪器精密度良好。
2.6 重复性试验 精密称取对照品并定容配成6份标准样品溶液,各吸取0.2 ml至6个具塞试管中,同“2.4”项下方法显色,于472 nm处测定A值,测得A值平均为0.684,RSD为1.9%(n=6)。
2.7 加样回收率试验 采用加样回收法,精密吸取供试品溶液0.2 ml于9支具塞试管中,分别精密加入对照品溶液约相当于样品总皂苷量的80%、100%和120%,各3份,按照测定方法进行测定,计算平均回收率为98.16%,RSD为1.9%,结果见表4。

表4 加样回收率试验结果
3 讨论
3.1 香草醛-高氯酸常用作三萜皂苷的显色剂。本实验在优化香草醛-高氯酸比色条件时考虑到显色剂与高氯酸的用量之间可能存在的交互作用,做一L18(37)正交设计,实验结果发现交互作用项无显著性差异,即显色剂与高氯酸在用量比例上没有内在联系,这也证实了显色反应是分步进行的,其显色原理可能是皂苷在强氧化性酸的作用下脱氢,氧化后再与香草醛加成[4]。显色后,香草醛-高氯酸能与皂苷反应形成特征的紫红色。因为某些糖也具易被氧化脱氢的性质,可能对此种含量测定方法存在一定干扰,以致常常出现实测值偏大的现象,所以要求在制备总皂苷样品的工艺中进行水洗脱除糖的操作,以尽量避免糖类物质对显色反应的干扰。
3.2 显色反应对于加热时间和温度的变化比较灵敏,操作中应严格控制加热时间和温度,且待显色样品需挥干溶剂后加入显色剂,否则对显色效果影响较大。5%香草醛-冰醋酸溶液应现用现配,放置时间过久会出现空白溶液吸光值加大的现象,干扰实验结果。
1 傅章才,赵更生,房益蓝,等.土贝母皂苷的药理学研究[J].陕西新医药,1985,14(4):49-53
2 张晓辉,孙乃学,王峰,等.单纯疱疹病毒性角膜炎土贝母皂甙点眼的浓度筛选与刺激性评价[J].西安交通大学学报,2003, 24(1):63-66
3 纪家贵.解毒消疣汤治疗传染性软疣36例[J].河南中医,2001, 21(4):43-44
4 兰霞,王洪新.比色法测定甘草中总皂苷的含量[J].时珍国医国药,2007,18(4):886-887
Deter mination of total tubeimosides inBolbostemmapaniculatum
Zhu Haiou1,Wang Lixin1,Hou Wenbin2,Shan Qi2,Zhou Fujun2
(1.Tianjin Second People’s Hospital,Tianjn,300192;2.Tianjin Institute of Pharmaceutical research, Tianjin 300193)
Objective:To establish an analysis method for the quantitative deter mination of total tubeimosides . Methods:The factors affecting the deter mination of total tubeimosides were researched by the single factor exploration and orthogonal design.The most appropriate one was selected and the method was optimized subsequently.Results:Total tubeimosides was well determined with 5% vanilin- glacial acid solution(0.2 ml) and perchloric acid(0.4 ml) as developer and 30 minutes at 70 ℃.The sample was cooled with ice -water bath for 5 min,taken out and added with 4 ml of acetic acid and cooled for 10 min again.The sample was UV detected following being cooled for 35 min at ambient temperature. Total tubeimosides was in good linearity between 0.049 mg and 0.293 mg. Conclution: This quantitative deter mination method for total tubeimosides is accurate and stable.It can be used for a main quality control of Bolbostemma paniculatum and total tubeimosides.
Bolbostemmapaniculatum,total tubeimosides,colorimetry,deter mination
2015-01-19
R927.2
A
1006-5687(2015)04-0014-03
*通讯作者:侯文彬,E-mail:hou-zhang@126.com。

