顶空气相色谱法测定甲磺酸加雷沙星中的甲磺酸乙酯残留
张奕恂,韦永爱,王 华,郭 瑾,梅 超,罗 刚,王志凤
(1.天津华津制药有限公司,天津 300241; 2.天津市汉康医药生物技术有限公司,天津 300409)
顶空气相色谱法测定甲磺酸加雷沙星中的甲磺酸乙酯残留
张奕恂1,韦永爱2,王 华2,郭 瑾2,梅 超2,罗 刚2,王志凤2
(1.天津华津制药有限公司,天津 300241; 2.天津市汉康医药生物技术有限公司,天津 300409)
目的:建立甲磺酸加雷沙星中甲磺酸乙酯的气相色谱检测方法。 方法:色谱系统采用AT-1000(30 m×0.53 mm,1 μm)气相色谱柱,ECD检测器,分流比为20∶1。结果:甲磺酸乙酯在37.56~338.04 ng/ml范围内线性关系良好(r=0.999 4),平均回收率为99.5%,最低检测浓度为2.5 ng/ml。结论:该方法简便、准确、重现性好且专属性强。
气相色谱法,甲磺酸加雷沙星,甲磺酸乙酯
甲磺酸加雷沙星一水合物是一种新的脱氟(6)喹诺酮类抗菌药,化学名为:1-环丙基-8-(二氟甲氧基)-7-[(1R)-2,3-二氢-1-甲基-1H-异吲哚-5-基]-1,4-二氢-4-氧代-3-喹啉甲酸甲磺酸盐一水合物,由富山化学公司与大正制药共同研发,于2007年10月首次在日本上市,商品名为GENINAX○R。甲磺酸加雷沙星主要作用于细菌DNA螺旋酶和DNA拓扑异构酶Ⅳ,从而抑制DNA的转录和复制,对引起呼吸系统和耳鼻喉感染的金黄色葡萄球菌、肺炎链球菌、流感嗜血杆菌、卡他莫拉菌有较强的抗菌活性,对非致病菌,如肺炎支原体和肺炎衣原体的抗菌活性也较好[1,2],临床上用于治疗咽炎、喉炎、扁桃体炎、急性支气管炎等呼吸系统和耳鼻喉科系统感染。甲磺酸加雷沙星中的杂质甲磺酸乙酯具有遗传毒性,对于其分析方法尚未见有文献报道,本文通过建立气相色谱法测定甲磺酸加雷沙星中的甲磺酸乙酯,对甲磺酸加雷沙星进行质量控制。
1 仪器与试药
GC2010气相色谱仪,由日本岛津公司生产;ECD检测器,由日本岛津公司生产;梅特勒AE 100 电子天平;AT-1000(酸改性聚乙二醇20 M毛细管色谱柱(30 m×0.53 mm,1 μm)。甲磺酸乙酯(百灵威科技有限公司,批号10169291); 无水硫代硫酸钠(天津市北方天医化学试剂厂);碘化钠(天津市北方天医化学试剂厂);甲苯为分析纯,乙腈为色谱纯。甲磺酸加雷沙星样品(天津市汉康医药生物技术有限公司,批号120507、120509、120511)。
2 方法与结果
2.1 色谱条件 色谱柱:AT-1000酸改性聚乙二醇20 M毛细管色谱柱(30 m×0.53 mm,1 μm);电子俘获检测器(ECD);顶空瓶平衡温度:60 ℃;平衡时间30 min;传输温度:120 ℃;进样口温度:200 ℃;检测器温度:240 ℃;程序升温:起始温度40 ℃,以10 ℃/min升温至130 ℃,再以70 ℃/min升温至220 ℃,保持5 min;进样口分流比为20∶1;载气为氮气,柱前压20 kPa。
2.2 溶液的制备
2.2.1 衍生试剂溶液A的配制 称取无水硫代硫酸钠30 mg与碘化钠60.0 g,置50 ml量瓶中,加水溶解并稀释至刻度,摇匀,备用。
2.2.2 供试品溶液的配制 精密称取本品50 mg,置顶空瓶中并加入0.50 ml的溶液A和0.50 ml乙腈溶剂,立即密封,即得。
2.2.3 对照品储备液的配制 分别取甲磺酸乙酯对照品75 mg,置10 ml量瓶中,加甲苯溶解并稀释至刻度,摇匀,精密量取50 μl,置100 ml量瓶中,加乙腈溶剂稀释至刻度,摇匀,作为对照品储备液Ⅰ。精密量取对照储备液Ⅰ 5 ml,置50 ml量瓶中,加乙腈溶剂稀释至刻度,摇匀,作为对照品储备液Ⅱ。
2.2.4 对照品溶液的配制 精密量取对照品储备液Ⅱ 0.50 ml与溶液A 0.50 ml,置顶空瓶中,立即密封,即得。照残留溶剂测定法测定,取空白溶剂、对照品溶液和供试品溶液分别顶空进样,记录色谱图,结果见图1。

1.甲磺酸乙酯
2.3 线性关系考查 精密量取对照品储备液Ⅱ 0.10、0.30、0.50、0.70与0.90 ml,置顶空瓶中,加入溶液A至1 ml,立即密封;取上述密封好的溶液,按“2.1”项下色谱条件,顶空进样,记录色谱图,试验结果按照峰面积与浓度进行线性回归,得回归方程Y=1 353.0X-1 611.5(n=5,r=0.999 4)。表明甲磺酸乙酯在37.56~338.04 ng/ml浓度范围内与峰面积呈良好的线性关系。
2.4 精密度试验 精密量取对照品储备液Ⅱ 0.50 ml与溶液A 0.50 ml,置顶空瓶中,立即密封,作为对照溶液。照上述测定方法,取对照品溶液顶空进样,重复测定6次,得到对照品溶液峰面积的RSD为1.75%(n=6)。
2.5 中间精密度试验 按“2.4”项下的方法于不同时间、不同仪器及不同操作人员,再测定6次,得到对照品溶液峰面积的RSD为1.69%(n=6)。
2.6 最低检测限 取对照品储备液Ⅱ,按主峰与噪音峰信号的强度比为3∶1进行定量稀释,精密量取0.50 ml与溶液A 0.50 ml,置顶空瓶中,立即密封,依法测定,记录色谱图。甲磺酸乙酯的检测限为2.5 ng/ml,相当于0.05 μg/g的杂质可检出。
2.7 加样回收试验 取对照品溶液和供试品溶液顶空进样,记录色谱图。取本品约50 mg,精密称定,分别置于9个顶空瓶中,依次分别加入对照品储备液Ⅱ0.40、0.50和0.60 ml,每个浓度平行3份,再分别加入溶液A至1 ml,立即密封;分别取上述溶液顶空进样,以测得量/添加量×100%计算回收率。测得回收率平均值为99.5%,RSD为1.22%。见表1。
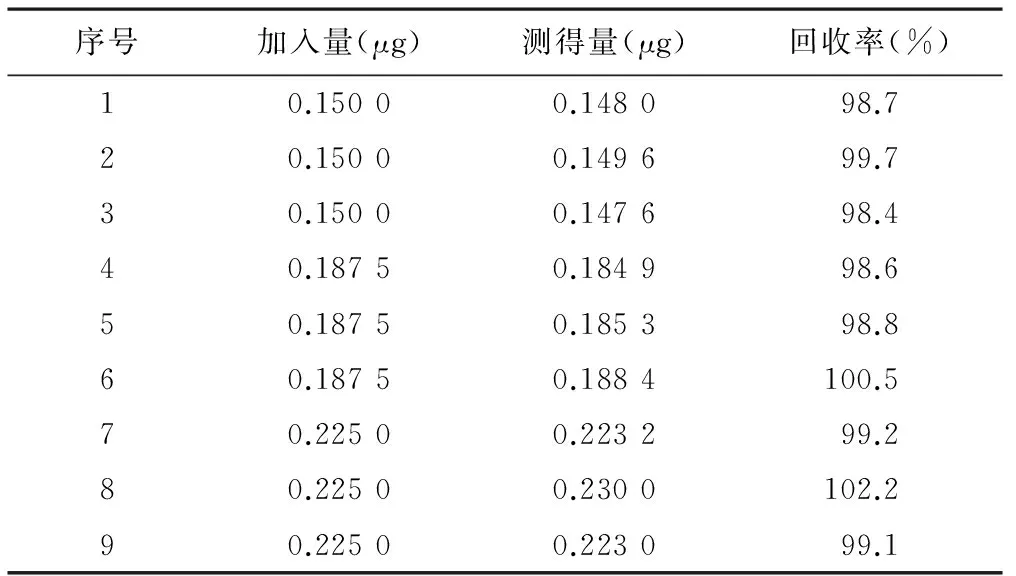
表1 甲磺酸乙酯回收率试验结果
2.8 样品检测结果 取对照品溶液及供试品溶液顶空进样,照上述残留溶剂测定法测定,按外标法以峰面积计算。试验结果三批样品中均未检出甲磺酸乙酯。
3 讨论
甲磺酸加雷沙星因含有甲磺酸根,在其药物合成过程的第一和第二步反应过程中使用了乙醇作为溶剂,少量残存的乙醇会与甲磺酸反应生成杂质甲磺酸乙酯,因其含有遗传毒性,在低浓度时可造成人体遗传物质的损伤,进而导致基因突变并可能促进肿瘤的发生,对人体潜在危害不可低估。
甲磺酸加雷沙星片在日本上市的说明书描述,其日最大剂量为400 mg,根据EMA (European Medicines Agency)在2006年公布的遗传毒性杂质限度指南可知,该TTC估计值为每人1.5 μg/d,故通过计算甲磺酸乙酯的限度应不得过3.75 μg/g。
在加雷沙星与甲磺酸成盐之前也可以对中间体乙醇的残留量进行监控,成盐后经过多次精制,亦能除去反应可能产生的甲磺酸乙酯,并且3批样品中均未检出甲磺酸乙酯,上述检测方法甲磺酸乙酯的检测限为2.5 ng/ml,相当于0.05 μg/g的杂质可检出,可有效检出甲磺酸加雷沙星原料药中可能残留的甲磺酸乙酯,该方法专属性好、灵敏度高,可有效监测药物的质量,以保证用药的安全性。
1 汪令. 加雷沙星的临床研究[J]. 国外医药·抗生素分册,2010,31(1):42-47
2 刘鑫荣.加雷沙星的临床研究[J]. 国外医药·抗生素分册, 2011,32(4):184-187
Determination of residues of ethyl methanesulfonate in garenoxacin mesylate by headspace gas chromatography
Zhang Yixun1,Wei Yongai2,Wang Hua2,Guo Jin2,Mei Chao2,Luo Gang2,Wang Zhifeng2
(1.Tianjin Huajin Pharmaceutical Co Ltd, Tianjin 300462;2.Tianjin Hankang Medicinal&Biological Technology Co Ltd, Tianjin 300409)
Objective: To establish a gas chromatography (GC)method for determining residues of ethyl methanesulfonate in garenoxacin mesylate. Methods: Ethyl methanesulfonate was quantitatively determined on a AT-1000 column was (30 m×0.53 mm,1 μm) with column temperature being increased by programmed control; ECD was used as the detector with a split flow ratio of 20∶1. Results: The calibration curve was linear over the range of 37.56~338.04 ng/ml(r>0.999);the average recovery was 99.5%. Conclution: The method is sample, accurate, reproducible and specific for determination of ethyl methanesulfonate in garenoxacin mesylate.
gas chromatography,genotoxic impurities,ethyl methanesulfonate
2015-05-19
R927.11
A
1006-5687(2015)04-0020-03

