钠、镁与冰醋酸、浓盐酸反应的实验探究
吴文中


摘要:钠的金属活动性比镁强,但实验发现钠和镁分别与浓盐酸、冰醋酸反应,钠的反应速率都明显比后者小,对于这一现象,通过建立金属与水溶液反应释出H2的微观作用模型,认为钠与浓盐酸、冰醋酸反应缓慢的主要原因是受其反应产物NaCl或CH3COONa在浓盐酸或冰醋酸中的溶解性或溶解速率小等因素所影响,钠与镁的金属活动性强弱只是影响化学反应速率的原因之一;同时提出影响活泼金属与水溶液反应释出氢气反应速率的4个因素的观点。
关键词:钠镁;冰醋酸;浓盐酸;实验探究
1 研究背景
钠与水作用得到NaOH并释出H2是中学阶段典型的活泼金属与水反应的课堂教学资源,许多教师在教学过程中把该反应的本质简单归纳为钠是与水电离出来的H3O+作用,认为溶液中的H3O+浓度越大,则钠与水溶液反应越快的结论。学者王永森[1]在探究钠与酸溶液反应时提出钠与酸溶液反应首先是与H3O+作用,认为其他条件相同的情况下,反应速率与H3O+浓度成正比的观点;刘文芳老师在“探究钠与酸溶液的反应速率”[2]一文中提出影响钠与酸溶液反应的两个因素:H3O+浓度大小以及Na+和H2的扩散速率,指出在低浓度酸中,H3O+浓度主导了反应速率,高浓度酸中,Na+和H2的扩散成了控制反应速率的主要原因。但上述观点无法解释一定量的钠分别与pH=1的盐酸、pH=13的氢氧化钠溶液反应时速率几乎相同的事实,因此其观点值得商榷。“钠与酸溶液反应的差异性分析”[3]一文则指出钠与浓酸比钠与水的反应速率小得多的原因是钠与浓盐酸反应得到的NaCl在浓盐酸中难以溶解而影响反应速率,认为所得溶质的溶解度越大,钠与水溶液反应越快的观点。
以上各种观点到底哪种说法更合理,哪种思维模型更能真实表征活泼金属与水溶液作用的反应速率?
2 钠、镁分别与浓盐酸和冰醋酸反应的“异常”现象
[实验1]把一粒黄豆大小的金属钠投入到盛有50mL 35%的浓盐酸的烧杯中,观察到钠浮在液面上并来回移动,反应平稳,无火星,有大量的白色小颗粒逐渐下沉到烧杯底部,溶液变浑浊,经检验,白色小颗粒为NaCl。
[实验2]取1镁条(未打磨,镁条表面积比[实验1]的钠的表面积小得多)投入到盛有50mL 35%的浓盐酸烧杯中,观察到镁开始时下沉并很快上浮到液面,反应较剧烈,一段时间后溶液呈沸腾状,有大量白雾(白雾为盐酸小液滴,有强烈的刺激性气味)产生。比较钠、镁分别与浓盐酸反应发现——镁与浓盐酸反应快得多。
[实验3]把一粒黄豆大小的金属钠和表面积相近的镁条同时投入到盛有50mL 17.4mol/L的冰醋酸的烧杯中。钠浮在溶液液面上,表面有少量气泡,无来回游动现象,反应平稳;镁下沉到溶液底部,表面产生大量气泡并逐渐上浮到溶液表面。肉眼觀察,镁与冰醋酸反应速率大得多,同时可以闻到刺激性气味(乙酸)。反应一段时间后,往烧杯中慢慢注入蒸馏水,钠逐渐融化成小球,开始在液面上来回游动,反应速率显著增大(注:上述三个实验均在19.5℃左右室温下进行)。
3 提出钠、镁与水溶液作用的微观机理模型
3.1 “破坏保护膜”模型研究钠、镁与水溶液作用机理
周星等学者[4]认为镁在低温下能和水反应,但程度低,在相对高温条件下,反应程度较高;随时间增加,同一温度下反应速率减小,即Mg/H2O反应表现出明显的快速反应和慢速反应两个阶段特征:(1)在快速反应阶段:镁粉与水的接触面积大,在反应速率一定的前提下,单位时间参与反应镁的质量大,反应程度快速增加;(2)在慢速反应阶段:随着反应的进行,镁粉表面覆盖了一层Mg(OH)2,使镁粉与水的接触面积减小,阻碍了反应的进一步发生,反应速率减小,反应程度增加缓慢,直至反应停止。在Mg/NaOH溶液体系中,更容易形成Mg(OH)2保护膜,使反应难以持续,这也是大多数学者认为镁与NaOH溶液“不反应”的原因所在,请注意,这里的“不反应”的真实含义就是反应速率很小的意思,而不是不能“自发”。
为研究方便,用图1示意图表征上述“破坏保护膜”模型研究钠、镁与水溶液作用机理。
阴极(正极,下同)行为——溶液中+1价的氢(如H3O+、 CH3COOH、 NH+4、 H2O等粒子)可以靠近或吸附在阴极表面(阴极可以是金属表面的杂质或本身,富集了金属释出的电子),并在其阴极表面获得电子转化为氢原子,氢原子最终形成H2而离开阴极表面。仅从阴极行为这一角度分析,影响镁与水溶液反应的快慢是由溶液中的活性氢在阴极表面获得电子的难易程度与氢分子离开“杂质”表面快慢共同决定的。
阳极行为(负极,下同)——在阳极表面,由于镁失去电子形成Mg2+,Mg2+快速与溶液中的OH-形成Mg(OH)2保护膜,溶液中某些粒子进攻保护膜Mg(OH)2,使得Mg(OH)2溶解而离开阳极表面。仅从阳极行为上看,决定反应快慢的是镁失电子的难易程度与保护膜溶解速率;若保护膜能及时被溶解,镁失去电子的快慢(金属性)就控制了镁与溶液的反应速率;若保护膜不能被及时破坏或难以被破坏,则破坏保护膜的行为就成了影响反应速率的主因。
Mg/NaOH溶液体系中存在“Mg+2H2OMg(OH)2+H2(g),常数为K1”的化学过程,该化学过程无论从焓变还是熵变的角度上看,都有利于反应自发且可以进行到底的。计算获得Mg/NaOH(aq,1mol/L)体系发生反应的平衡常数K1为1062.78,热力学数据表明——镁与NaOH溶液能发生反应。但事实上镁不能与NaOH溶液持续作用释出H2,分析其原因就是由于在NaOH溶液中难以破坏保护膜Mg(OH)2所致。同样利用上述“破坏保护膜模型”来分析铝与NaOH溶液持续作用释出H2,就是因为NaOH溶液可以很快溶解铝表面形成的保护膜[Al2O3或Al(OH)3]。
但钠、镁与冰醋酸反应时,在钠、镁表面并不会形成保护膜,利用上述“破坏保护膜模型”就不能解释镁与冰醋酸反应更快的事实。
3.2 “金属阳离子擴散速率”模型研究钠、镁与水溶液作用机理
文献[5]认为,在钠与盐酸反应体系中存在高浓度的Cl-,由于NaCl溶解度较小,金属钠表面的Na+与Cl-所形成的盐(NaCl)可以暂时在金属钠表面形成“保护膜”,钠离子扩散速率不足够快而“暂时”覆盖在金属钠表面,阻碍金属钠与盐酸的反应,其原理如下:
金属钠与不同浓度的盐酸反应时,盐酸浓度越高,得到固体NaCl也越多,沉积在金属钠表面的氯化钠也越多,从而降低化学反应速率。也就是说,溶液中溶质溶解度越大,金属阳离子离开金属表面的速率也就越大。这是因为费克扩散定律——固液相之间的离子扩散速率与扩散层厚度、扩散层的浓度梯度成正比,其中扩散层的浓度梯度与溶解度相关,固体溶质的溶解度越大,其浓度梯度也越大,因此溶解度大的物质其扩散速率往往也越快。为此,修正研究钠、镁与水作用的“破坏保护膜”模型为“金属阳离子扩散速率”模型,示意图如图2所示。
与水溶液作用机理示意图
“金属阳离子扩散速率”模型与“破坏保护膜”模型的阴极行为并没有发生改变,只是阳极表面并非只是溶液中某些粒子破坏保护膜那么简单,主要是溶液中各种阴离子与金属阳离子之间的作用,若溶液中的阴离子与金属阳离子形成的溶质溶解度越大,那么金属阳离子离开阳极表面的速率就越大,宏观上金属与水溶液反应速率也就越大。
3.3 影响钠、镁与水溶液反应快慢的4个主要因素
综上,影响钠、镁与水溶液反应快慢主要有4个因素(以金属镁为例)。
阳极行为:①金属失电子:Mg-2e-Mg2+;②金属离子离开阳极:Mg2+→Mg2+(aq)。
阴极行为:③活性氢在阴极得电子:2H+1+2e-H2;④H2分子离开阴极材料:H2(吸附)→H2(g)。
第1个因素:金属失去电子的难易取决于金属本身的性质——金属失电子难易程度可以依据金属的活动性强弱判断。
第2个因素:金属离子离开阳极的快慢取决于所形成溶质的溶解性——金属阳离子离开阳极表面的快慢,主要依据金属阳离子和溶液中阴离子所组成的物质的溶解度来判断(详见后文“3.4形成溶质的溶解性大小对钠、镁与水溶液反应的影响”)。
第3个因素:活性氢得电子的快慢取决于活性氢的活性强弱和浓度大小。
一般溶液中含有活性氢的粒子主要有H3O+、 CH3COOH+2(来自CH3COOH的自偶电离)、CH3COOH、 NH+4、 H2O等,但其得电子能力有较大差异,在其浓度相同时,其中H3O+最容易得电子,但在其浓度差异很大的情况下,相对难以得电子的H2O照样也能得电子——“在滴有酚酞试液浓度为1.0mol/L的稀盐酸中投入一黄豆大小的金属钠,可以观察到金属钠周围的溶液会变红色而后又很快褪色”的实验就说明钠和盐酸的反应过程中,溶液中的H2O也可以得电子,只是得到的NaOH溶液能很快被盐酸中和而难以被察觉。
为了说明上述常见含有活性氢的粒子与活泼金属钠、镁作用时得电子的情景,特别设计[实验4]和[实验5]。
[实验4]用2mL 17.4mol/L的冰醋酸和蒸馏水配制成70mL乙酸溶液注入一锥形瓶中;再用2mL 17.4mol/L的冰醋酸以及一定量的乙酸钠固体和蒸馏水配制70mL的混合溶液注入另一锥形瓶,两种溶液温度均为20.2℃。然后分别加入1.3g未经打磨的镁条,使用数字化传感技术分别测定上述2个反应体系的pH和温度随反应时间变化的曲线,如图3所示。
整个实验过程中2个反应体系溶液的温度变化几乎一致,显示2个反应体系的反应速率几乎一样,肉眼观察两者产生气泡量几乎一样,意思是尽管H3O+更容易得到电子,但浓度小,乙酸溶液或乙酸与乙酸钠的混合溶液与金属镁反应的快慢取决于乙酸分子浓度,正因为上述2个反应体系中乙酸分子浓度几乎一样,因此其反应速率也几乎一样。
事实上,NH+4也可能直接得到阴极表面的电子,为此我们设计下列实验。
[实验5]配制浓度1.0mol/L的NH4Cl溶液及浓度为1.0mol/L NH4Cl与少量浓氨水的混合溶液100mL,分别放入2只250mL烧杯中,同时加入1.3g未经打磨的镁条,使用数字化传感技术分别测定2个反应体系的pH和温度随反应时间变化的曲线,如图4所示(pH传感器所测定的pH有误差,但不影响两者的对比实验讨论)。
反应开始阶段NH4Cl溶液pH显著升高,而NH4Cl和氨水混合溶液pH升高缓慢,整个实验过程中2个反应体系溶液的温度变化几乎一致,显示2个反应体系的反应速率几乎一样,肉眼观察两者产生气泡量几乎一样。上述实验同样可以说明——尽管H3O+更容易得到电子,但由于浓度小,影响NH4Cl溶液或NH4Cl与氨水的混合溶液与金属镁反应快慢的因素在于NH+4浓度,正因为上述2个反应体系中NH+4浓度几乎一样,因此其反应速率也几乎一样。
值得注意的是[实验4]和[实验5]得电子的粒子不可能主要是H2O,因为镁与NaCl溶液作用产生的H2慢得多,但H2O也不可能不得电子。
综上,钠、镁与水溶液作用时其阴极行为主要就是活性氢得电子的难易程度以及活性氢的浓度大小。
第4个因素:阴极材料性质对反应的影响。
纯净的锌与稀硫酸难以反应,但若加入铜粉则可显著提高锌与稀硫酸的反应速率,在锌和稀硫酸反应体系中加入少许氯化汞,则锌和稀硫酸之间几乎就不能发生反应。对于这一现象,在物理化学教材中主要是用析氢超电位理论来解释,其中H2在汞表面的超电位特别大,H2分子难以“逃逸”。从微观角度分析就是H2在不同金属或杂质表面“脱吸”的难易程度不一样,由于文章篇幅所限,不再赘述。
3.4 形成溶质的溶解性大小对钠、镁与水溶液反应的影响
学者张勇、邓伟等[6]在“利用数字化实验探究氯离子对金属腐蚀速率的影响”一文中,利用温度传感器、电流传感器、电势传感器和压力传感器测定氯离子对金属腐蚀的影响,通过对比实验,用实时、准确的数据说明氯离子能加快金属腐蚀速率的广泛性。氯离子对金属的腐蚀一是破坏金属物质表面的氧化膜等,二是与金属离子形成配合物促进金属溶解。为了说明钠、镁与不同水溶液作用所形成的溶质对反应速率的影响,选取钠、镁等活泼金属的硫酸盐、氯化物和氢氧化物的溶解性作详细分析讨论。查阅常见金属的硫酸盐、氯化物和氢氧化物的溶解度如表1所示。
从表1中可以看到:常见金属的硫酸盐的溶解度无一例外地比相应的氯化物的溶解度小,若换算为物质的量浓度,硫酸盐浓度同样明显小于相应氯化物浓度,其中锌的硫酸盐的溶解度远远小于其氯化物的溶解度,为此补充[实验6]——取质量为5.0g且大小形状相同的高纯度锌粒,分别投入到100mL 1mol/L的硫酸和2mol/L的盐酸中(20.2℃左右),实验发现锌与稀硫酸作用时,锌粒表面气泡较少(氢在锌上析出的超电势为0.70V[7]),但是锌与盐酸反应剧烈(尽管上述实验中,硫酸和盐酸溶液的pH几乎一样),印证了“锌与溶液中阴离子所形成溶质的溶解性大小显著影响金属与水溶液作用的反应速率”的结论。又如Al与CuSO4溶液反应体系中,由于铝表面易形成一层致密的氧化膜,导致Al与CuSO4溶液的反应难以较快进行,为了加快反应速率,可以在CuSO4溶液中加入少量固体NaC1。结果显示,铝与硫酸铜反应明显加快完成“铜树”实验,其中加入NaCl固体后,溶液中的Cl-浓度增大,为Al3+形成的盐的溶解度相应增大,即Cl-的存在,使得Al3+离开金属表面更快,Al3+的扩散速率更大。
3.5 钠、镁与冰醋酸反应出现“异常”的原因分析
上述[实验3]中钠和镁分别与冰醋酸反应,为什么钠的反应速率反而比镁与冰醋酸的反应速率小?
采用“金属阳离子扩散速率”模型讨论上述实验的“异常”现象是不错的选择。
首先,钠镁相比,前者的金属活动性强,因此从金属失电子角度上看,钠与冰醋酸反应更快;第二,2个反应体系中都是CH3COOH或CH3COOH+2得电子,无显著差异;第三,两种金属含有的杂质不多,对反应速率的影响很小;第四,钠与冰醋酸反应形成的溶质是乙酸钠,镁与冰醋酸反应形成的溶质是乙酸镁,其溶质的性质不一样。
以上分析推理可获知:钠、镁与冰醋酸反应“异常”定是因为钠、镁和冰醋酸反应后形成的溶质在冰醋酸中溶解度存在显著差异所致。但查阅许多文献和教材,未能查到CH3COONa与Mg(CH3COO)2在冰醋酸中的溶解度,为此分别取1.5g CH3COONa和Mg(CH3COO)2固体于2只100mL的烧杯中,同时加入50mL 17.4mol/L的冰醋酸,稍稍搅拌,6分钟后,Mg(CH3COO)2固体能完全溶解,而CH3COONa固体在乙酸中难以溶解。
在钠、镁同时放入冰醋酸的相关实验中,一段时间后再加入蒸馏水,发现镁和冰醋酸反应速率有所增大,这是因为冰醋酸被水稀释后,体系中更容易得电子的H3O+逐渐增多所致;同时还发现钠和冰醋酸反应速率增大更显著,那是因为乙酸钠在水中的溶解度显著增大所致,而乙酸镁在水中溶解度增大相对不明显[注:20℃时,CH3COONa的溶解度为46.4g/(100g水),Mg(CH3COO)2的溶解度为53.4g/(100g水),且乙酸钠比乙酸镁的摩尔质量小许多,因此前者的物质的量浓度比后者大许多]。
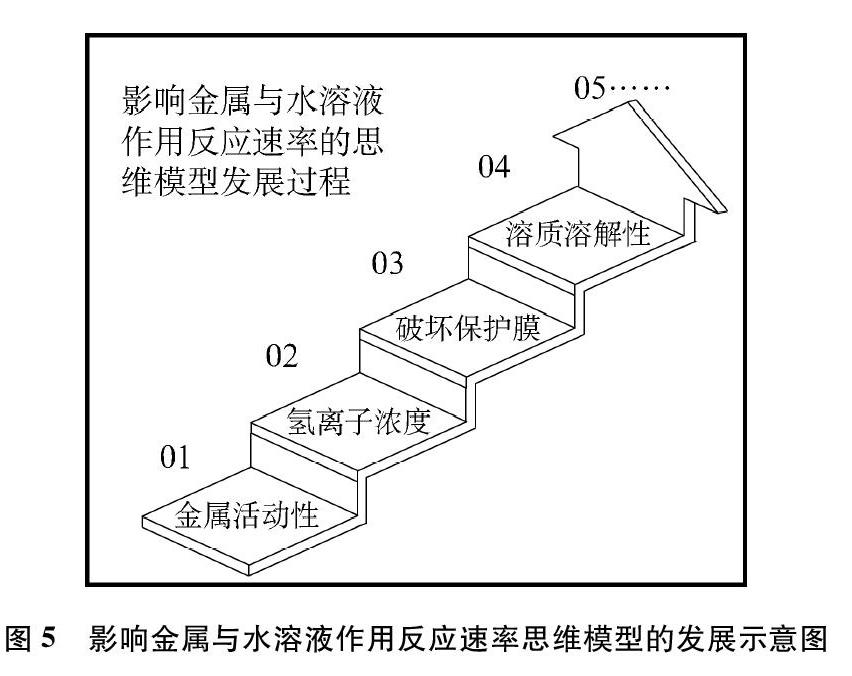
综上,归纳、概括、总结钠、镁或其他金属与水溶液作用的认识过程,研究其反应速率的思维模型的发展过程可用图5来描述。
4 预测并证实或证伪其他金属与水溶液作用结果
那么,其他金属与水溶液作用时是否也有类似规律,化学反应速率大小是否可以采用“金属阳离子扩散速率”模型来解释?现以解释或预测有关金属铅与水溶液的作用为例来说明。
铅为什么不能与硫酸溶液反应——主要因为PbSO4难溶于水。
铅为什么能与浓盐酸反应释出H2——因为PbCl2在浓盐酸中溶解度增大,PbCl2在高浓度Cl-中形成PbCl-3配离子,相当于显著增大了PbCl2的溶解度,有利于Pb2+的扩散。
为什么“铅室法制硫酸”中用铅制品作为制备硫酸的容器——因为铅很难与硫酸溶液反应,不但因为PbSO4难溶于水形成保护膜,而且H2在Pb上难以“逃逸”,Pb存在较高的析氢超电位。
铅蓄电池为什么不使用盐酸为电解质溶液——防止铅与盐酸直接发生反应放出H2。
铅能与稀硝酸反应、与浓硝酸却不反应——浓硝酸能使Pb表面形成保护膜,类似金属铁、铝遇浓硝酸发生的“钝化”作用。
铅为什么能与醋酸溶液持续反应——因为醋酸铅在水中溶解度较大。
钙、钡等金属的氢氧化物及其硫酸盐的溶解度比较小,依据上述分析模型预测钙和钡等两种金属分别与水或稀硫酸反应的速率并没有钠分别与水、稀硫酸反应那么剧烈,尽管钙和钡的金属活动性比钠强,为了证实或证伪,设计[实验7]。
[实验7]取2颗黄豆大小的金属钙、分别投放到2只盛有30mL蒸馏水与1mol/L的稀硫酸溶液的烧杯中(两种溶液温度均为20.2℃左右),发现金属钙下沉到溶液底部,其中蒸馏水中的钙表面均匀地产生气泡,比钠与水反应平缓、安静,一段时间后,溶液突然变浑浊;在稀硫酸体系中,比钠与稀硫酸反应更平缓,投入金属钙的瞬间能看到在金属钙周围有大量白色沉淀,随着反应的进行,钙表面产生的气泡量减少,不久后,钙与硫酸反应出现微小的“爆炸”现象并继续反应。原因就是钙与水、硫酸反应得到溶质Ca(OH)2、 CaSO4的溶解度均比较小,钙离子离开金属表面慢,离子的扩散速率小,这说明活泼金属与水或酸溶液反应得到的碱或盐的溶解性对反应速率的影响是显著的,甚至可能在许多情况下是控制性因素。分析钠/氢氟酸体系,发现生成物氟化钠是溶解度较小的固体(氟化钠20℃的溶解度为4.06g/100g水),预测钠和氢氟酸反应是缓慢的。由于实验条件的限制和氢氟酸相关实验的危险性,上述预测虽未能证实或证伪,但推断钠和氢氟酸的反应速率一定不快。
參考文献:
[1]王永森. 探究钠与酸反应时是与水反应还是与H+反应[J]. 教学仪器与实验(中学版),2005,(12):12.
[2]刘文芳. 探究钠与酸溶液的反应速率[J]. 化学教育,2009,(5):54.
[3][5]吴文中. 钠与酸溶液反应的差异性分析[J]. 中学化学教学参考,2016,(C1):5~8.
[4]周星,张炜,郭洋,姜本正. 低温镁/水反应特征及反应动力学研究[J]. 固体火箭技术,2011,34(1):71~74.
[6]张勇,邓伟,王文玉. 利用数字化实验探究氯离子对金属腐蚀速率的影响[J]. 化学教学,2017,(12):65~67.
[7]陈恕华. 不宜用热力学原理解释反应速率问题——兼谈锌与稀硫酸溶液的反应[J]. 化学教学,2001,(3):43~44.

