人乳头瘤病毒疫苗预防宫颈癌及其相关感染有效性及安全性的Meta分析
杨 丽,何 艳,马彩玲
人乳头瘤病毒疫苗预防宫颈癌及其相关感染有效性及安全性的Meta分析
杨 丽,何 艳,马彩玲
目的 系统评价人乳头瘤病毒(HPV)疫苗预防宫颈癌及HPV相关感染的有效性与安全性。方法 计算机检索PubMed、EMBase、Cochrane Library、OVID、中国生物医学文献数据库(CBM)、中国知网、万方数据库,并辅以手工检索相关杂志和纳入研究的参考文献,查找关于HPV疫苗预防宫颈癌及HPV相关感染的随机对照研究(RCT),检索时限从建库至2014年7月。由2名评价员按照纳入和排除标准独立进行文献筛选、资料提取和质量评价后,采用RevMan 5.2软件进行Meta分析。结果 最终纳入23篇RCT。Meta分析结果显示,疫苗组宫颈上皮内瘤样病变(CIN)Ⅱ+发生率、6个月HPV持续性感染发生率、12个月HPV持续性感染发生率、阴道内皮瘤样变(VIN)Ⅱ+/外阴内皮瘤样变(VaIN)Ⅱ+发生率、外生殖器疣发生率、高危型HPV(HR-HPV)相关感染与疾病发生率均低于对照组(P<0.05)。按照预案规定(PP)人群及意向性分析(ITT)人群,疫苗组CINⅡ+发生率、6个月HPV持续性感染发生率、12个月HPV持续性感染发生率、VINⅡ+/VaINⅡ+发生率、外生殖器疣发生率、HR-HPV相关感染与疾病发生率均低于对照组(P<0.05)。疫苗组注射部位相关不良反应发生率高于对照组(P<0.05);疫苗组与对照组系统不良反应发生率、严重不良反应发生率、病死率比较,差异无统计学意义(P>0.05)。结论 HPV疫苗对预防宫颈癌前病变、HPV持续性感染、HPV相关外生殖器病变显示了高效的保护效应和交叉保护效果,因此是安全、有效的。然而现有报道尚未证明HPV疫苗预防宫颈癌的远期疗效,不能提供HPV疫苗预防宫颈癌的直接证据,有待开展更多高质量RCT并延长随访时间以进一步验证。
乳头状瘤病毒疫苗;宫颈肿瘤;预防;随机对照试验;Meta分析
杨丽,何艳,马彩玲.人乳头瘤病毒疫苗预防宫颈癌及其相关感染有效性及安全性的Meta分析[J].中国全科医学,2015,18(12):1415-1424.[www.chinagp.net]
Yang L,He Y,Ma CL.Efficacy and safety of prophylactic human papillomavirus vaccine in preventing cervical cancer and HPV-ralated infection prevention:a Meta-analysis[J].Chinese General Practice,2015,18(12):1415-1424.
人乳头瘤病毒(HPV)感染是宫颈癌的主要病因。20世纪80年代德国科学家Haraldzur Hausen首先发现HPV感染与宫颈癌的发生发展相关,并揭示其中高危型HPV(HR-HPV)16、18感染可引起70%以上感染者发生宫颈癌和癌前病变,而低危型HPV(LR-HPV)6、11感染,则主要引起生殖器疣[1-2]。近年来,随着社会生活的变化,HPV感染发生率呈上升趋势[3]。虽然宫颈癌的筛查可以减少其发生的危险,但不能阻止HPV的感染。研制廉价、高效的预防性HPV疫苗,采用特异性的免疫接种方法预防生殖道HPV感染及其所引起的恶性病变,具有重大的经济学价值和社会意义。目前,世界上已经通过基因重组技术成功制备了四价(HPV 6/11/16/18)和二价(HPV 16/18)HPV疫苗,分别于2006年和2007年获准上市[4]。HPV疫苗接种是一个重大的公共卫生干预措施,其实施影响国家长期预算及健康结果。因此,健全的信息是决策的关键。随着HPV疫苗的广泛应用,HPV疫苗取得了显著的功效,对疫苗所针对的HPV亚型感染的癌前病变预防有效率几乎为100%。也有相关系统评价,如Lu等[5]研究不同种类疫苗的流行病学保护效果和安全性,但大多结局指标局限,且研究地域局限,大多集中在欧美发达国家。最近出现一些对亚洲人群进行的高质量的随机对照试验(RCT)以及更多对HR-HPV交叉保护的研究结果。本研究对国内外关于预防性HPV疫苗有效性与安全性的RCT进行Meta分析,为我国制定HPV疫苗的免疫策略提供循证医学证据。
1 资料与方法
1.1 纳入标准
1.1.1 研究类型 所有HPV疫苗预防宫颈癌及HPV相关感染有效性及安全性的RCT,文种限中英文。
1.1.2 研究对象 健康女性,年龄9~26岁,未孕,巴氏涂片结果无异常,研究期间有效避孕。
1.1.3 干预措施 对照组:安慰剂或其他疫苗;疫苗组:HPV疫苗。
1.1.4 结局指标 主要临床疗效指标:(1)宫颈上皮内瘤样病变(CIN)Ⅱ+(CINⅡ、CINⅢ、原位癌、宫颈癌)发生率;(2)6个月HPV持续性感染发生率;(3)12个月HPV持续性感染发生率。次要临床疗效指标:(1)阴道内皮瘤样变(VIN)Ⅱ+/外阴内皮瘤样变(VaIN)Ⅱ+(VINⅡ/VaINⅡ、VINⅢ/VaINⅢ)发生率;(2)外生殖器疣发生率;(3)HR-HPV相关感染与疾病发生率。安全性指标:(1)注射部位相关不良反应发生率;(2)系统不良反应发生率;(3)严重不良反应发生率;(4)病死率。
1.2 排除标准 研究方法不是RCT;入组前巴氏涂片结果阳性、妊娠的女性;研究对象男性疫苗接种者或治疗性疫苗接种者;无对照研究;重复报道,结局指标资料不详细的文献。
1.3 检索策略 计算机检索:PubMed(1969年1月—2014年7月)、EMBase(1980年1月—2014年7月)、Cochrane Library(2013年第12期)、OVID(2003年1月—2014年7月)、中国生物医学文献数据库(CBM)(1978年1月—2014年7月)、中国知网(1998年1月—2014年7月)、万方数据库(2002年1月—2014年7月),并辅以手工检索相关杂志和纳入研究的参考文献,查找关于HPV疫苗预防宫颈癌及HPV相关感染有效性及安全性的RCT。英文检索词包括:human papillomavirus vaccine、HPV vaccine、cervical cancer vaccine、randomized、randomised、controlled、trial;中文检索词包括:人乳头瘤病毒、宫颈癌、疫苗、随机对照试验。
1.4 文献筛选与资料提取 由2名评价员独立进行文献的筛选、纳入文献的方法学质量评价、数据的提取,并进行交叉核对,如遇分歧由第3位研究人员协助解决,缺乏的资料尽量与原作者联系索取。
1.5 文献质量评价 按照Cochrane系统评价员手册5.1.0[6]的质量评价标准评价纳入RCT的方法学质量:采用何种随机分配方法、是否进行分配隐藏、有无采用盲法评价、有无数据偏倚、是否选择性报告结果及其他偏倚。各条目评价结果按“是”(低偏倚风险)“不清楚”及“否”(高偏倚风险)表示。
1.6 统计学方法 采用Cochrane协作网提供的RevMan 5.2软件[7]进行Meta分析。计数资料采用优势比(OR)及其95%CI表示。采用I2检验对纳入文献进行统计学异质性分析,当P≥0.1和I2≤50%时,表示各研究间无统计学异质性,采用固定效应模型;若P<0.1和I2>50%,表示各研究间存在统计学异质性,分析其异质性来源,对可能导致异质性的因素进行亚组分析,若仍存在统计学异质性而无临床异质性或差异无统计学意义时,采用随机效应模型进行分析。当异质性源于低质量研究时,进行敏感性分析。如两组间异质性过大或无法找寻数据来源时,采用描述性分析。若试验过程中有退出和/或失访病例,则按意向性分析(ITT)原则处理。以P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果与纳入文献的基本特征 初检出相关文献621篇,其中英文579篇,中文42篇。通过阅读文题、摘要和全文排除598篇,最终纳入23篇[8-30],均为英文文献。文献检索流程及结果见图1。纳入文献的基本特征详见表1。
2.2 纳入文献的偏倚风险评估结果 23篇文献均采用随机方法,均采用分配隐藏、双盲,选择性报告及其他偏倚均为不清楚(见表2)。
2.3 Mata分析结果
金昌市全市规模以上工业企业有60家,其中国有及国有控股企业12家,大型企业5家,中型企业5家,小型企业50家,重工业42家。工业占国民经济的比重达到63.6%,全市产业结构比例为 5.4∶75.8∶18.8, 以工业为主的第二产业支撑作用明显,工业经济对全市社会经济的支撑作用明显,主导地位愈加突显。其中地方财政收入大部分来源于有色金属经济,可以说有色冶金经济是金昌市的命脉。然而,过去20多年的开发,开始出现储采失衡,由于后备资源严重不足,已不能在长时间内维持现有产量水平,储量以及国际镍价的双项制约使得金昌市经济止步不前。急需寻求接续和替代产业,为城市经济持续增长寻找新的动力和支撑。
2.3.1 CINⅡ+发生率 共纳入16篇文献[9,11-13,16-21,23-26,28,30],各研究间存在统计学异质性(P<0.000 01,I2=90%),故采用随机效应模型,Meta分析结果显示,疫苗组CINⅡ+发生率低于对照组,差异有统计学意义〔OR=0.08,95%CI(0.04,0.17),P<0.000 01〕。按照人群分析的不同将纳入文献分为2类,进行亚组分析,PP人群中,各研究间无统计学异质性(P=0.50,I2=0%),故采用固定效应模型,Meta分析结果显示,疫苗组CINⅡ+发生率低于对照组,差异有统计学意义〔OR=0.05,95%CI(0.02,0.09),P<0.000 01〕;ITT人群中,各研究间存在统计学异质性(P<0.000 01,I2=90%),故采用随机效应模型,Meta分析结果显示,疫苗组CINⅡ+发生率低于对照组,差异有统计学意义〔OR=0.12,95%CI(0.05,0.28),P<0.000 01,见图2〕。
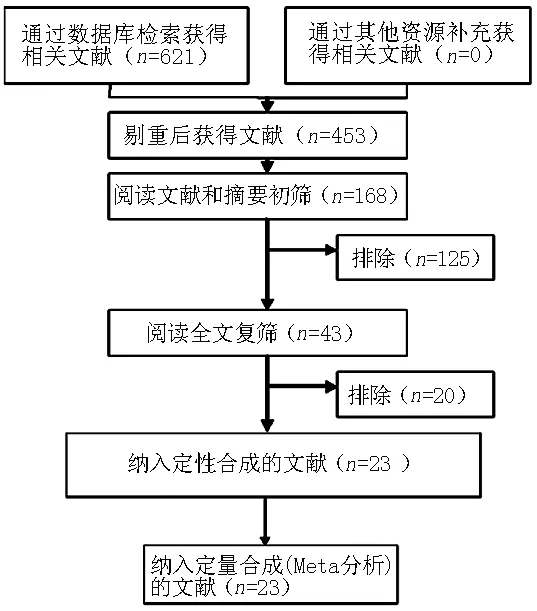
图1 文献筛选流程图
(续表1)
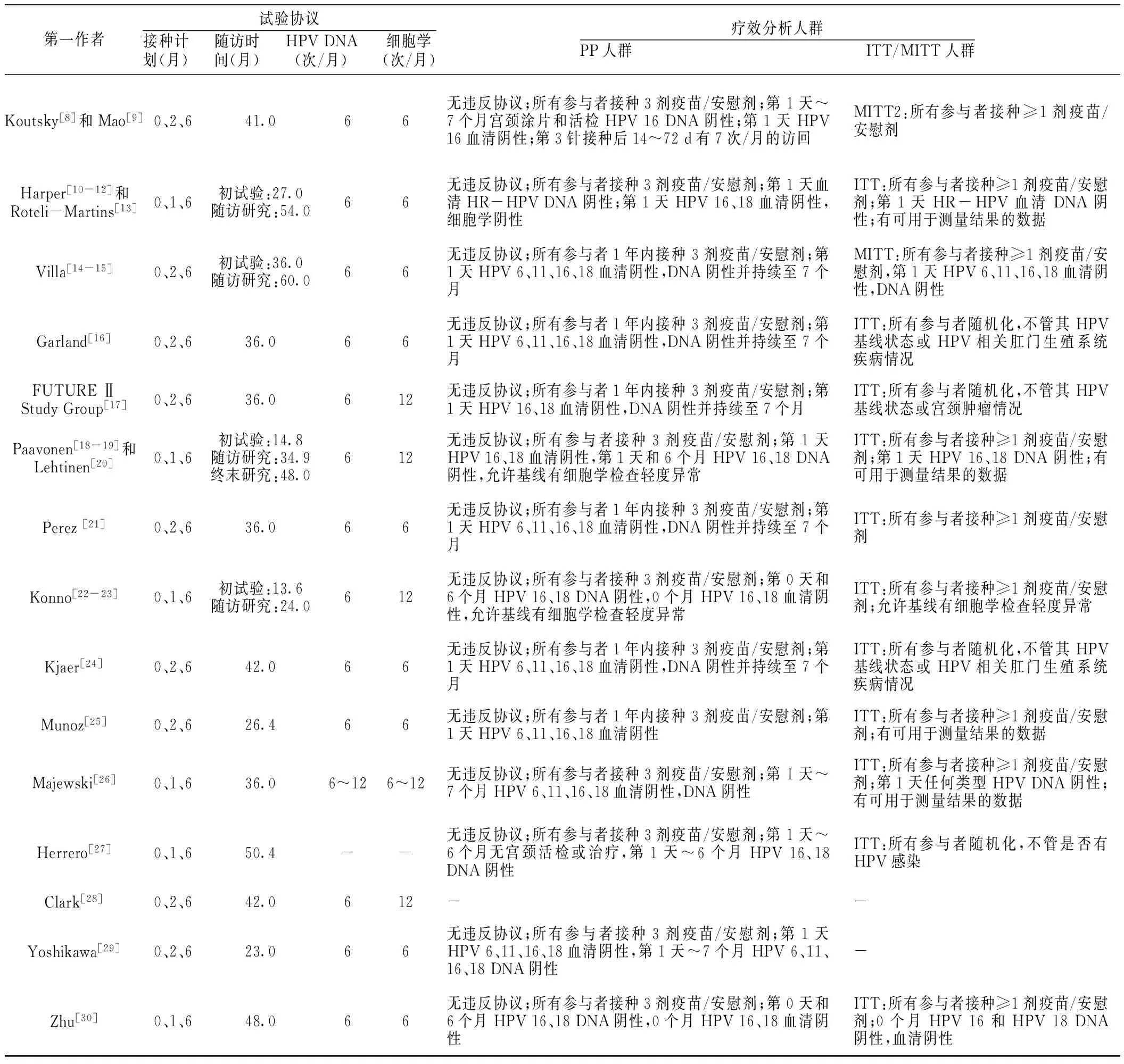
第一作者试验协议接种计划(月) 随访时间(月) HPVDNA(次/月) 细胞学(次/月)疗效分析人群PP人群 ITT/MITT人群Koutsky[8]和Mao[9]0、2、641.066无违反协议;所有参与者接种3剂疫苗/安慰剂;第1天~7个月宫颈涂片和活检HPV16DNA阴性;第1天HPV16血清阴性;第3针接种后14~72d有7次/月的访回MITT2:所有参与者接种≥1剂疫苗/安慰剂Harper[10-12]和Roteli-Martins[13]0、1、6初试验:27.0随访研究:54.066无违反协议;所有参与者接种3剂疫苗/安慰剂;第1天血清HR-HPVDNA阴性;第1天HPV16、18血清阴性,细胞学阴性ITT:所有参与者接种≥1剂疫苗/安慰剂;第1天HR-HPV血清DNA阴性;有可用于测量结果的数据Villa[14-15]0、2、6初试验:36.0随访研究:60.066无违反协议;所有参与者1年内接种3剂疫苗/安慰剂;第1天HPV6、11、16、18血清阴性,DNA阴性并持续至7个月MITT:所有参与者接种≥1剂疫苗/安慰剂,第1天HPV6、11、16、18血清阴性,DNA阴性Garland[16]0、2、636.066无违反协议;所有参与者1年内接种3剂疫苗/安慰剂;第1天HPV6、11、16、18血清阴性,DNA阴性并持续至7个月ITT:所有参与者随机化,不管其HPV基线状态或HPV相关肛门生殖系统疾病情况FUTUREⅡStudyGroup[17]0、2、636.0612无违反协议;所有参与者1年内接种3剂疫苗/安慰剂;第1天HPV16、18血清阴性,DNA阴性并持续至7个月ITT:所有参与者随机化,不管其HPV基线状态或宫颈肿瘤情况Paavonen[18-19]和Lehtinen[20]0、1、6初试验:14.8随访研究:34.9终末研究:48.0612无违反协议;所有参与者接种3剂疫苗/安慰剂;第1天HPV16、18血清阴性,第1天和6个月HPV16、18DNA阴性,允许基线有细胞学检查轻度异常ITT:所有参与者接种≥1剂疫苗/安慰剂;第1天HPV16、18DNA阴性;有可用于测量结果的数据Perez[21]0、2、636.066无违反协议;所有参与者1年内接种3剂疫苗/安慰剂;第1天HPV6、11、16、18血清阴性,DNA阴性并持续至7个月ITT:所有参与者接种≥1剂疫苗/安慰剂Konno[22-23]0、1、6初试验:13.6随访研究:24.0612无违反协议;所有参与者接种3剂疫苗/安慰剂;第0天和6个月HPV16、18DNA阴性,0个月HPV16、18血清阴性,允许基线有细胞学检查轻度异常ITT:所有参与者接种≥1剂疫苗/安慰剂;允许基线有细胞学检查轻度异常Kjaer[24]0、2、642.066无违反协议;所有参与者1年内接种3剂疫苗/安慰剂;第1天HPV6、11、16、18血清阴性,DNA阴性并持续至7个月ITT:所有参与者随机化,不管其HPV基线状态或HPV相关肛门生殖系统疾病情况Munoz[25]0、2、626.466无违反协议;所有参与者1年内接种3剂疫苗/安慰剂;第1天HPV6、11、16、18血清阴性ITT:所有参与者接种≥1剂疫苗/安慰剂;有可用于测量结果的数据Majewski[26]0、1、636.06~126~12无违反协议;所有参与者接种3剂疫苗/安慰剂;第1天~7个月HPV6、11、16、18血清阴性,DNA阴性ITT:所有参与者接种≥1剂疫苗/安慰剂;第1天任何类型HPVDNA阴性;有可用于测量结果的数据Herrero[27]0、1、650.4--无违反协议;所有参与者接种3剂疫苗/安慰剂;第1天~6个月无宫颈活检或治疗,第1天~6个月HPV16、18DNA阴性ITT:所有参与者随机化,不管是否有HPV感染Clark[28]0、2、642.0612--Yoshikawa[29]0、2、623.066无违反协议;所有参与者接种3剂疫苗/安慰剂;第1天HPV6、11、16、18血清阴性,第1天~7个月HPV6、11、16、18DNA阴性-Zhu[30]0、1、648.066无违反协议;所有参与者接种3剂疫苗/安慰剂;第0天和6个月HPV16、18DNA阴性,0个月HPV16、18血清阴性ITT:所有参与者接种≥1剂疫苗/安慰剂;0个月HPV16和HPV18DNA阴性,血清阴性
注:HPV=人乳头瘤病毒,PP=按照预案规定,ITT=意向性分析,MITT=修正的意向性分析,AAHS=无定形羟基磷酸铝硫酸盐佐剂,AS04=3-氧-生长素-单磷酰酯A-4,氢氧化铝,HR-HPV=高危型人乳头瘤病毒;-为无此项
2.3.2 6个月HPV持续性感染发生率 共纳入9篇文献[9,11-13,15,22-23,29-30],各研究间无统计学异质性(P=0.97,I2=0%),故采用固定效应模型,Meta分析结果显示,疫苗组6个月HPV持续性感染发生率低于对照组,差异有统计学意义〔OR=0.05,95%CI(0.03,0.08),P<0.000 01〕。按照人群分析的不同将纳入文献分为2类,进行亚组分析,PP人群中,各研究间无统计学异质性(P=0.83,I2=0%),故采用固定效应模型,Meta分析结果显示,疫苗组6个月HPV持续性感染发生率低于对照组,差异有统计学意义〔OR=0.05,95%CI(0.03,0.08),P<0.000 01〕;ITT人群中,各研究间无统计学异质性(P=0.89,I2=0%),故采用固定效应模型,Meta分析结果显示,疫苗组6个月HPV持续性感染发生率低于对照组,差异有统计学意义〔OR=0.06,95%CI(0.03,0.11),P<0.000 01,见图3〕。
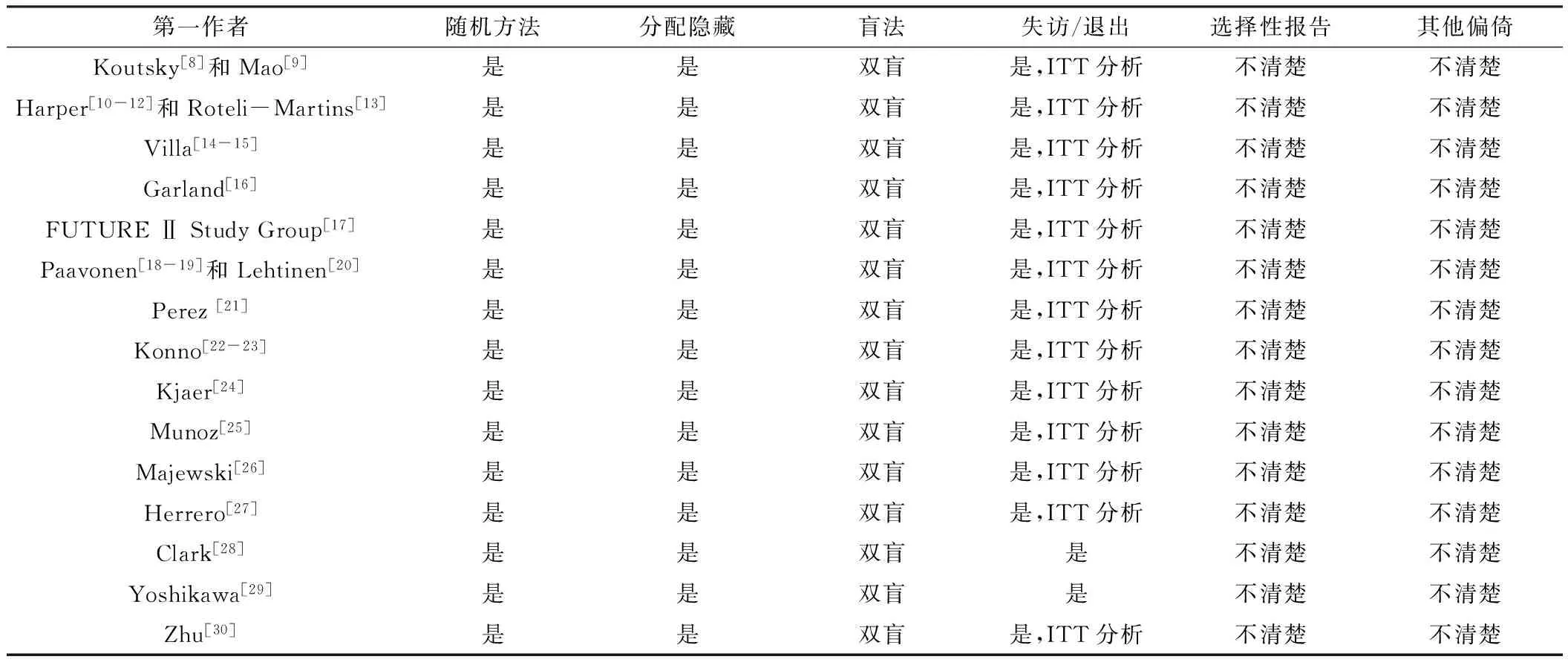
表2 纳入文献的偏倚风险评估

注:PP=按照预案规定,ITT=意向性分析
图2 对照组与疫苗组CINⅡ+发生率比较的森林图
Figure 2 Forest plot for comparison of the frequency of CINⅡ+between control group and vaccine group
2.3.3 12个月HPV持续性感染发生率 共纳入7篇文献[11-13,18,23,27,30],各研究间无统计学异质性(P=0.41,I2=3%),故采用固定效应模型,Meta分析结果显示,疫苗组12个月HPV持续性感染发生率低于对照组,差异有统计学意义〔OR=0.11,95%CI(0.08,0.17),P<0.000 01〕。按照人群分析的不同将纳入文献分为2类,进行亚组分析,PP人群中,各研究间无统计学异质性(P=0.84,I2=0%),故采用固定效应模型,Meta分析结果显示,疫苗组12个月HPV持续性感染发生率低于对照组,差异有统计学意义〔OR=0.08,95%CI(0.04,0.14),P<0.000 01〕;ITT人群中,各研究间无统计学异质性(P=0.44,I2=0%),故采用固定效应模型,Meta分析结果显示,疫苗组12个月HPV持续性感染发生率低于对照组,差异有统计学意义〔OR=0.17,95%CI(0.10,0.30),P<0.000 01,见图4〕。

图3 对照组与疫苗组6个月HPV持续性感染发生率比较的森林图
Figure 3 Forest plot for comparison of the frequency of HPV persistent infection(6 months) between control group and vaccine group
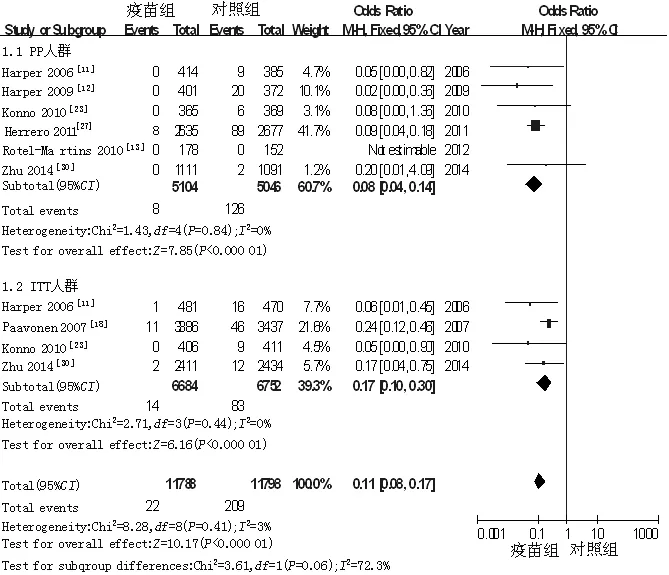
图4 对照组与疫苗组12个月HPV持续性感染发生率比较的森林图
Figure 4 Forest plot for comparison of the frequency of HPV persistent infection(12 months) between control group and vaccine group
2.3.4 VINⅡ+/VaINⅡ+发生率 共纳入6篇文献[16,21,24-26,28],各研究间无统计学异质性(P=0.28,I2=19%),故采用固定效应模型,Meta分析结果显示,疫苗组VINⅡ+/VaINⅡ+发生率低于对照组,差异有统计学意义〔OR=0.16,95%CI(0.10,0.25),P<0.000 01〕。按照人群分析的不同将纳入文献分为2类,进行亚组分析,PP人群中,各研究间无统计学异质性(P=0.82,I2=0%),故采用固定效应模型,Meta分析结果显示,疫苗组VINⅡ+/VaINⅡ+发生率低于对照组,差异有统计学意义〔OR=0.05,95%CI(0.01,0.18),P<0.000 01〕;ITT人群中,各研究间无统计学异质性(P=0.25,I2=27%),故采用固定效应模型,Meta分析结果显示,疫苗组VINⅡ+/VaINⅡ+发生率低于对照组,差异有统计学意义〔OR=0.21,95%CI(0.13,0.34),P<0.000 01,见图5〕。
2.3.5 外生殖器疣发生率 共纳入6篇文献[15-16,21,25-26,28],各研究间存在统计学异质性(P<0.000 01,I2=79%),故采用随机效应模型,Meta分析结果显示,疫苗组外生殖器疣发生率低于对照组,差异有统计学意义〔OR=0.06,95%CI(0.02,0.16),P<0.000 01〕。按照人群分析的不同将纳入文献分为2类,进行亚组分析,PP人群中,各研究间无统计学异质性(P=0.55,I2=0%),故采用固定效应模型,Meta分析结果显示,疫苗组外生殖器疣发生率低于对照组,差异有统计学意义〔OR=0.02,95%CI(0.01,0.06),P<0.000 01〕;ITT人群中,各研究间存在统计学异质性(P=0.001,I2=81%),故采用随机效应模型,Meta分析结果显示,疫苗组外生殖器疣发生率低于对照组,差异有统计学意义〔OR=0.12,95%CI(0.05,0.31),P<0.000 01,见图6〕。

图5 对照组与疫苗组VINⅡ+/VaINⅡ+发生率比较的森林图
Figure 5 Forest plot for comparison of the frequency of VINⅡ+/VaINⅡ+between control group and vaccine group
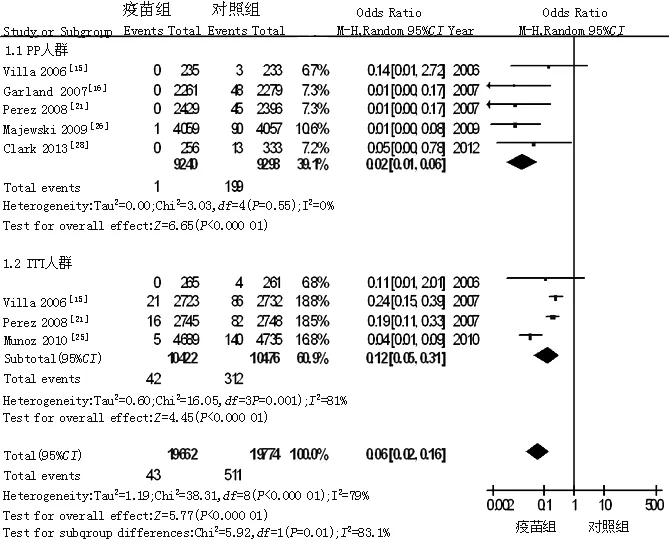
图6 对照组与疫苗组外生殖器疣发生率比较的森林图
Figure 6 Forest plot for comparison of the frequency of exophytic genital wart between control group and vaccine group
2.3.6 HR-HPV相关感染与疾病发生率 共纳入5篇文献[9,11,16,25-26],各研究间存在统计学异质性(P<0.000 01,I2=87%),故采用随机效应模型,Meta分析结果显示,疫苗组高风险HPV相关感染与疾病发生率低于对照组,差异有统计学意义〔OR=0.46,95%CI(0.36,0.59),P<0.000 01〕。按照不同疾病将纳入文献分为4组,进行亚组分析,结果显示,疫苗组CINⅠ+、CINⅡ+、外生殖器疣、VINⅡ+/VaINⅡ+发生率均低于对照组,差异有统计学意义〔OR=0.73,95%CI(0.66,0.80),P<0.000 01〕、〔OR=0.57,95%CI(0.41,0.79),P<0.000 7〕、〔OR=0.21,95%CI(0.08,0.53),P<0.000 9〕、〔OR=0.19,95%CI(0.07,0.52),P=0.01,见图7〕。
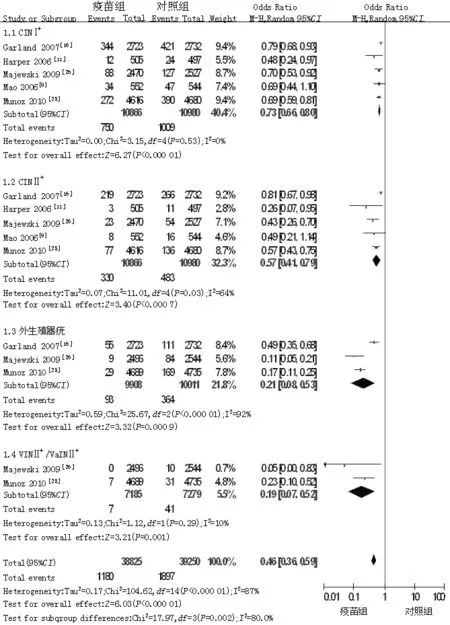
注:CIN=上皮内瘤样病变,VIN=阴道内皮瘤样变,VaIN=外阴内皮瘤样变
图7 对照组与疫苗组高风险HPV相关感染与疾病发生率比较的森林图
Figure 7 Forest plot for comparison of the frequency of high-risk HPV-related infections and diseases between control group and vaccine group
2.3.7 注射部位相关不良反应发生率 共纳入6篇文献[15-17,21,26,29],各研究间无统计学异质性(P=0.39,I2=4%),故采用固定效应模型,Meta分析结果显示,疫苗组注射部位相关不良反应发生率高于对照组,差异有统计学意义〔OR=1.91,95%CI(1.74,2.10),P<0.000 01,见图8〕。
2.3.8 系统不良反应发生率 共纳入5篇文献[15-17,21,26],各研究间无统计学异质性(P=0.81,I2=0%),故采用固定效应模型,Meta分析结果显示,疫苗组与对照组系统不良反应发生率比较,差异无统计学意义 〔OR=1.06,95%CI(0.98,1.16),P=0.14,见图9〕。
2.3.9 严重不良反应发生率 共纳入8篇文献[11-12,15-17,21,26,29],各研究间无统计学异质性(P=0.84,I2=0%),故采用固定效应模型,Meta分析结果显示,疫苗组与对照组严重不良反应发生率比较,差异无统计学意义 〔OR=0.96,95%CI(0.77,1.20),P=0.73,见图10〕。
2.3.10 病死率 共纳入5篇文献[16-17,21,29-30],各研究间无统计学异质性(P=0.94,I2=0%),故采用固定效应模型,Meta分析结果显示,疫苗组与对照组病死率比较,差异无统计学意义 〔OR=1.25,95%CI(0.49,3.17),P=0.64,见图11〕。
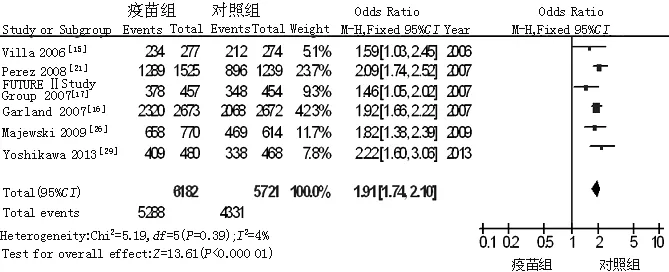
图8 对照组与疫苗组注射部位相关不良反应发生率比较的森林图
Figure 8 Forest plot for comparison of the frequency of injection site-related adverse reactions between control group and vaccine group
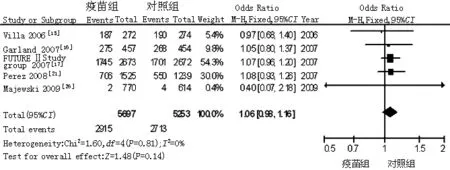
图9 对照组与疫苗组系统不良反应发生率比较的森林图
Figure 9 Forest plot for comparison of the frequency of systems adverse reactions between control group and vaccine group

图10 对照组与疫苗组严重不良反应发生率比较的森林图
Figure 10 Forest plot for comparison of the frequency of serious adverse reaction between control group and vaccine group
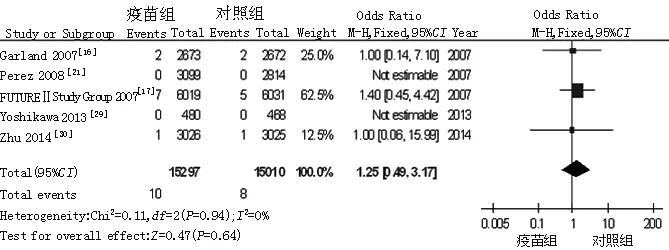
图11 对照组与疫苗组病死率比较的森林图
Figure 11 Forest plot for comparison of the mortality between control group and vaccine group
2.4 漏斗图偏倚分析 分别对关于CINⅡ+发生率、严重不良反应发生率的文献绘制漏斗图,结果显示,关于CINⅡ+发生率文献的漏斗图左右不对称,表明存在发表偏倚的可能性较大(见图12)。关于严重不良反应发生率文献的漏斗图左右对称,表明其存在发表偏倚可能性较小(见图13)。

图12 CINⅡ+发生率发表偏倚的漏斗图
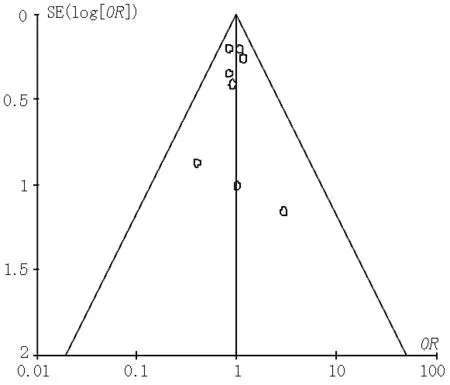
图13 严重不良反应发生率发表偏倚的漏斗图
3 讨论
生殖器HPV感染主要通过性接触传播,HPV具有很强的传播性,大多数性行为活跃的男性或女性均可能感染。某些HPV基因型的持续感染可以诱发生殖器官的癌前病变和癌症[31]。HPV 16、18是致癌性HPV,与70%的宫颈癌发生有关,HPV 6、11是2种非致癌性HPV,与75%~90%的外生殖器疣和呼吸道乳头状瘤发生有关[32-33]。以HPV感染为出发点研制疫苗是预防宫颈癌及HPV相关感染的方法之一。2006-06-08美国食品和药品管理局(FDA)批准MERCK公司的HPV 6/11/l6/18四价疫苗(Gardasil),2007-09-24欧盟委员会批准葛兰素史克公司的HPV 16/18二价疫苗(Cervarix)上市,预防经HPV亚型所引起的宫颈癌及生殖器病变效果显著,是医学和公共卫生领域的重大突破。
这2种疫苗能诱导高滴度抗体,是安全、有效的。尽管HPV疫苗的研发有一个良好的开端,但如何大范围地应用于临床,仍有很多工作需要去完善,如已上市的疫苗的安全性、免疫效果及交叉免疫预防效果如何,HPV疫苗开发的高耗资与有限市场的矛盾,由于认知缺乏人们对疫苗的疑惧使得我国HPV疫苗的发展受到一定限制。新疫苗的实施影响我国长期预算及健康结果,其对包括亚洲在内的全世界人群的远期疗效及安全性等问题需要进一步研究来证明。鉴于此,本研究通过检索HPV疫苗相关的RCT,采用Meta分析方法进行系统评价,希望通过增大样本量来提高结果的可靠性,为我国制定HPV疫苗的免疫策略提供重要证据支持,为疫苗接种获得满意的效果提供理论保障。
宫颈癌的发生和发展是一个缓慢的过程,患者从初次感染HPV到发展为浸润性宫颈癌的平均时间为(12.0±2.9)年[34]。那么,HPV疫苗有效性的评估不可能将宫颈癌作为终点指标,而CIN及原位腺癌(AIS)是宫颈癌直接的也是必经的癌前病变。世界卫生组织和FDA将CINⅡ+作为主要终点指标来评价HPV疫苗的预防效果[35-37]。而HR-HPV的持续感染,是引起宫颈癌及其癌前病变的重要影响因素[38-39],故本研究将HPV持续性感染作为另外一个主要终点指标。HPV疫苗疗效分析是在PP人群和ITT人群中进行的。
结合国内外文献,本Meta分析纳入了23篇RCT,均详细描述了随机、对照、双盲的实施过程,设计严密,样本量大。入选的受试者同质性好,在年龄、种族、干预措施等基线特征方面无差异,选择偏倚较小。入选的各研究指标比较一致,随访率高。且采用ITT,有效避免了各种偏倚,均属高质量研究。因部分文献基本资料和质量评价一致,故合并列出。Meta分析结果显示,HPV疫苗可显著降低CINⅡ+、HPV持续性感染、外生殖器疣、VINⅡ+/ VaINⅡ+发生率,同时对HR-HPV所引起的CINⅡ+、CINⅠ+、外生殖器病变也有交叉保护效果。
预防性HPV疫苗安全性分析中可见,疫苗组注射部位相关不良事件包括局部红肿、疼痛及麻木较对照组常见,但是大多数不良反应比较短暂,多为轻度。接种HPV疫苗后系统不良反应报道最多的有头痛、眩晕、体温升高、疲乏、肌痛等,与对照组相似,大多为轻中度,而且局部和系统不良反应的发生率并不随着接种剂量的增加而增加。严重不良反应发生率及病死率在疫苗组和对照组保持均衡。
本研究尚存在一定的局限性:(1)本研究中,关于HPV疫苗保护效果研究达到纳入标准的文献不足被检索到文献总数的4%。这可能与入选标准,特别是研究设计的严格限制有关。(2)研究结果存在异质性。HPV疫苗不同制备方法可能对研究结果有影响,HPV疫苗的有效性与随访时间及随访的依从性有一定关系。但大多数原始文献对此进行ITT。(3)感染HPV到进展为宫颈癌的时间较长,因道德因素限制,无法得到HPV疫苗降低宫颈癌发病率及病死率的确切证据,需要获得更多信息或开展更多更久的研究后进行分析。故今后在HPV疫苗的临床研究中应注意以下几点:(1)需要开展更多前瞻性、高质量、大样本、多中心的RCT,并详尽记录长期随访结果以利于进一步评估其远期疗效,以提供HPV疫苗预防宫颈癌的直接证据。(2)对HPV疫苗有效性研究时,可扩大研究对象年龄宽度,并行不同年龄段之间有效性的比较。
综上所述,HPV疫苗可显著降低CINⅡ+、HPV持续性感染、外生殖器疣发生率,同时,预防性HPV疫苗对于HR-HPV所引起的CINⅡ+、CINⅠ+、外生殖器病变也有交叉保护效果,因此,预防性HPV疫苗是安全、有效的,可以减少因持续性感染引起的宫颈癌及HPV相关感染与疾病发生率,降低疾病负担,具有良好的公共卫生意义和社会效应。然而,现有报道尚未证明HPV疫苗预防宫颈癌的远期疗效,不能提供HPV疫苗预防宫颈癌及外阴癌的直接证据,有待开展更多设计严谨的高质量RCT进一步验证,并尽可能延长随访时间以观察长期疗效。
[1]Kjrnbauer R,Scbellenbacher C,Shafti-Keramat S,et al.HPV infections[J].Hautarzt,2009,60(11):878-880.
[2]Mougin C,BourgauIt-Vi1lada I,Coursaget P.HPV immunization for the prevention of cervical cancer[J].Presse Med,2009,38(12):1750-1768.
[3]丰有吉,沈铿,马丁,等.妇产科学[M].2版.北京:人民卫生出版社,2010:325-331.
[4]World Health Organization.Vaccine position papers on human papillomavirus vaccine[J].WER,2008,58(15):118-131.
[5]Lu B,Kumar A,Castellsagué X,et al.Efficacy and safety of prophylactic vaccines against cervical HPV infection and diseases among women:a systematic review & meta-analysis[J].BMC Infect Dis,2011,11(1):1-16.
[6] Higgins JPT,Green S.Cochrane handbook for systematic reviews of interventions version 5.1.0.[2014-08-21].The Cochrane Collaboration,2011.www.cochrane-handbook.org.
[7] Review Manager(RevMan)[CP].Version 5.2.Copenhagen:The Nordic Cochrane Centre,The Cochrane Collaboration,2012.
[8]Koutsky LA,Ault KA,Wheeler CM,et al.A controlled trial of a human papillomavirus type 16 vaccine[J].N Engl J Med,2002,347(21):1645-1651.
[9]Mao C,Koutsky LA,Ault KA,et al.Efficacy of human papillomavirus-16 vaccine to prevent cervical intraepithelial neoplasia:a randomized controlled trial[J].Obstet Gynecol,2006,107(1):18-27.
[10] Harper DM,Franco EL,Wheeler C,et al.Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with human papillomavirus types 16 and 18 in young women:a randomized controlled trial[J].Lancet,2004,364(13):1757-1765.
[11]Harper DM,Franco EL,Wheeler CM,et al.Sustained efficacy up to 4.5 years of a bivalent L1 virus-like particle vaccine against human papillomavirus types 16 and 18:follow-up from a randomized control trial[J].Lancet,2006,367(9518):1247-1255.
[12]Harper DM.Impact of vaccination with CervarixTMon subsequent HPV-16/18 infection and cervical disease in women 15-25 years of age[J].Gynecol Oncol,2008,110(3 suppl 1):S11-17.
[13]Roteli-Martins C,Naud P,De Borba P,et al.Sustained immunogenicity and efficacy of the HPV-16/18 AS04-adjuvanted vaccine:up to 8.4 years of follow-up[J].Hum Vaccin Immunother,2012,8(3):390-397.
[14] Villa LL,Costa RLR,Petta CA,et al.Prophylactic quadrivalent human papillomavirus(types 6,11,16 and 18) L1 virus-like particle vaccine in young women:a randomized double-blind placebo-controlled multicentre phase Ⅱ efficacy trial[J].Lancet Oncol,2005,6(5):271-278.
[15]Villa LL,Costa RLR,Petta CA,et al.High sustained efficacy of a prophylactic quadrivalent human papillomavirus types 6/11/16/18 L1 virus-like particle vaccine through 5 years of follow-up[J].Br J Cancer,2006,95(11):1459-1466.
[16] Garland SM,Hernandez-Avila M,Wheeler CM,et al.Quadrivalent vaccine against human papillomavirus to prevent anogenital diseases[J].N Engl J Med,2007,356(19):1928-1943.
[17] FUTURE Ⅱ Study Group.Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions[J].N Engl J Med,2007,356(19):1915-1927.
[18]Paavonen J,Jenkins D,Bosch FX,et al.Efficacy of a prophylactic adjuvanted bivalent L1 virus-like-particle vaccine against infection with human papillomavirus types 16 and 18 in young women:an interim analysis of a phase Ⅲ double-blind,randomised controlled trial[J].Lancet,2007,369(9580):2161-2170.
[19] Paavonen J,Naud P,Salmerón J,et al.Efficacy of human papillomavirus(HPV)-16/18 AS04-adjuvanted vaccine against cervical infection and precancer caused by oncogenic HPV types(PATRICIA):final analysis of a double-blind,randomised study in young women[J].Lancet,2009,374(9686):301-314.
[20]Lehtinen M,Paavonen J,Wheeler CM,et al.Overall efficacy of HPV-16/18 AS04-adjuvanted vaccine against grade 3 or greater cervical intraepithelial neoplasia:4-year end-of-study analysis of the randomised,double-blind PATRICIA trial[J].The Lancet Oncology,2012,13(1):89-99.
[21]Perez G,Lazcano-Ponce E,Hernandes-Avila M,et al.Safety,immunogenicity,and efficacy of quadrivalent human papillomavirus(types 6,11,16,18) L1 virus-like-particle vaccine in Latin American women[J].Int J Cancer,2008,122(6):1311-1318.
[22]Konno R,Tamura S,Dobbelaere K,et al.Efficacy of human papillomavirus 16/18 AS04-adjuvanted vaccine in Japanese women aged 20 to 25 years:interim analysis of a phase 2 double-blind,randomized,controlled trial[J].Int J Gynecol Cancer,2010,20(3):404-410.
[23]Konno R,Tamura S,Dobbelaere K,et al.Efficacy of human papillomavirus type 16/18 AS04-adjuvanted vaccine in Japanese women aged 20 to 25 years:final analysis of a phase 2 double-blind,randomized controlled trial[J].Int J Gynecol Cancer,2010,20(5):847-855.
[24]Kjaer SK,Sigurdsson K,Iversen OE,et al.A pooled analysis of continued prophylactic efficacy of quadrivalent HPV(types 6/11/16/18) vaccine against high-grade cervical and external genital lesions[J].Cancer Prev Res(Phila),2009,2(10):868-878.
[25]Munoz N,Kjaer SK,Sigurdsson K,et al.Impact of human papillomavirus(HPV)-6/11/16/18 vaccine on all HPV-associated genital diseases in young women[J].J Natl Cancer Inst,2010,102(5):325-339.
[26]Majewski S,Bosch FX,Dillner J,et al.The impact of a quadrivalent human papillomavirus(types 6,11,16,18) virus-like particle vaccine in European women aged 16 to 24[J].J Eur Acad Dermatol Venereol,2009,23(10):1147-1155.
[27]Herrero R,Wacholder S,Rolomon AC,et al.Prevention of persistent human papillomavirus infection by an HPV16/18 vaccine:a community-based rRandomized clinical tTrial in Guanacaste,Costa Rica[J].Cancer Discov,2011,1(5):408-419.
[28]Clark LR,Myers ER,Huh W,et al.Clinical trial experience with prophylactic human papillomavirus 6/11/16/18 vaccine in young black women[J].Journal of Adolescent Health,2013,52(3):322-329.
[29]Yoshikawa H,Ebihara K,Tanaka Y,et al.Efficacy of quadrivalent human papillomavirus(types 6,11,16 and 18) vaccine(GARDASIL) in Japanese women aged 18-26 years[J].Cancer Sci,2013,104(4):465-472.
[30]Zhu FC,Chen W,Hu YM,et al.Efficacy,immunogenicity and safety of the HPV-16/18 AS04-adjuvanted vaccine in healthy Chinese women aged 18-25 years:results from a randomised controlled trial[J].Int J Cancer,2014,135(11):2612-2622.
[31]Walboomers JM,Jacoks MV,Manosos MM,et al.Human papillomavirus is a necessary cause of invasive cervical cancel worldwide[J].J Patbol,1999,189(1):12-19.
[32]Clavel CE,Nawrocki B,Bosseaux B,et al.Detection of human papillomavirus DNA in bronchopulmonary carcinomas by hybrid capture Ⅱ:a study of 185 tumors[J].Cancer,2000,88(6):1347-1352.
[33] Major T,Szarka K,Sziklai I,et al.The characteristics of human papillomavirus DNA in head and neck cancers and papillomas[J].J Clin Pathol,2005,58(1):51-55.
[34]Jacobs MV,Zielinski D,Meijer CJ,et al.A simplified and reliable HPV testing of archival Papanicolaou-stained cervical smears:application to cervical smears from cancer patients starting with cytologically normal smears[J].Br J Cancer,2000,82(8):1421-1426.
[35]ASCUS-LSIL Traige Study(ALTS) Group.Results of a randomized trial on the management of cytology interpretations of atypical squamous cells of undetermined significance[J].Am J Obstet Gynecol,2003,188(6):1383-1392.
[36]Pagliusi SR,Teresa Aguado M.Efficacy and other milestones for human papillomavirus vaccine introduction[J].Vaccine,2004,23(5):569-578.
[37]Wright TC Jr,Cox JT,Massad LS,et al.2001 consensus guidelines for the management of women with cervical intraepithelial neoplasia[J].Am J Obstet Gynecol,2003,189(1):295-304.
[38] Bosch FX,Lorincz A,Munoz N,et al.The causal relation between human papillomavirus and cervical cancer[J].J Clin Pathol,2002,55(4):244-265.
[39] Chavel C,Masure M,Bory JP,et al.Human papillomavirus testing in primary screening for the detection of high-grade cervical lesions:a study of 7932 women[J].Br J Cancer,2001,84(12):1616-1623.
修回日期:2015-02-21)
(本文编辑:陈素芳)
Efficacy and Safety of Prophylactic Human Papillomavirus Vaccine in Preventing Cervical Cancer and HPV-ralated Infection Prevention:A Meta-analysis
YANGLi,HEYan,MACai-ling.
DepartmentofGynaecology,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830054,China
Objective To assess efficacy and safety of prophylactic human papillomavirus(HPV) vaccines in preventing cervical cancer and HPV-related infection,a systematic review and meta-analysis were conducted.Methods Searched in PubMed,EMBase,Cochrane Library,OVID,CBM,CNKI and Wanfang database to identify randomized controlled trials(RCT) on vaccines in preventing cervical cancer and HPV-related infection,and also manually searched relevant magazines and references,the time range for publishing dates of the literatures was from databases establishment to July 2014.According to the inclusion and exclusion criteria,two reviewers independently screened studies,extracted data,and evaluated the quality of studies.The meta-analysis was performed using RevMan software version 5.2.Results 23 RCTs were included.According to the meta-analysis results,the frequency of CINⅡ+,VINⅡ+/VaINⅡ+,6-months persistent HPV infections,12-months persistent HPV infections,exophytic genital wart,high-risk HPV-related infections and diseases in vaccine group was significantly lower than that in control group,respectively(P<0.05).For plan provisions(PP) group and intention-to-treat(ITT) group,the frequency of CINⅡ+,6-months persistent HPV infections,12-months persistent HPV infections,VINⅡ+/VaINⅡ+,exophytic genital wart,high-risk HPV-related infections and diseases in vaccine group was significantly lower than that in control group,respectively(P<0.05).Prevalence of the injection site-related adverse reactions in vaccine group was significantly higher than that in control group(P<0.05).There was no significant difference in prevalences of adverse reaction of the systems,serious adverse events and death between vaccine group and control group(P>0.05).Conclusion Prophylactic HPV vaccines are safe and effective in preventing cervical precancerous lesions,HPV persistent infections and HPV-related genital lesions,and have cross-protection effect and efficient protective effect.However,according to existing literature,long-term efficacy of HPV vaccines in preventing cervical cancer is not clear,due to the lack of direct evidence of prophylactic HPV vaccines in preventing cervical cancer,more high quality RCT with duration follow-up should be carried out.
Papillomavirus vaccines;Uterine cervical neoplasms;Precautions;Randomized controlled trial;Meta-analysis
国家自然科学基金资助项目(8110278);重大疾病医学重点实验室开放课题(SKLIB-XJMDR—2012-5)
830054新疆乌鲁木齐市,新疆医科大学第一附属医院妇科
马彩玲,830054新疆乌鲁木齐市,新疆医科大学第一附属医院妇科;E-mail:hymcl@sina.com
R 711.74
A
10.3969/j.issn.1007-9572.2015.12.013
基本情况临床试验(期) 国家/地区 发表年份(年) 研究对象年龄(岁) 性伴侣(个)疫苗类型 HPV分型 剂量(μg) 佐剂对比剂组成Koutsky[8]和Mao[9]Ⅲ美国2002、200616~25≤5单价1640AAHS安慰剂Harper[10-12]和Roteli-Martins[13]Ⅲ加拿大、美国、巴西2004、2006、2008、201215~25≤6二价16/1820/20AS04安慰剂Villa[14-15]Ⅱ巴西、欧洲、美国2005、200616~23≤4四价6/11/16/1820/40/40/20AAHS安慰剂Garland[16]Ⅲ亚洲太平洋地区等200716~24≤4四价6/11/16/1820/40/40/20AAHS安慰剂FUTUREⅡStudyGroup[17]Ⅲ-200715~26≤6四价6/11/16/1820/40/40/20AAHS安慰剂Paavonen[18-19]和Lehtinen[20]Ⅲ澳大利亚、比利时等2007、2009、201215~26≤4二价16/1820/20AS04甲型病毒性肝炎疫苗Perez[21]Ⅲ巴西、墨西哥等20089~24≤4四价6/11/16/1820/40/40/20AS04安慰剂Konno[22-23]Ⅱ日本2010、201020~25-二价16/1820/20AS04甲型病毒性肝炎疫苗Kjaer[24]Ⅲ-200916~26≤4四价6/11/16/1820/40/40/20AAHS安慰剂Munoz[25]Ⅲ澳大利亚、奥地利等201015~26≤4四价6/11/16/1820/40/40/20AAHS安慰剂Majewski[26]Ⅲ奥地利、丹麦等200916~24≤4四价6/11/16/1820/40/40/20AAHS安慰剂Herrero[27]--201118~25-二价16/1820/20AS04甲型病毒性肝炎疫苗Clark[28]Ⅲ-201316~24≤4四价6/11/16/1820/40/40/20AAHS安慰剂Yoshikawa[29]Ⅱ日本201318~26≤4四价6/11/16/1820/40/40/20AAHS安慰剂Zhu[30]Ⅱ/Ⅲ中国201418~25≤4二价16/1820/20AS04安慰剂
2014-08-26;

