大鼠鼠尾胶对小鼠胰岛细胞培养前后的形态及活性影响
陈慧慧 傅红兴 曹雄杰 何文萃 戴丹萍 邱凯燕 张伟
(1.温州医科大学药学院 浙江温州 325035;2.宁波大学医学院附属医院药剂科 浙江宁波 315000)
鼠尾胶原蛋白是一种在细胞培养板包被领域中应用广泛的生物材料,具有优越的生物相容性、高拉伸强度、生物可降解性、低抗原性[1],由于其特有的三重螺旋的氨基酸结构,使其还具有低细胞毒性、促进细胞生长、细胞贴附和迁移等特性,常用于贴壁细胞的培养[2]。鼠尾胶原主要为Ⅰ型胶原蛋白,来源广泛,制备方便,可作为开发其他相关功能性生物材料的原料。
本实验室自制了大鼠鼠尾胶原,并将其应用于小鼠胰岛细胞团的培养,进行了培养前后小鼠胰岛细胞团形态、活性的比较,以期获得其在小鼠胰岛细胞培养中的应用,为其在胰岛细胞移植中的应用奠定基础。
一、 材料
1. 实验动物:SD 大鼠10 只,雌雄不限,体重250 ~300 g;ICR 小鼠20 只,雄性,体重25 ~ 30 g,均由温州医科大学实验动物中心提供。
2.试剂和实验器材:胶原酶V、二乙酸荧光素(FD)、碘化吡啶(PI)(Sigma 公司,美国);胎牛血清(杭州四季青生物工程材料有限公司);Hanks 、低糖型DMEM 培养基(杭州吉诺生物医药技术有限公司);透析袋(分子量2000,美国);Ficoll-1077 和Ficoll-1119(温州市怡康细胞移植技术开发有限公司);其余试剂均为分析纯。
二、实验方法
1. 鼠尾生物胶的制备
取健康大鼠尾,75%酒精浸泡15 min,去皮,弯镊抽出尾腱在无水乙醇中脱水脱脂15 min;取1g,剪成1cm 左右,加入含1M NaCl 的0.05M Tirs/HCl (pH 7.5)溶液20 ml 进行前提取;4℃环境放置24 h,用Tirs/HCl 和生理盐水纯化;加入0.5M 乙酸400 ml ,4℃下放置4 天;将得到的粗制胶原液用20 %NaCl 液和生理盐水洗涤纯化,得到胶原沉淀物;将胶原沉淀物透析1 天,取胶原液;将精制胶原液5 ml/瓶分装于玻璃瓶中,冷冻干燥;用0.5M乙酸溶解鼠尾胶原冻干粉末配制成鼠尾胶原蛋白溶液,与DMEM 无糖基础培养液[3]混合均匀(1:4)后取2 ml注入35 mm 培养皿,用2M NaOH 调节pH 至中性;37℃恒温培养箱放置1 h,得到胶原蛋白凝胶。
2.小鼠胰岛的分离纯化
采用本实验室常用的方法分离小鼠胰岛[4],简述如下:取ICR 小鼠,颈椎脱臼后,逆行胆总管灌注Ⅴ型胶原酶溶液,取下胰腺后37±0.5℃恒温水浴中振摇消化至泥沙状,用Ficoll-1119 和Ficoll-1077 密度梯度分离液进行胰岛细胞纯化;洗涤后的胰岛细胞在体视显微镜下用移液枪分批挑至两种胰岛细胞培养液中,在37℃、5%CO2培养箱中与含鼠尾胶的培养液培养24 h,以不含鼠尾胶的培养液为对照。
3.胰岛的形态、活性评价
(1)FD-PI 溶液的配制
称取二乙酸荧光素(FD)2 mg,溶于200 mL 丙酮中,用铝箔纸包裹4℃避光保存;称取碘化吡啶(PI)12.5 mg,用25 mL DPBS 溶液溶解,用铝箔纸包裹-20℃避光保存。
(2)染色及活性计算
取含胰岛组织0.5 mL,加入PI、FD 各10 μL,稍混匀后避光室温下静置染色30 s 左右,在荧光显微镜下观察细胞染色情况,死亡的胰岛发红光,存活的胰岛发绿光;估算红色细胞占整个细胞团中的比例;数50 个胰岛细胞团的活性,取其平均值即为胰岛活性。
4.统计学分析
采用SPSS 11.0 统计学软件,所有数据采用均数
三、结果
1.大鼠鼠尾胶制备结果
大鼠鼠尾胶经精制和冻干后,得到的结果如下图1所示。
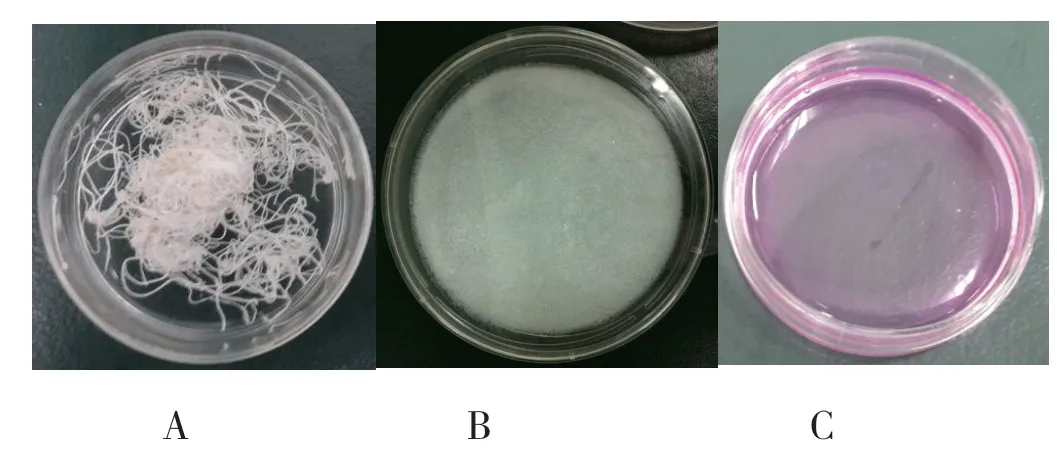
图1 大鼠的鼠尾腱、鼠尾胶冻干后和含鼠尾胶培养液样品
由图1 可见,大鼠鼠尾胶处理前为白色的不溶性肌腱(图1A),经过精制和冻干后,可得到白色的海绵状鼠尾胶蛋白(图2A),用细胞培养液溶解后的含鼠尾胶细胞培养液澄清透明,溶液略带胶黏状(图1C)。
2.小鼠胰岛新分离后的活性结果
新分离的小鼠胰岛呈圆形、椭圆形或不规则形,胰岛边缘清晰,直径为50 ~300 μm;将分离纯化的胰岛经FD-PI 染色后,用荧光显微镜下观察,可得胰岛的活性为90.2±1.6%,如下图2A。
3.小鼠胰岛与鼠尾胶培养后的活性
将胰岛细胞团加至含自制生物胶的胰岛细胞培养液中培养24 h 后观察活性,得到结果如下图2B 所示,以胰岛细胞与不含生物胶的培养液培养相同时间后的活性做对比(图2C),结果如下:

图2 小鼠胰岛细胞经自制鼠尾胶胶培养24 h 前后的活性比较(FD-PI 染色)
由上图结果可知,培养后的胰岛外形依然圆整,边缘清晰;与培养前的胰岛活性相比较,含鼠尾胶的培养液培养后的胰岛活性为91.3±1.7%,不含鼠尾胶的培养液培养后的胰岛活性为89.6±3.6%,但两者无统计学差异(p>0.05)。由此可知,含鼠尾胶培养的胰岛细胞24n 内活性良好。
四、 讨论
良好的细胞活性是胰岛细胞培养和移植研究的基础。由本研究可得,本方法制备的鼠尾胶结合低糖型DMEM 培养液,培养的胰岛细胞团紧实,活性好,可用于培养胰岛细胞。
[1] 任海涛, 钟志勇, 郑佳琳, 等. 鼠尾胶原蛋白提取、 分离、纯化方法的建立及鉴定[J].中国比较医学杂志,2012,22(11):50-53
[2]Montanez E,Casaroli-Marano RP,Vilaro S.et al.Comparative study of tube assembly in three dimensional collagen matrix and on Matrigel coats[J].Angiogenesis,2002,5(3):167-172.
[3]崔晨威,傅红兴,吴岚岚,等.两种培养液对小鼠胰岛细胞培养后的形态和功能的影响[J].生物技术世界.2015,(01):69-70.
[4]叶丛丛,傅红兴,江铃,等.一种快速分离纯化小鼠胰岛的方法[J].肝胆胰外科杂志.2014,26(5):403-405.

