重型颅脑损伤行肠外营养支持患者血糖控制的研究
曾梁楠 杨昌美 江涌 罗世洪 黄雨佳 罗庆莲
(1.四川医科大学,四川 泸州 646000;2.四川医科大学附属第一医院,四川 泸州 646000)
重型颅脑损伤行肠外营养支持患者血糖控制的研究
曾梁楠1,2杨昌美2江涌2罗世洪1黄雨佳1罗庆莲2
(1.四川医科大学,四川 泸州 646000;2.四川医科大学附属第一医院,四川 泸州 646000)
目的 通过控制重型颅脑损伤患者行肠外营养支持时的血糖水平,以减少高血糖、高甘油三酯血症和电解质失衡等并发症的发生。方法 采用前瞻性随机对照研究法,把行肠外营养支持的66例重型颅脑损伤患者随机分为治疗组和对照组,各33例。治疗组患者持续输注胰岛素,使血糖水平控制在4.4~6.6 mmol/L之间;对照组患者血糖水平高于11.0 mmol/L时接受胰岛素治疗。对比两组患者的血糖水平、上臂周径、C反应蛋白、血脂、肝功能和电解质。结果 治疗组平均血糖水平低于对照组(P<0.05);治疗组甘油三酯和C反应蛋白均低于对照组(P<0.05);两组电解质比较有差异,治疗组镁和磷低于对照组(P<0.05)。结论 重型颅脑损伤患者行肠外营养支持治疗时血糖水平控制在4.4~6.6 mmol/L之间有利于改善患者的营养状况,能减少并发症的发生。
重型颅脑损伤; 血糖控制; 肠外营养; 并发症
重型颅脑损伤患者受伤早期由于基础代谢增高出现低蛋白血症以及因意识障碍而无法进食等情况,行肠外营养旨在通过静脉为营养不良的患者提供营养支持,起源于宾夕法尼亚大学医学院[1-2]。但它可引起高血糖、高甘油三酯血症、电解质失衡和脂肪变性等代谢改变,且其引起的高血糖可加重患者的继发性脑损伤,影响患者神经功能的恢复[3-4]。近年来,随着对营养支持认识的增加,在实施营养支持时人们越来越重视血糖监测[5-6]。本研究于2013年9月-2014年8月使用江苏华瑞制药公司生产的脂肪乳氨基酸(17)葡萄糖(11%)注射液(商品名:卡文)对我科重型颅脑损伤患者实施肠外营养支持,观察此过程中不同的血糖控制方法对患者的影响。现报告如下。
1 资料与方法
1.1 一般资料 选择我科2013年9月-2014年8月收治的、经临床和头颅CT证实为重型颅脑损伤的患者66例,其中,男28例,女38例,且符合以下条件:(1)格拉斯哥评分(GCS)为3~8分。(2)年龄≥18岁。(3)使用卡文行肠外营养支持。(4)在我科住院≥14 d。排除标准:(1)GCS>8分。(2)年龄<18岁。(3)肝、肾、胰腺或心脏功能衰竭患者。(4)在我科住院天数在14 d以内。(5)Ⅰ型或Ⅱ型糖尿病患者。按入院顺序将66例患者随机分为治疗组和对照组,各33例。两组患者年龄、性别、GCS评分、入组血糖水平及观察指标基线值比较差异均无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 治疗组 治疗组患者在输注卡文时使用输液泵对患者持续泵入胰岛素(0.9%生理盐水50 mL+50 IU诺和灵R),每小时对患者手指末端血糖进行监测,根据血糖水平调节泵速以控制患者血糖水平在4.4~6.6 mmol/L之间。为防止低血糖的发生,当患者血糖低于4.4 mmol/L时,立即停止胰岛素的泵入;若患者血糖持续下降且低于2.8 mmol/L时,则按照低血糖处理原则进行处理。
1.2.2 对照组 对照组患者所使用肠外营养液与治疗组相同,每小时对患者手指末端血糖进行监测,使用卡文期间当患者血糖值高于11.0 mmol/L时才接受胰岛素治疗,根据患者血糖水平采用不同剂量胰岛素,半小时后复测血糖按所得值进行相应处理,直至患者血糖低于11.1 mmol/L。
1.3 监测指标 对患者血糖实行长期监测,在使用卡文后的第7、14天监测患者的上臂周径、C反应蛋白、血脂(总胆固醇、低密度脂蛋白、高密度脂蛋白、甘油三酯)、电解质(镁、磷)和肝功能(丙氨酸转氨酶、天冬氨酸转氨酶、总胆红素、乳酸脱氢酶)。

2 结果
使用卡文后治疗组平均血糖水平(5.56±1.56) mmol/L比对照组(9.67±1.72) mmol/L低,差异有统计学意义(P<0.01)。在监测的第7天两组间所有的监测变量差异均无统计学意义(P>0.05);在第14天治疗组的C反应蛋白值、甘油三酯浓度较对照组低(P<0.01),镁和磷的值也较对照组低(P=0.02,P<0.01),高密度脂蛋白较对照组有所增加(P<0.01),治疗组上臂周径经胰岛素强化治疗后较之前有增加,而对照组呈下降趋势。见表1。
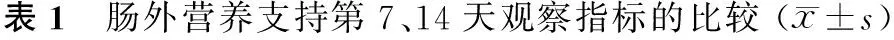
观察指标治疗组第7天第14天对照组第7天第14天F第7天第14天P第7天第14天上臂周径/cm23.48±3.0623.63±2.8623.95±3.1523.57±2.850.380.010.540.95C反应蛋白/mg·L-161.01±28.3840.55±21.3271.92±31.1378.65±30.682.2234.320.14<0.01总胆固醇/mmol·L-14.12±0.774.12±0.774.23±0.764.32±0.760.370.370.550.55高密度脂蛋白/mmol·L-11.62±0.451.83±0.381.52±0.431.55±0.420.898.170.35<0.01低密度脂蛋白/mmol·L-12.14±0.392.43±0.432.07±0.342.55±0.440.561.240.460.27甘油三酯/mmol·L-11.03±0.180.97±0.171.09±0.211.18±0.231.7918.170.19<0.01谷草转氨酶/U·L-188.78±49.3488.36±48.7177.92±48.4877.35±48.020.810.850.370.36谷丙转氨酶/U·L-171.79±42.0867.98±40.3676.18±47.0969.99±43.180.160.040.690.85总胆红素/umol·L-116.42±8.6614.84±7.7918.82±9.2715.27±7.641.180.050.280.82乳酸脱氢酶/U·L-1968.03±524.071003.91±548.961162.08±579.571103.49±553.622.040.540.160.47镁/mmol·L-10.81±0.280.81±0.280.87±0.290.99±0.330.635.640.430.02磷/mmol·L-11.26±0.341.32±0.351.37±0.341.63±0.411.7110.620.20<0.01
3 讨论
目前重型颅脑损伤的发生率和死亡率居高不下,已成为部分国家或地区面临的一重大公共健康问题[7]。Frankenfield D等[8-9]研究表明重型颅脑损伤患者多处于高代谢和高分解状态,所需基础热量和蛋白质消耗较常人多,常规营养不能满足患者机体需要。本研究根据患者机体状态补充能量和蛋白质等提供合理肠外营养支持,以维持患者脑组织的血流灌注和脑氧合,减轻脑组织的缺血缺氧,降低致残率和死亡率,改善临床预后[10-11]。但肠外营养支持可引起多种并发症,特别是其引起的高血糖可加重继发性脑损伤[4],而Van den Berghe G 等[12]对1 548例机械通气危重患者的研究表明患者血糖水平控制在4.4~6.6 mmol/L之间能有效降低并发症的发生率和死亡率。因此治疗组患者行肠外营养支持时,血糖水平控制在4.4~6.6 mmol/L之间。
本研究过程中治疗组患者在使用卡文时通过泵入胰岛素控制患者血糖接近正常水平并未导致肠外营养所致的高血糖、高甘油三酯血症和电解质失衡等并发症的发生,有利于改善患者的营养状况。使用卡文后因使用时间短两组患者上臂周径差异无统计学意义,但治疗组患者上臂周径呈增加趋势,这可能与胰岛素的合成代谢功能及其参与脂肪、蛋白质合成有关[13]。治疗组和对照组患者C反应蛋白虽都高于正常值,但治疗组C反应蛋白较对照组呈降低趋势(P<0.01),与Olveira G等[14]所研究结果一致,可能是因治疗组患者血糖水平低于对照组所致。由于胰岛素作为一种激素可将电解质从血液转到细胞从而降低血液中电解质,所以治疗组镁和磷的浓度降低(P=0.02,P<0.01)。研究结果还显示治疗组患者血糖水平低于观察组,这使得脂蛋白脂酶活性的增加,从而在破坏甘油三酯颗粒的同时增加高密度脂蛋白(P<0.01),因此不难看出高密度脂蛋白和患者血糖水平呈负相关,这与Liop J[15]等所得研究结论相似。
由此可见,重型颅脑损伤患者在实施肠外营养支持时,把血糖水平控制在4.4~6.6 mmol/L之间符合患者的生理机制,有利于改善患者的营养状况,减少高血糖、高脂血症等并发症的发生。但本研究作为重型颅脑损伤患者肠外营养支持时行胰岛素治疗的初步研究,目前只关注于患者第7天和第14天的各项指标的改变,在今后的研究中还应重点观察患者后续的致残率和死亡率等信息,并应做好随访和资料收集等工作。
[1] 王国锋,王国荣,周昆.重型颅脑损伤昏迷患者的营养支持[J].中国中西医结合急救杂志,2012,19(3):152-155.
[2] Brokenshire E,Plank LD,Gillanders LK,et al.Adult total parenteral nutrition at Auckland City Hospital:a 6-year review[J].N Z Med J,2009,122(1297):17-24.
[3] Mousavi SN,Samini F,Nematy M,et al.Hyperglycemia and antibody titres against heat shock protein 27 in traumatic brain injury patients on parenteral nutrition[J].Iran J Basic Med Sci,2014,17(2):119-122.
[4] Singer P,Berger MM,Van den Berghe G,et al.ESPEN Guidelines on Parenteral Nutrition:intensive care[J].Clin Nutr,2009,28(4):387-400.
[5] 丁学敏,贺占海,徐建波.早期肠内营养支持在重型颅脑损伤患者中的应用及对预后的影响[J].现代中西医结合杂志,2014,23(22):2478-2480.
[6] 刘飞,廖达光,张天一,等.肠外肠内联合营养对老年重型颅脑外伤病人预后的影响[J].肠外与肠内营养,2006,13(5):295-298.
[7] Chourdakis M,Kraus MM,Tzellos T,et al.Effect of early compared with delayed enteral nutrition on endocrine function in patients with traumatic brain injury:an open-labeled randomized trial[J].JPEN J Parenter Enteral Nutr,2012,36(1):108-116.
[8] Frankenfield D.Energy expenditure and protein requirements after traumatic injury[J].Nutr Clin Pract,2006,21(5):430-437.
[9] Kalsbeek WD,McLaurin RL,Harris BS,et al.The National Head and Spinal Cord Injury Survey:major findings[J].J Neurosurg.1980,Suppl:S19-31.
[10] Adam MD,Rupinder D,Andrew GD,et al.Comparisons between intragastric and small intestinal delivery of enteral nutrition in the critically ill:a systematic review and meta-analysis[J].Crit Care,2013,17(3):R125.
[11] Wang X,Dong Y,Han X,et al.Nutritional support for patients sustaining traumatic brain injury:a systematic review and meta-analysis of prospective studies[J].PLoS One,2013,8(3):e58838.
[12] van den Berghe G,Wouters P,Weekers F,et al.Intensive insulin therapy in critically ill patients[J].N Engl J Med,2001,345(19):1359-1367.
[13] Frontera JA.Intensive versus conventional insulin therapy in critically ill neurologic patients:still searching for the sweet spot[J].Neurocrit Care,2010,13(3):295-298.
[14] Study Group of Hyperglycemia In Parenteral Nutrition Nutrition Area of The Spanish Society of E,Nutrition S,Olveira G,et al.Prevalence of diabetes,prediabetes,and stress hyperglycemia:insulin therapy and metabolic control in patients on total parenteral nutrition(prospective multicenter study)[J].Endocr Pract,2015,21(1):59-67.
[15] Krinsley JS.Association between hyperglycemia and increased hospital mortality in a heterogeneous population of critically ill patients[J].Mayo Clin Proc,2003,78(12):1471-1478.
Glycemic control for severe brain injury patients with parenteral nutrition support
Zeng Liangnan1, Yang Changmei2,Jiang Yong1, Luo Shihong1, Huang Yujia1, Luo Qinglian1
(1,SichuanMedicalUuniversity,SichuanLuzhou646000 , 2,TheFirstAffiliatedHospitalofSichuanMedicalUniversity,SichuanLuzhou646000 )
Objective To control the blood glucose levels for patients with severe traumatic brain injury when implemented of parenteral nutrition,and to reduce the incidence of high blood glucose, high triglycerides and electrolyte imbalance and other complications. Method A randomized controlled prospective assessment was designed. 66 cases of severe traumatic brain injury patients with parenteral nutrition were randomly divided into treatment group and control group, 33 cases respectively. Patients in treatment group was given continuous infusion of insulin to maintain blood glucose levels between 4.4~6.6 mmol/L. Patients in control group were not received insulin unless glucose levels were greater than 11.0 mmol/L . Blood glucose, mid-arm circumference, C-reactive protein, lipid profile, liver function test and blood electrolytes were measured and compared. Result The average blood glucose levels of treatment group was less than that of the control group (P<0.05). Mid-arm circumference and C-reactive protein for treatment group were lower than that of the control group (P<0.05); There were significant differences in the electrolytes, with magnesium and phosphorus being lower in the treatment group (P<0.05). Conclusion Patients with severe brain injury when under parenteral nutrition support control blood glucose levels between 4.4~6.6 mmol / L will help to improve the nutritional status of patients and reduce the incidence of complications.
Severe brain injury; Blood glucose control; Parenteral nutrition; Complication
曾梁楠(1989-),女,四川内江,硕士在读,研究方向:外科护理
杨昌美,E-mail:myycm6406@yeah.net
R473.6
A
1002-6975(2015)22-2023-03
2015-03-20)

