三七总皂苷对大鼠大脑缺血再灌注VEGF表达的影响
蒋会慧
(安徽医科大学药理学教研室 亳州职业技术学院药学院,安徽 亳州 236800)
王园园
(亳州职业技术学院药学院,安徽 亳州 236800)
胡东华
(安徽医科大学药理学教研室,安徽 合肥 230032)
江荣炎
(亳州市人民医院心血管内科,安徽 亳州 236800)
三七总皂苷对大鼠大脑缺血再灌注VEGF表达的影响
蒋会慧
(安徽医科大学药理学教研室亳州职业技术学院药学院,安徽 亳州 236800)
王园园
(亳州职业技术学院药学院,安徽 亳州 236800)
胡东华
(安徽医科大学药理学教研室,安徽 合肥 230032)
江荣炎
(亳州市人民医院心血管内科,安徽 亳州 236800)
[摘要]目的:观察三七总皂苷(PNS)对预处理大鼠大脑缺血再灌注后血管内皮细胞生长因子( VEGF)表达的影响。方法:将48只SD大鼠随机平均分为假手术组、模型组、PNS组和尼莫地平对照组。预给大鼠PNS 7d后,制备大鼠局灶性脑缺血再灌注模型。观察各组大鼠神经功能评分及大脑TTC染色,从VEGF的角度检测免疫组化和mRNA水平表达情况。结果: PNS可以显著改善大鼠神经功能评分和降低脑梗死体积,并可增加VEGF蛋白表达和上调VEGF mRNA表达水平。结论:PNS能有效上调脑缺血再灌注损伤后VEGF mRNA浓度的表达,促进缺血区血管新生。
[关键词]三七总皂苷(PNS); 脑缺血; 再灌注损伤;血管内皮细胞生长因子( VEGF)
缺血性脑血管病(Ischemic Cerebral Vascular Disease,ICVD)是一种严重威胁人类健康的心脑血管疾病,占脑血管病的60%~80%。随着当今社会的老龄化,其发病率在不断增高,如何有效的降低死亡率和致残率是治疗该类疾病的核心问题。三七总皂苷(Panax notoginseng saponin, PNS) 是五加科植物三七的主要活性成分,也是临床治疗心脑血管病药物血栓通注射液的主要成份。PNS中三七皂苷R1、人参皂苷Rb1、Rg1、Rd和Re约占总皂苷含量的80%[1],具有防止脂质沉积、抑制血管平滑肌细胞增殖、促纤溶及抑制血小板聚集、促进微循环、抗动脉粥样硬化和保护心肌等作用[2,3]。血管内皮细胞生长因子( VEGF) 又称血管通透性因子( VPF) ,可特异性地作用于血管内皮细胞, 促进血管内皮细胞的新生,并增加其通透性。本实验以脑缺血再灌注损伤中VEGF mRNA表达水平为切入点,在大鼠大脑中动脉闭塞(middle cerebral artery occlusion ,MCAO)再灌注模型上观察PNS对VEGF表达的影响,旨在探讨PNS在缺血性脑血管病治疗与恢复中的作用机制。
1材料与方法
1.1实验动物
SD雄性大鼠,SPF级,质量180~220g,安徽医科大学实验动物中心提供(动物合格证号:SCXK( 皖) 2005-001)。动物常规喂养,自由饮水;饲养室光10h,黑暗14h,温度21~25 ℃,湿度30%~70%。
1.2药物和主要试剂
PNS,丽珠集团利民制药厂(批号:ZZ-5802, 粤卫药准字( 1994) 第801313号),使用时用生理盐水配成质量浓度为2.5g/L。阳性对照药尼莫地平注射液(浙江一新制药股份有限公司,批号:01092001,规格20mg/100mL ),使用时用生理盐水配成质量浓度为0.1mg/mL[4]。红四氮唑( 2, 3, 5-Triph-enyltetrazoliumchloride,TTC,中国医药集团上海化学试剂公司,批号20010201) ;RNApure 超纯总RNA快速提取试剂盒(博迈德生物);VEGF抗大鼠一抗购自Santa Crutz公司;Trans Script TM One-Step RT-PCR Super Mix(北京全式金生物技术有限公司);兔SP免疫组化试剂盒、DAB显色剂购自北京中杉生物制剂公司;Fast SYBR@Green Master Mix (Applied Biosystems);其他试剂均为市售分析纯。
1.3分组与给药
雄性大鼠48只按体重随机分为4组,即假手术组、模型组、PNS组和尼莫地平对照组(每组12只)。各组大鼠预给药7d,1次/d,PNS给药剂量为2.5g/L,尼莫地平注射液给药剂量为0.1mg/mL,均为临床等效剂量[4];以同等体积的生理盐水给予假手术组和模型组。
1.4模型建立及标本采集
参照Longa等[5]的线栓改良法制备大鼠左侧大脑MCAO局灶性脑缺血模型。采用10% 水合氯醛 ( 350mg/kg,ip) 麻醉大鼠,制备脑缺血再灌注模型;缺血2h后再灌注24h,仰卧位固定大鼠,将线栓轻轻外抽,实现再灌注,剪断线栓。剔除死亡及不符合标准的动物,苏醒后行走向左旋转或左侧肢体瘫痪的大鼠为栓堵或者再灌注成功。假手术组仅分离血管。大鼠于造模成功后,断头处死,取脑组织,按检测指标要求的不同贮存于甲醛或液氮中。
1.5观察指标
1)神经行为评分(NBS)。采用Longa评分法[5]。 0分:无神经功能缺失症状;1分:轻度局造性神经功能缺失(不能完全伸展左侧前肢);2分:中度神经功能缺失(向左侧转圈);3分:重度神经功能缺失(向左侧倾倒);4分:不能自发行走,意识水平降低。
2)TTC染色,观察脑梗死体积。脑缺血再灌注24h后,将大鼠断头取大脑,将完整的大脑置于盛生理盐水的培养皿,沿冠面均匀切成厚约2mm的五片脑组织,迅速移至用生理盐水配制的2% TTC液体,避光染色,37℃孵育0.5h。摇动培养皿以充分反应,脑片中正常组织被染成红色,梗死组织呈白色,30min后将脑组织从孵育的培养皿中拿出,置于4%多聚甲醛溶液中,换液两次,4℃冰箱固定24h,用相机拍下记录[6]。
3)免疫组化测定。每组取3只做免疫组化鉴定,用免疫组化染色(ABC法)[7],组织薄片以PBS(0.01mol/L)漂洗2次, 0.3%过氧化氢孵育10min; PBS漂洗3次, 正常山羊血清37℃孵育15min后, 滴加稀释后的一抗(VEGF为:1∶200)稀释倍数。阴性对照以0.01mol/LPBS代替1抗。光学显微镜观察免疫组化染色结果,组织片中细胞质呈棕黄色者为免疫反应阳性细胞。
4)Real Time PCR测定VEGF mRNA水平。每组实验结束后,取3只大鼠断头取大脑,液氮速冻后-80℃冰箱保存备用。取出脑组织适量,提取总RNA,电泳分析表明A260/A280比值在1.7~2.0之间,总RNA片段完整未降解,可以用于下一步实验。取2μg RNA,按照TransScriptTMOne-Step RT-PCR SuperMix 说明书进行逆转录反应,42℃ 30min;85℃ 5 min。然后用ABI StepOne PlusTMReal Time PCR进行PCR反应,取2.0μL逆转录反应产物作为PCR反应模板,加入上下游引物20μmol/L各0.5μL,Fast SYBR@Green Master Mix 10μL,补充Rase-free water至20μL。反应参数:95℃ 20s预变性,95℃ 3S变性,60℃ 30s退火,共40个循环。每次扩增设置β-actin 作为内参照,进行PCR扩增产物的实时定量分析,用2-(△△Ct)方法分析。特异性引物序列见表1。
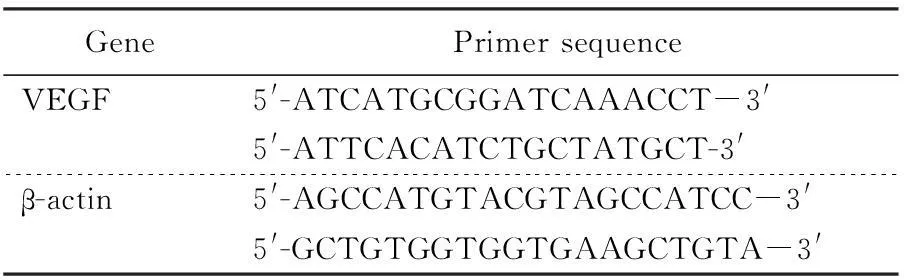
表1 Real Time PCR用的特异性引物序列
1.6统计学分析
利用板栗花富含黄酮类化合物的特点,以及黄酮类物质的抗氧化作用,通过提取、分离精制,生产黄酮含量高的制剂,进而与其他食品或助剂配伍,开发板栗花保健食品;利用黄酮、多酚类物质对皮肤的美白等保健功能,可以开发板栗花美白化妆品,如乳液、膏霜、水剂、面膜等;通过板栗花抑菌能力追踪研究,提取或分离出抗抑菌能力强的成分或成分组合,开发板栗花天然抗菌药品,减少人们对抗生素的依赖。
2结果
2.1大鼠Longa评分
假手术组﹑模型组﹑PNS组和尼莫地平组的Longa评分分别为0﹑(3.0±0.73)﹑(0.79±0.62)﹑(0.65±0.76)分。除假手术组无神经行为缺损症状外,其他各组大鼠则显示出不同程度的神经行为缺损症状。与假手术组相比,模型组的神经缺损评分表现较高,差异有显著的统计学意义(P<0.05)。与模型组相比, PNS组和尼莫地平组的神经缺损评分表现都有所降低P<0.05。
2.2大鼠脑组织TTC染色
与假手术组比较,模型组大鼠大脑有明显的脑梗死面积。与模型组比较, PNS组和尼莫地平组的大鼠大脑脑梗死面积不明显。
2.3VEGF免疫组化结果
如图1所示,假手术组大鼠的皮质、海马和皮质下结构中VEGF蛋白呈弱阳性表达。与假手术组比较,模型组的缺血半暗区有较多的神经细胞、胶质细胞和内皮细胞表达VEGF蛋白。和模型组比较,模型+PNS组和模型+尼莫地平组的VEGF蛋白表达明显增强。

图1 实验组VEGF免疫组化结果(ABC,×400)
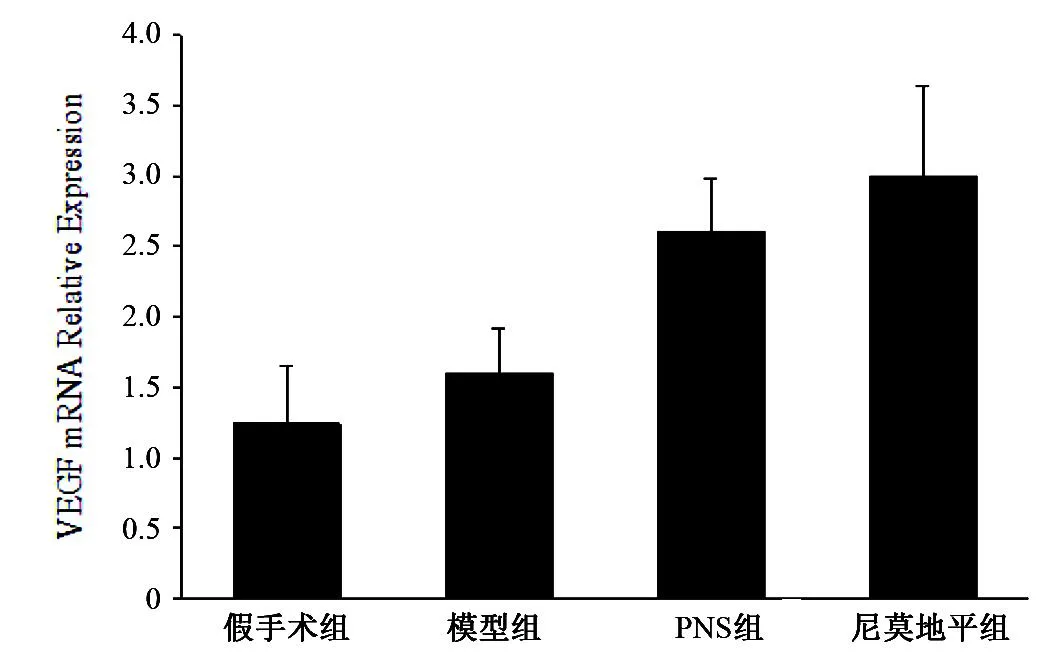
图2 PNS对大鼠大脑缺血再灌注VEGF mRNA水平表达的影响
如图2所示,相较于假手术组,模型组大鼠大脑VEGF的 mRNA表达水平升高明显,差异有统计学意义(P<0.05)。相较于模型组, PNS组和尼莫地平组的大鼠大脑VEGF的 mRNA表达水平升高明显,具有统计学差异(P<0.05)。
3讨论
VEGF是促进血管增生的重要因子,其生物学功能及在脑梗塞治疗中的重要作用已逐渐被人们关注。VEGF 可促使微血管通透性增加,有助于促进在完全阻塞血栓中产生再通血管,促进周围侧枝循环建立和改善内皮细胞依赖性血管舒张,从而在缺血性脑血管疾病的治疗中发挥重要作用[8]。在正常生理条件下,VEGF mRNA仅在正常血管内皮细胞中表达且水平甚低,而在缺血性脑血管病如脑梗塞时,梗死灶及缺血半暗带中VEGF mRNA表达增高[9]。Hayashi 等[10]用免疫组化方法研究了大鼠MCAO后VEGF蛋白表达,发现缺血90min、再灌注1h供血区皮质部分神经元胞浆可见VEGF表达。
本实验以PNS临床剂量预处理大鼠7d,经缺血再灌注后观察各组大鼠神经功能评分和大鼠大脑TTC染色,并从VEGF的角度观察其免疫组化和mRNA水平表达情况,初步探讨PNS预处理大鼠后,对缺血再灌住后的生理和对VEGF的影响。结果显示,模型组的神经功能学评分显著高于假手术组,缺血再灌注模型成功。相较于模型组,PNS组和尼莫地平组的神经缺损评分表现都有所降低,说明对于大鼠大脑的缺血再灌注损伤,PNS可有显著的改善作用。相较于模型组,PNS组和尼莫地平组的大鼠大脑脑梗死面积并不明显,说明预给予PNS,可以显著减轻脑梗死面积。这与文献[11]报道一致。
从VEGF的角度,免疫组化结果表明模型组的缺血半暗区有较多的神经细胞、胶质细胞和内皮细胞表达VEGF蛋白。相较于模型组,PNS组和尼莫地平组的VEGF蛋白表达增强较明显。在mRNA水平,模型组大鼠大脑VEGF的 mRNA表达水平明显升高。相较于模型组,PNS组和尼莫地平组的大鼠大脑脑VEGF的 mRNA表达水平升高明显。
综上所述,PNS可以改善大鼠大脑缺血再灌注引起的损伤,并且可以增强VEGF mRNA水平的表达。故初步推测三七总皂可能是通过上调缺血区脑组织血管内皮细胞表面VEGF mRNA的表达,促进缺血区新生血管形成,恢复缺血区脑组织及神经细胞血流供应,而起到治疗脑缺血再灌注损伤及减轻恢复期功能障碍的作用,对其临床疗效有一定的指导意义。至于PNS究竟通过何种途径激活并上调VEGF mRNA的表达,其确切机制尚不十分清楚,还有待日后进一步研究。
[参考文献]
[1]Li X Y, Wang G G, Sun J G, et al. Pharmacokinetic and absolute bioavailability study of total panax notoginsenoside, a typical multiple constituent traditional Chinese medicine (TCM) in rats [J]. Biol Pharm Bull, 2007, 30(5): 847~851.
[2] 李晓宇, 孙建国, 郑媛婷, 等. PNS对抗pO2 所致大鼠脑微血管内皮细胞损伤的物质基础研究[J]. 中国药理学通报, 2007, 23(8): 1030~1034.
[3] 吴颖, 孙冰, 肖静, 等. 三七皂苷R1对LPS诱导的小鼠心肌损伤的保护作用[J]. 中国药理学通报, 2013, 29(2): 179~184.
[4] 李花, 邓常清, 陈北阳, 等. PNS对大鼠脑缺血再灌注后Caspase表达的影响[J]. 中国药理学通报, 2006, 22(2): 189~193.
[5] Longa E Z, Weinstein P R, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats [J]. Stroke, 1989, 20(1): 84~91.
[6] 韩若东, 汤其强, 肖晗, 等. 丹参酮 ⅡA对早期脑缺血和脑缺血再灌注损伤的脑保护作用[J]. 安徽医科大学学报, 2012, 47(6): 655~658.
[7] 牛建国, 何仲义. 大鼠MCAO再灌注模型的改良及GM1对大鼠MCAO再灌注损伤保护作用的实验研究[D].银川:宁夏医学院, 2005.
[8] 郑婵娟, 廖维靖, 杨万同, 等. 当归注射液对大鼠脑缺血再灌注损伤后VEGF表达的影响[J]. 中国康复理论与实践, 2005, 11(12): 973~975.
[9] 崔常香, 孔立红, 周红娟, 等. 穴位埋线对脑缺血再灌注大鼠皮质区VEGF mRNA表达的影响[J]. 湖北中医学院学报, 2010, 12(4): 21~23.
[10] Hayashi T, Abe K, Suzuki H, et al. Rapid induction of vascular endothelial growth factor gene expression after transient middle cerebral artery occlusion in rats [J]. Stroke, 1997, 28: 2039~2044.
[11]王海芳. PNS保护脑缺血再灌注脑损伤机制的实验研究进展[J].山西中医学院学报, 2014, 15(2): 73~75.
[编辑]刘阳
[文献标志码]A
[文章编号]1673-1409(2015)12-0001-04
[中图分类号]R363
[作者简介]蒋会慧(1978-),女,讲师,主要从事血管药理学研究工作, bzyhuli@126.com。
[收稿日期]2015-01-05
[引著格式]蒋会慧,王园园,刘立富,等. 三七总皂苷对大鼠大脑缺血再灌注VEGF表达的影响[J]. 长江大学学报(自科版),2015,12(6):1~4.

