盐酸法舒地尔对慢性脑低灌注损伤大鼠海马细胞的保护作用
孙 莉 梅 瑰 郭莲军 陈玉华
430010 武汉,长江航运总医院 武汉脑科医院[孙 莉 梅 瑰 陈玉华(通信作者)];华中科技大学同济医学院药理系(郭莲军)
盐酸法舒地尔对慢性脑低灌注损伤大鼠海马细胞的保护作用
孙莉梅瑰郭莲军陈玉华
430010武汉,长江航运总医院 武汉脑科医院[孙莉梅瑰陈玉华(通信作者)];华中科技大学同济医学院药理系(郭莲军)
盐酸法舒地尔(hydroxy fasudil, HF),其化学结构为6(H)-1-(5-磺酰基异喹啉)-1(H)-1,4-二氮杂卓盐酸盐[1],作为一种扩血管药物首次在日本上市,主要应用于改善及预防蛛网膜下腔出血术后的脑血管痉挛及随之引起的脑缺血症状,一种Rho激酶特异性抑制剂,通过抑制Rho激酶舒张血管增加脑供血并抑制炎症反应[2],上调eNOS蛋白表达[3]改善血管内皮功能,稀释血液降低血液粘滞度[4],并抑制中性粒细胞的迁移[5]。慢性脑缺血致认知功能障碍是临床上常见的脑损伤之一,已成为研究的热点,其损伤机制尚未阐明。盐酸法舒地尔不仅可以通过抑制Rho激酶来缓解脑缺血症状,还可以通过直接作用于受损神经元而发挥神经保护作用[6-7]。海马是参与学习与记忆功能的重要脑区,本研究应用水迷宫实验及HE染色观察慢性脑缺血后及经盐酸法舒地尔治疗30 d后对大鼠学习记忆功能的影响及海马细胞形态的变化,从而探讨盐酸法舒地尔改善慢性脑缺血致认知功能障碍的机制。
1材料与方法
1.1实验动物
健康成年雄性Sprague-Dawley大鼠,清洁级,体重180~220 g,由华中科技大学同济医学院实验动物中心提供(动物证号:No19-050)。大鼠随机分笼饲养,维持室温20~22 ℃,自由摄食与饮水,自然光照节律,每天提供足量的食物和水。
1.2主要药品和试剂
盐酸法舒地尔(hydroxy fasudil,HF),白色粉剂,纯度>98%,Tocris Cookson Ltd. (Britol, UK)公司生产,批号040311,临用前用生理盐水溶解并稀释至所需浓度,注意避光。其余药品和试剂均为市售分析纯。
1.3动物模型制备
大鼠慢性不完全性全脑缺血模型采用大鼠双侧颈总动脉永久性结扎(permanent occlusion of the bilateral CCA, 2VO)制备。大鼠用10%水合氯醛0.35 ml/100 g腹腔内注射麻醉,仰卧位固定,颈部去毛,强力碘消毒,颈部正中切口,分离双侧颈总动脉,并套以“0”号线,分别结扎双侧颈总动脉的近心端和远心端,并从中间剪断,以确保阻断颈总动脉血流;缝合后腹腔注射生理盐水4~5 mL,放回笼中饲养。假手术组除不结扎、不剪断双侧颈总动脉外,其余过程与模型组相同。术中保持大鼠肛温36.5~37.5 ℃。各组大鼠同条件饲养,在相同时间点作各种检测。
1.4实验分组与给药
将Sprague-Dawley大鼠随机分为3组,即(1)假手术组;(2)脑缺血模型组:永久性结扎双侧颈总动脉(permanent occlusion of the bilateral CCA, 2VO);(3)HF治疗组:2VO + HF 10 mg/kg。2VO术后第1 d开始腹腔注射给药,假手术组和脑缺血模型组分别给予等体积的生理盐水;HF治疗组给予盐酸法舒地尔10 mg/kg,1次/d,持续30 d。
1.5大鼠空间学习和记忆能力检测
大鼠双侧颈总动脉结扎30 d后用Morris水迷宫实验方法检测学习记忆能力;实验装置为一直径为200 cm,高50 cm的不锈钢的圆柱形水池,等分为4个象限;将一直径约为10 cm的平台固定于其中某一象限正中心的位置;水深约为30 cm,平台隐没在水平面下1.5 cm,水中加入奶粉,使水成为不透明的乳白色,以致看不见平台位置。测试程序包括(1)定位航行实验:大鼠连续训练5 d,每天分上、下午两个时段,每个时段训练4次。每次实验大鼠在4个不同象限中点头朝池壁放入水池,次序每天不同,任其游泳,直至找到平台;大鼠找到平台时间和轨迹由水池上方的摄像机记录;180 s内到达平台的时间即逃避潜伏期,4个象限记录的时间的平均值作为当天大鼠的逃逸潜伏期;(2)空间探索实验:实验第6 d,撤除平台,记录大鼠在180 s内大鼠在目标象限的停留时间;采用MT-200水迷宫图像追踪系统监测大鼠游泳轨迹;水迷宫实验在每天早上10:30~12:00进行。
1.6组织学观察
大鼠水迷宫实验结束后腹腔注射20%乌拉坦0.6 mL/100 g麻醉,于30~40 min内从左心室快速灌注生理盐水100~150 mL,继续灌注4%多聚甲醛500 mL;大鼠静置于4 ℃冰箱,3 h后取出大脑,置4 ℃的同样的固定液中过夜,经梯度酒精(浓度依次为80%、95%、100%)上行脱水、二甲苯透明后石蜡包埋;自前囟后2.0 cm处以5 um的厚度行连续冠状位切片;石蜡切片经二甲苯脱蜡透明、梯度酒精(浓度依次为100%,95%)下行至水后PBS漂洗2次,每次5 min;加入苏木素染色5 min后自来水冲洗10 min,1%盐酸水溶液分色,自来水冲洗10 min,伊红染色5 min;切片经酒精脱水,二甲苯透明,树胶封片;普通光学显微镜下观察皮层、海马细胞形态变化。
1.7在体电生理记录
各组大鼠水迷宫实验结束后乌拉坦(1.5 g/kg, ip)麻醉,用恒温水循环系统维持大鼠体温至37 ℃;头部固定于脑立体定位仪(SN-3, 5 Narishige, Japan),在无菌条件下剪开皮肤和筋膜暴露头骨,刺激电极插入海马Schaffer 侧枝(前囟后3.5~4.0 mm;中缝旁3.1~3.5 mm;硬膜下2.2~2.5 mm);记录电极分别定位于同侧海马CA1(前囟后3.2~3.6 mm;中缝旁2.2~2.5 mm;硬膜下1.8~2.2 mm),电极定位完毕后休息30 min;开始实验,刺激持续时间0.15 ms,刺激频率30 Hz,刺激强度为5~30 V;测定每个时间点的群峰电位(population spike, PS)幅度,以刺激前基线记录的PS平均幅度为100%进行标准化;用RM6240BD 生物信号记录系统记录、放大、监测和分析生物信号。
1.8统计学处理
所有计量资料以均数±标准误(mean±SEM)表示,运用one/two-way ANOVA分析组间差异,P<0.05表示显著性差异。
2结果
2.1盐酸法舒地尔对大鼠慢性脑缺血所致空间学习记忆能力减退的影响
水迷宫实验发现,模型组大鼠寻找平台时间即逃避潜伏期与假手术组比较,明显延长,脑缺血模型组与假手术组比较逃避潜伏期明显延长(P<0.01);盐酸法舒地尔治疗组大鼠逃避潜伏期与脑缺血模型组比较有显著缩短(P<0.05)(图1)。
空间探索实验发现,脑缺血模型组大鼠在原来平台所在象限停留时间与假手术组比较明显缩短(P<0.05),脑缺血盐酸法舒地尔治疗组显著延长大鼠在靶象限中的停留时间(P<0.05)(图2)。
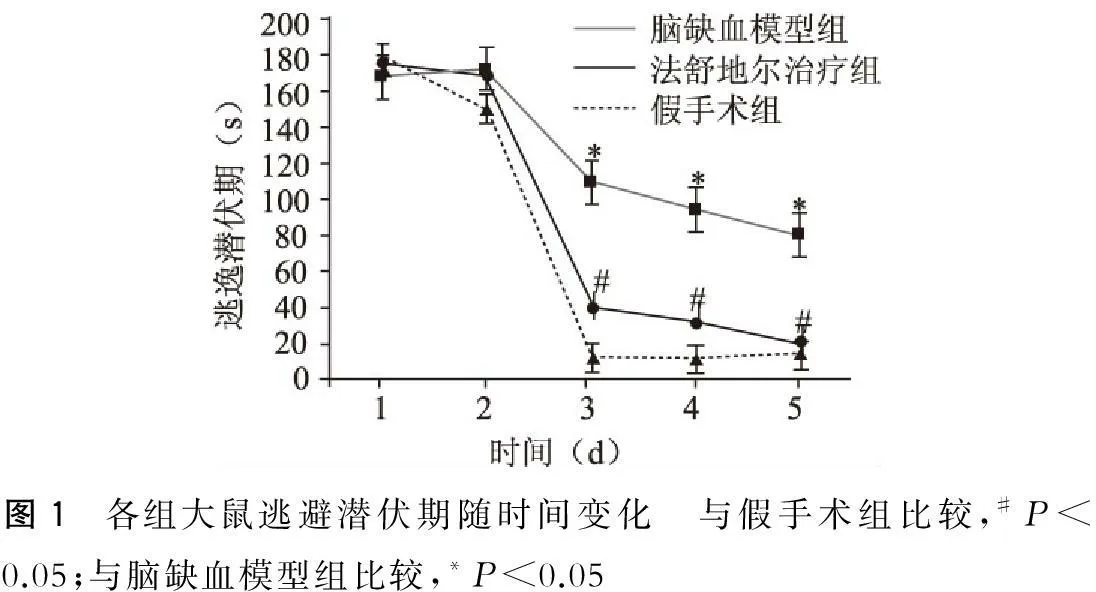
图1 各组大鼠逃避潜伏期随时间变化 与假手术组比较,#P<0.05;与脑缺血模型组比较,*P<0.05
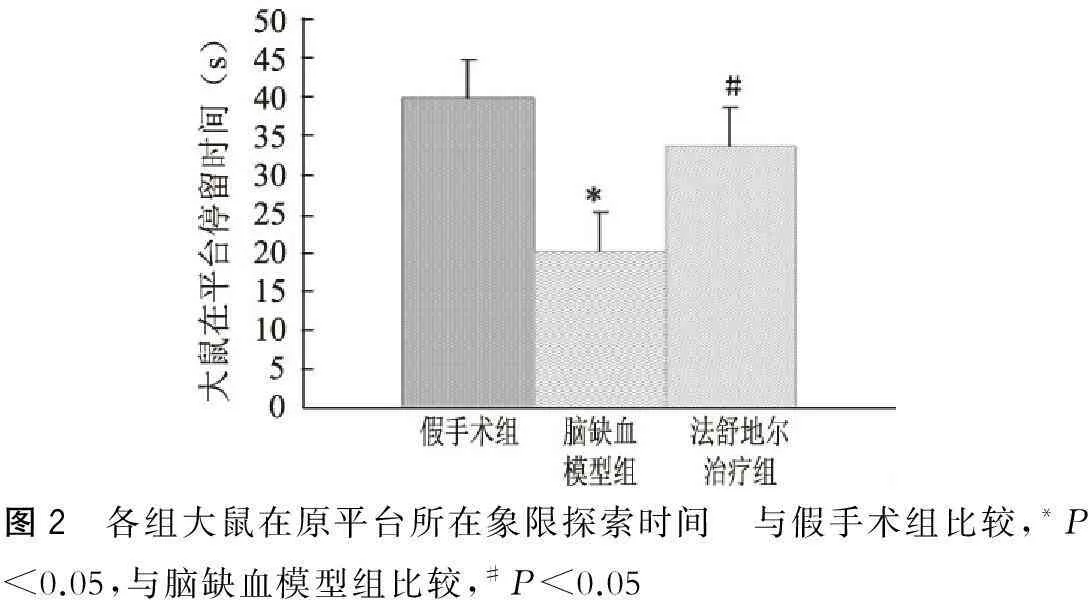
图2 各组大鼠在原平台所在象限探索时间 与假手术组比较,*P<0.05,与脑缺血模型组比较,#P<0.05
2.2盐酸法舒地尔对2VO大鼠海马神经元细胞丢失的影响
组织学观察显示,光镜下假手术组海马神经元结构清晰完整,无异常改变;慢性脑缺血30 d后可见细胞结构较紊乱,神经元丢失;经盐酸法舒地尔治疗30 d后神经元丢失现象减少,明显优于模型组(图3~4)。
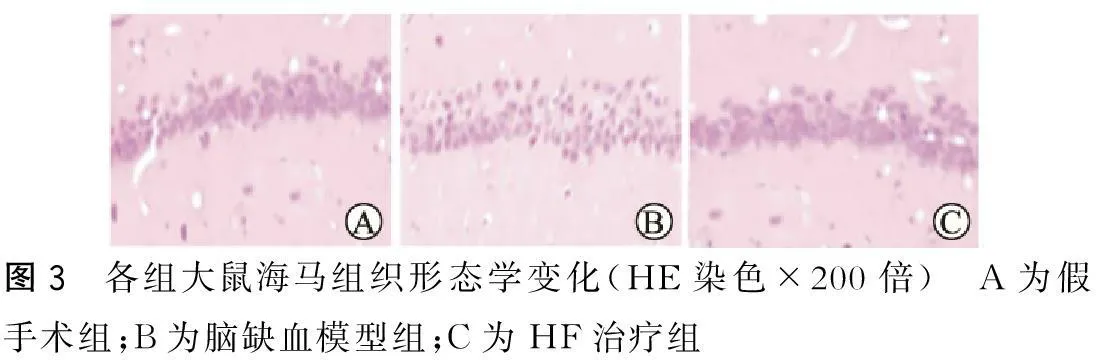
图3 各组大鼠海马组织形态学变化(HE染色×200倍) A为假手术组;B为脑缺血模型组;C为HF治疗组
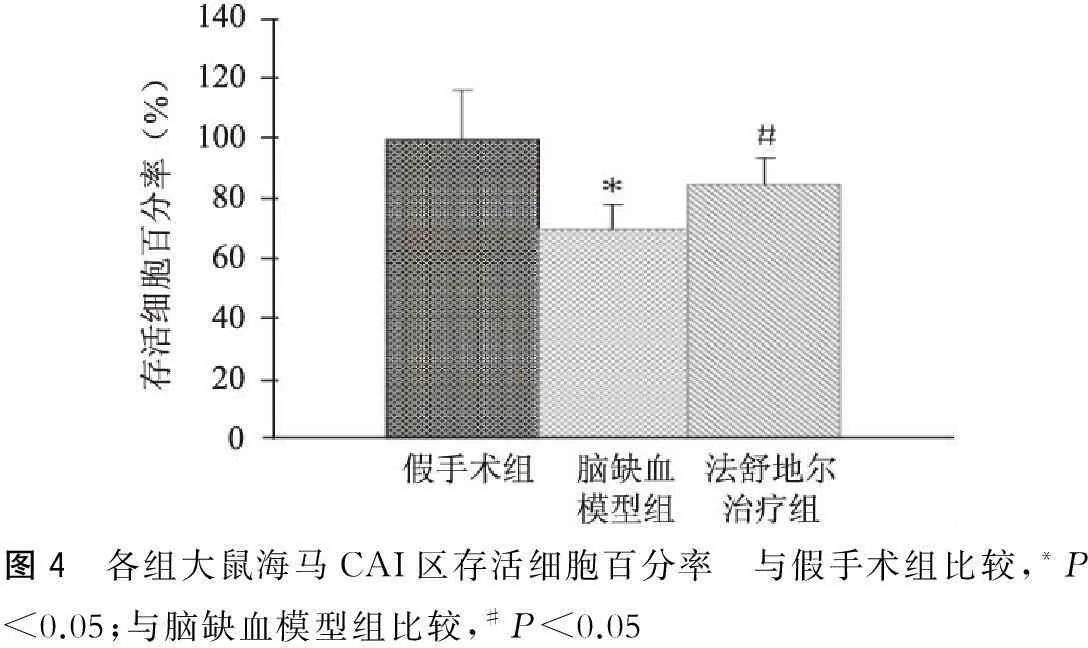
图4 各组大鼠海马CAI区存活细胞百分率 与假手术组比较,*P<0.05;与脑缺血模型组比较,#P<0.05
2.3盐酸法舒地尔对慢性脑低灌大鼠海马突触传递功能的影响
在体电生理实验发现,假手术组、脑缺血模型组、HF治疗组大鼠强直刺激海马CA1区PS幅值变化百分率,模型组大鼠PS幅值明显被抑制,其PS相对幅值均显著低于假手术组组(P<0.05),HF治疗组大鼠PS幅值明显改善,显著高于模型组(P<0.05)(图5)。
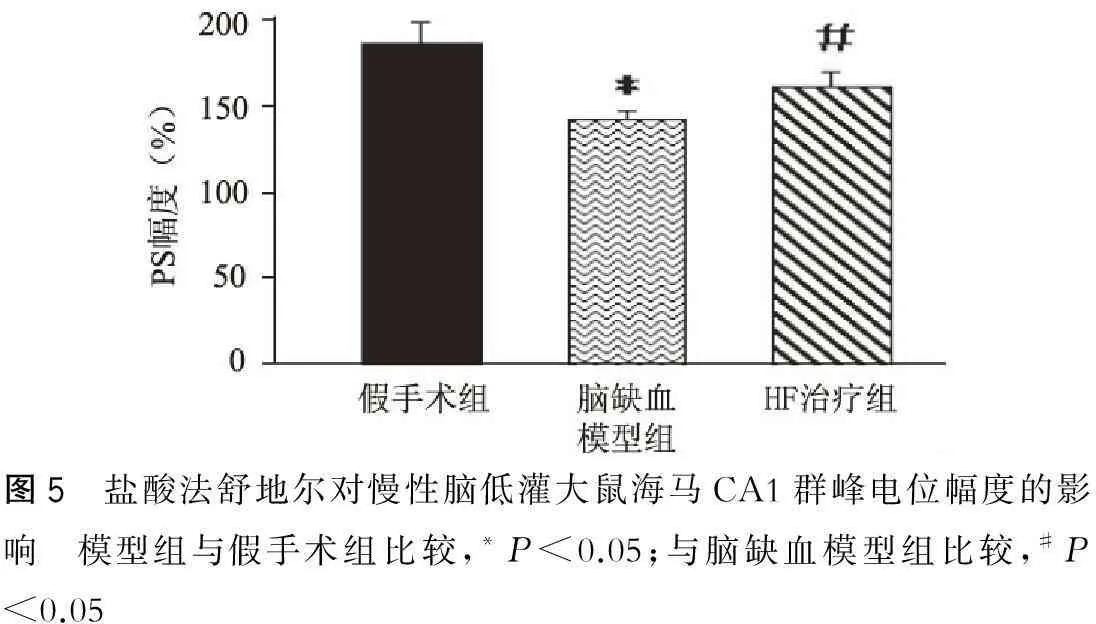
图5 盐酸法舒地尔对慢性脑低灌大鼠海马CA1群峰电位幅度的影响 模型组与假手术组比较,*P<0.05;与脑缺血模型组比较,#P<0.05
3讨论
脑组织缺血后神经细胞的损伤有许多病理生理过程参与,目前认为兴奋性氨基酸释放、神经细胞钙离子超载、氧自由基产生、炎症反应、细胞凋亡等因素均参与了脑缺血所致的神经细胞损伤的发生与发展[8-9]。脑缺血时细胞内钙离子超载可以引起Rho激酶的活化,与脑血管痉挛有密切关系。随着国际上实验研究的进展,越来越多的研究证实Rho激酶不仅与血管痉挛有关,与脑缺血后神经元细胞的氧化应激损伤亦密切相关[10]。Rho激酶在脑缺血神经元损伤的病理生理过程中占有重要地位,可以改变蛋白的磷酸化过程并影响基因组表达和蛋白合成,从而参与谷氨酸的神经毒性作用以及促进炎症/氧化应激,进一步引起神经元的磷脂膜、细胞骨架蛋白、核酸等重要结构的解体,导致脑神经信息发生紊乱,能量代谢功能障碍,进而出现神经元缺血性变性、凋亡和坏死,这是血管性认知障碍及痴呆发生机制之一[11-12]。有研究发现,抑制Rho激酶对于海马的缺血性损伤有重要治疗意义[13]。
本实验通过应用永久性结扎双侧颈总动脉方法制作慢性低灌性大脑缺血模型,观察Rho激酶特异性抑制剂法舒地尔对大鼠脑缺血后海马细胞的保护作用。大鼠双侧颈总动脉永久性结扎致慢性大脑缺血30 d后,水迷宫行为学检测显示,模型组大鼠逃离潜伏期延长、在目标象限中游泳时间缩短,提示其学习记忆功能明显受损;海马组织病理切片可见慢性脑低灌注缺血可导致CA1神经元损伤,表现核深染,细胞丢失,这与相关研究报道一致[10]。给予Rho激酶特异性抑制剂法舒地尔腹腔注射30 d后脑缺血的SD大鼠学习记忆能力均有明显改善,并能明显减轻海马神经细胞的丢失。提示盐酸法舒地尔改善大鼠慢性低灌所引起的认知功能障碍与对海马神经元的保护作用有关。在体电生理实验显示,盐酸法舒地尔可明显逆转慢性脑低灌注缺血大鼠CA1群峰电位幅度的降低,表明对海马突触传递功能损伤有改善作用。
缺血性脑血管疾病的发病机制十分复杂,许多病理生理过程都参与了缺血性脑血管疾病中神经元损伤的发生与损伤级联反应的发展,盐酸法舒地尔亦有可能通过其它的途径改善慢性脑缺血所致的认知功能障碍。详细作用机制有待深入研究。
参考文献
1Shimokawa H, Takeshita A. Rho-kinase is an important therapeutic target in cardiovascular medicine. A rterioscler Throm b Vasc B iol, 2005, 25 (9):1767-1775.
2Satoh S, Kobayashi T, Hitomi A, et al. Inhibition of neutrophilmigration by a protein kinase inhibitor for the treatment of ischemic brain infarction. J Pharmacol, 1999, 80(1): 41-48.
3Hitomi A, Satoh S, Ikegaki I, et al. Hemorheological abnormalities in experimental cerebral ischemia and effects of protein kinase inhibitor on blood fluidity. Life Sci, 2000, 67(16): 1929-1939.
4Satoh S, Utsunomiya T, Tsurui K, et al.Pharmacological profile of hydroxyphasudil as a selective rho kinase inhibitor on ischemic brain damage. Life Sci, 2001, 69(12):1441-1453.
5Qin Li , Yuhua Chen , Li Sun, et al.Vasodilatation produced by Fasudil Mesylate in vivo and in vitro.Vascular Pharmacology, 2011, 55(5-6):121-126.
6Yano K, Kawasaki K, Hattori T, et al. Demonstration of elevation and localization of Rho-kinase activity in the brain of a rat model of cerebral infarction. Eur J Pharmacol, 2008, 594(1-3):77-83.
7Yamashita K, Kotani Y, Nakajima Y, et al. Fasudil, a Rho kinase (ROCK) inhibitor, protects against ischemicneuronal damage in vitro and in vivo by acting directly on neurons. Brain Res, 2007, 1154:215-224.
8White BC, Sullivan JM, DeGracia DJ, et al. Brain ischemia and reperfusion: molecularmechanisms of neuronal injury. Neurol Sci, 2000, 179(S1-2):1-33.
9Chong ZZ, Li F, Maiese K. Oxidative stress in the brain: novel cellular targets thatgovern survival during neurodegenerative disease. Prog Neurobiol, 2005, 75(3):207-246.
10Rikitake Y, Kim HH, Huang Z, et al.Inhibition of Rho kinase (ROCK) leads to increased cerebral blood flow and stroke protection. Stroke,2005, 36(10):2251-2257.
11Oguro H, Okada K, Yamaguchi S, et al. A six year follow-up study on the influence of silent ischemic brain lesions on cognitve function and brain atrophy in elderly people. Nippon Ronen Igakkai Zasshi,2000, 37(4):298-303.
12Bor nstein NM, Gur AY, Treves TA, et al. Do silent brain infarctions predict the development of dementia after first ischemic stroke?. Stroke, 1996, 27(2-3):904-905.
13Huang L, Li Q, Li H, et al. Inhibition of intracellular Ca2+ release by a Rho-kinase inhibitor for the treatment of ischemic damage in primary cultured rat hippocampal neurons. Eur J Pharmacol, 2009, 602(2-3):238-244.
(2015-04-28收稿)
【摘要】目的观察Rho激酶抑制剂盐酸法舒地尔(hydroxy fasudil, HF)对慢性低灌注脑缺血所致大鼠海马神经细胞损伤的保护作用。方法采用永久性结扎大鼠双侧颈总动脉(permanent occlusion of the bilateral CCA, 2VO)制备大鼠慢性不完全性全脑缺血模型,将SD大鼠随机分为假手术组、脑缺血模型组和HF治疗组,运用Morris 水迷宫行为学方法检测大鼠空间学习记忆能力;用HE染色观察海马组织形态学改变。结果Morris 水迷宫检测发现模型组大鼠学习记忆能力受损,与假手术组比较逃避潜伏期延长、空间辨别能力下降;组织学观察模型组大鼠海马CA1细胞发生丢失,组织结构异常。连续给予盐酸法舒地尔30 d能改善大鼠学习记忆功能,减少脑缺血所致的大鼠海马神经细胞丢失。结论盐酸法舒地尔可减少慢性脑缺血所致的大鼠海马神经元的丢失,改善学习记忆功能。
【关键词】盐酸法舒地尔Rho激酶脑缺血海马神经细胞HE染色
【DOI】10.3969/j.issn.1007-0478.2015.04.006
Neuroprotective effects of hydroxy fasudil on brain hippocampal neurons damage of chronic cerebral hypoperfusion rat modelSunLi,MeiGui,GuoLianjun,etal.DepartmentofNeurology,GeneralHospitaloftheYangtzeRiver(WuhanBrainHospital),Wuhan430010
【Abstract】ObjectiveTo observe the neuroprotective effects of hydroxy fasudil (HF), a Rho-kinase inhibitor, on hippocampal neurons damage after chronic cerebral hypoperfusion in a rat model.MethodsChronic cerebral hypoperfusion in rats was performed by permanent occlusion of the bilateral common carotid artery (2VO). SD rats were divided into three groups: sham-operated group, ischemic group and HF treated group (10 mg/kg). Morris water maze was used to measure spatial learning and memory performance. HE stain was used to observe morphology change.ResultsCompare with sham-operation group, 2V0 rats resulted in spatial learning and memory impairments shown by longer escape latency and shorter time spent in the target quadrant. Morphological observe of 2V0 rats hippocampal show CA1 neurons lost. Administration of hydroxy fasudil (10 mg/kg, once per day for 30days) can improve 2V0 rats learning and reduce the neuron lost.ConclusionsLong-term administration of hydroxy fasudil markedly attenuated chronic cerebral hypoperfusion induced neuronal damage.
【Key words】Hydroxy fasudilRho kinaseCerebral ischemiaHippocampal neuronsHE stain
【中图分类号】R743
【文献标识码】A
【文章编号】1007-0478(2015)04-0215-04
基金项目:交通运输部长江航务管理局课题(201210011);武汉市卫计委临床医学科研项目(WX14D12)

