人参皂甙单体Rb1对大鼠脑缺血损伤保护作用的实验研究
任庆华 罗江兵 李长清
529000 广东省江门市人民医院神经内科(任庆华),神经外科(罗江兵);重庆医科大学附属第二医院神经内科(李长清)
人参皂甙单体Rb1对大鼠脑缺血损伤保护作用的实验研究
任庆华罗江兵李长清
529000广东省江门市人民医院神经内科(任庆华),神经外科(罗江兵);重庆医科大学附属第二医院神经内科(李长清)
中枢神经系统损伤后康复是医学界一大难题,缺血性脑血管疾病则是中枢神经系统损伤的常见原因。人参是传统中药,其提取物的多种成分具有药理活性,其中Rb1可诱导神经元的分化,保护皮质神经元,诱导其突起生长,对中枢神经系统有神经营养效应[1]。本实验采用人参皂甙单体Rb1对鼠实验性脑缺血后进行干预,观察其可能的脑保护效应。
1材料与方法
1.1动物成年雄性清洁级SD大鼠30只(由重庆医科大学动物实验中心提供)随机分为5组, 假手术组(Sham)、缺血对照组(Con)、干预组(Tre),干预组又分为Rb130 mg/kg、60 mg/kg及90 mg/kg三个不同剂量组,每组各6只。采用Zea Longa改良法建立大脑中动脉闭塞(MCAO)模型[2]。干预组在术前用相应剂量Rb1 ip qd×7 d,末次给药后3 h内造模,假手术组与缺血对照组术前用相同剂量生理盐水代替;假手术组接受手术,但栓线不插入颈内动脉颅内段。对照组及干预组大鼠清醒后无神经功能缺损者或有蛛网膜下腔出血者弃之,随机补充大鼠。
1.2标本采集术后48 h再次麻醉大鼠,直视下开胸,剪开右心耳,以200 ml生理盐水经升主动脉快速灌注,然后以4%多聚甲醛400 ml灌注;灌注完毕后立即断头取脑,于中1/3处取冠状位切片(厚约3~4 mm),4%多聚甲醛中固定过夜常规石蜡包埋;用于TTC染色或脑组织含水量测定的标本在麻醉后直接快速断头取脑,不做灌注处理。
1.3神经功能缺失征象的评定采用Zea Longa评分[2],0分:无神经功能缺损,肢体活动正常:1分:神经功能轻度局灶性损伤,提尾时不能伸展左前肢;2分:神经功能中度局灶性损伤,向左侧划圈;3分:神经功能重度局灶性损伤,向左侧倾倒;4分:神经功能极重度局灶性损伤,无自主行走、意识障碍或昏迷。
1.4病理学观察及调亡细胞检测石蜡切片常规HE染色观察缺血后病理改变。原位末端标记DNA片段(TUNEL)检测细胞凋亡。调亡试剂盒由德国Roche公司提供,操作过程按说明书进行。
1.5TTC染色测定梗死面积取大鼠新鲜脑组织,从额极至小脑做冠状位切片,每片厚2 mm;将脑片浸入37 ℃预热的2%TTC溶液中37 ℃中孵育15 min,4%的中性多聚甲醛10 ml固定24 h,数码像机摄像,在TD2000计算机图像分析系统上计算出梗死区相对体积。水肿对梗死灶体积的影响采用Swanson的方法进行纠正,即梗死面积=非缺血侧半球面积-缺血侧半球未梗死区面积,梗死灶体积以梗死侧体积和非缺血侧半球体积的百分比(%)来表示[3]。
1.6脑含水量(BWC)测定(干湿重法)新鲜脑组织放在一个内有生理盐水润湿的定性滤纸的培养皿中,以防水分蒸发,去除皮质表面的软脑膜、小脑、脑干;取缺血侧和梗死对侧大脑半球分别置于称量杯中分析天平称湿重;从取脑到称量完毕时间控制在5 min,然后放入电热恒温箱内100 ℃烘烤24 h后取出,至分析天平恒重后称干重(两次干重之差小于等于0.2 mg);脑组织含水量按以下公式计算:脑含水量(%)=(湿重-干重)/湿重× 100%[4]。
1.7NgR表达的测定石蜡切片常规脱蜡至水,3%过氧化氢室温孵育10~15 min,置于0.01 M枸橼酸盐缓冲液中进行微波抗原修复,冷却至室温后0.01 M的PBS浸泡5 min,滴加正常山羊封闭血清室温孵育20 min,倾去多余血清,滴加抗NgR(纯化的抗Nogo-66受体的IgG抗体,美国ad公司,按1∶150的比例稀释)30 ul4 ℃冰箱过夜,滴加生物素标记的二抗工作液,室温孵育15 min,滴加辣根标记链霉卵白素,室温孵育15 min,DAB显色,镜下观察控制染色时间,自来水充分冲洗;苏木素复染,镜下观察控制染色时间,自来水充分冲洗;脱水、二甲苯透明、中性树脂封片。各步骤间均用0.01 M PBS充分冲洗。同时设立对照,用正常羊血清代替抗NgR。二抗试剂盒为中山试剂公司提供的SP-9001。在计算机上用TD2000病理图像分析系统分析并计算阳性表达面积(μm2)。
2结果
2.1大鼠局灶性脑缺血再灌注后神经功能评分、脑梗死体积及脑组织含水量的变化。
在缺血后48 h缺血对照组表现出不同程度神经功能缺失,出现梗死病灶及脑水肿。各干预组与假手术组或缺血对照组相比差异显著。在神经功能评分中干预组相邻剂量组间比较无显著差异(P>0.05),干预各组间脑梗死体积及脑组织含水量比较(P<0.05)(表1)。
2.2大鼠局灶性脑缺血再灌注脑组织病理学观察
缺血后48 h脑组织出现不同程度的脑水肿及神经细胞缺失,失去正常结构形态,细胞变形,核固缩,细胞周围出现空泡,可见红色神经元。缺血对照组的病理改变明显重于干预各组,出现神经细胞溃变,神经纤维网疏松呈海绵状。
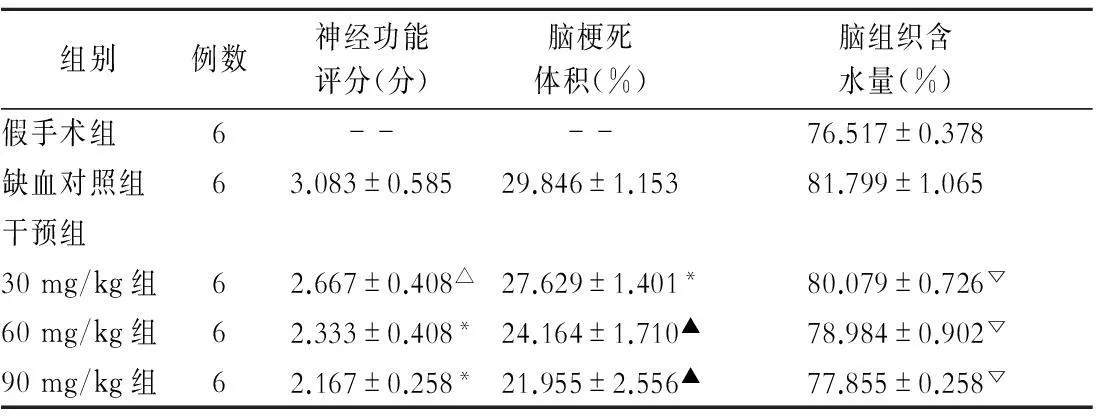
表1 各组大鼠神经功能评分、脑梗死体积
注:One-way ANOVA,与缺血对照组比较,△P>0.05,*P<0.05,▲P<0.01;与假手术组比较,▽P<0.01
2.3大鼠局灶性脑缺血再灌注后调亡细胞及NgR表达的变化。

表2 各组大鼠调亡细胞数及NgR表达的变化
注:与缺血对照组比较,*P<0.01;△P>0.05
TUNEL法检测调亡细胞,DAB显色,苏木素复染,阳性表现为核固缩深染的棕黄色细胞为调亡细胞。在假手术组脑组织偶见调亡细胞。缺血后调亡细胞增加,各干预组增加程度较缺血对照组小(P<0.01)。各干预组间比较(P<0.05)(表2)。
NgR主要表达在细胞膜及突起上,呈棕黄色。在假手术组也有表达,主要在胞膜上,突起上表达少;缺血后表达增多,表现为表达强度增加及突起上表达增加,突起上表达主要在近端。各组间均有显著差异。(图1~5)
3讨论
脑梗死是临床多发病,发病后脑水肿程度、梗死面积大小、神经细胞存活情况等严重影响着病人的功能恢复及预后。本实验观察到病理检查显示假手术组形态结构基本正常,大脑皮质分层清楚。缺血后48 h脑组织出现不同程度的脑水肿及神经细胞缺失,失去正常结构形态,细胞变形,核固缩,细胞周围出现空泡,可见红色神经元。缺血对照组的病理改变明显重于干预各组,出现神经细胞溃变,神经纤维网疏松呈海绵状。干预组的间质水肿明显轻于缺血对照组。脑组织受到缺血缺氧刺激,诱发神经细胞死亡。细胞在形态学上有两种死亡过程:一种是有害因素的极度刺激造成的病理性死亡,即坏死;另一种是细胞内外因素激活细胞本身的主动程序性死亡,即凋亡,主要表现为染色质凝集,胞膜完整,细胞内容物不释放,不引起炎症反应。近年来对调亡机制的研究显示脑缺血后神经细胞死亡与细胞调亡关系密切。TUNEL法利用分子生物学与组织化学相结合的技术,特异性标记DNA片段,原位检测凋亡细胞,并具有较高的敏感性。如何有效控制脑水肿,防止梗塞体积扩大,保护存活细胞挽救濒死细胞将有重要的临床意义。本实验显示干预组预先给人参皂甙单体Rb1能够显著减少脑水肿程度、减小梗死面积及梗塞周边区调亡细胞,改善功能评分,这与病理改变一致。不同剂量组间显示出不同的保护强度。提示Rb1能通过减轻缺血性损伤后脑水肿等作用发挥神经保护作用且具有剂量依赖性。

图1 假手术组大鼠缺血再灌注48h后NgR的表达水平(×200倍) 图2 缺血对照组大鼠缺血再灌注48h后NgR的表达水平(×200倍) 图3 Rb130mg/kg组大鼠缺血再灌注48h后NgR的表达水平(×200倍) 图4 Rb160mg/kg组大鼠缺血再灌注48h后NgR的表达水平(×200倍) 图5 Rb190mg/kg大鼠缺血再灌注48h后NgR的表达水平(×200倍)
中枢神经系统(CNS)损伤后的再生能力一直是神经病学家高度关注的问题,这是影响功能恢复的关键。同发育中的CNS相比,成熟CNS损伤后的功能恢复及结构可塑性能力是很有限的。现有研究显示众多抑制因子中Nogo-A备受注目,它分布于CNS髓鞘膜中,有两个活性区域。其中Nogo-66与NgR(Nogo-66 receptor)特异性结合而表现出强大的抑制轴突生长的作用[5]。用Nogo-66的特异竞争性拮抗剂NEP1-40阻止Nogo-66与NgR的结合,可以促进损伤轴突生长及功能恢复[6]。已在鼠短暂性半球缺血(缺血10分钟)后检测到NgR的表达增高[7]。已有研究显示NgR不仅仅是Nogo-A的作用点,它还是其它中枢髓鞘衍生轴突生长抑制因子髓鞘相关糖蛋白(MAG)和少突胶质细胞髓鞘糖蛋白(OMgp)发挥作用的集中点[8-9],对NgR进行干预或许可以收到比干预单一抑制因子更强大的促轴突生长作用。本实验观察到实验性脑梗死后NgR的表达增高,表现为表达强度增加及突起上表达增加。干预组的增高程度低于缺血对照组,有显著差异。这提示Rb1可能在中枢神经系统损伤后康复中起促进作用。但其作用是直接干预NgR的表达,还是存在其它环节的作用?有待实验进一步研究。
人参是传统医药的重要药材,Rb1是从中提取的有效单体之一,有着多方面的药理作用[10-12]。本实验结果显示其提取物Rb1对鼠实验性脑缺血再灌注损伤有保护作用且呈剂量相关性,这不仅为临床用药提供依据,还为临床治疗中枢神经损伤开辟新思路。
参考文献
1Wang XY. Effect of ginsenoside Rb1 on long-term potentiation in the dentate gyrus of anaesthetized rats. J Asian Nat Prod Res,2003,5(1):1-4.
2Durukan K,Tatlisumak T. Preconditioning-induced ischemic tolerance:a window into endogenous gearing for cerebroprotection.Exp Transl Stroke Med,2010,2(1):2.
3Wanson RA, Morton MT, Tsao-Wu, et al. A semiautomatic method for measuring brain infarct volume. J Cere Blood Flow Metab,1990,10(2):290-293.
4曹美鸿, 秦天森. Nimodipine 对冷冻伤性脑水肿的保护作用.临床神经科学, 1991, 1(1):6-9.
5Alyson EF, GrandPre T, Strittmatter SM. Identification of a receptor mediating Nogo-66 inhibition of axonal regeneration. Nature, 2001, 409(6818): 341-346.
6Wiessner C, Bareyre FM, Allegrini PR, et al. Anti-Nogo-A antibody infusion 24hours after experimental stroke improved behavioral outcome and corticospinal plasticity in normotensive and spontaneously hypertensive rats. J Cereb Blood Flow &Metab, 2003, 23(2): 154-165.
7Zhou C, Li Y,Nanda A,et al.HBO suppresses Nogo-A,Ng-R,or RhoA expression in the cerebral contex after global ischemia.Biochemical and Biophysical Research Communications,2003,309(12):368-376.
8Jiang W,Xia F,Han J. Patterns of Nogo-A,NgR,and RhoA expression in the brain tissues of rats with focal cerebral infarction.Translational Research,2009,154(1):40-48.
9Kevin CW, Koprivica V, Jieun AK, et al. Oligodendrocyte-mylin glycoprotein is a Nogo receptor ligand that inhibits neuritis outgrowth. Nature, 2002, 417(6892): 941-944.
10杨艳萍. 人参皂苷Rb1药理作用的研究概述.中国药师,2010,13(2):280-282.
11罗天飞,刘姗姗,葛鹏飞,等.人参皂甙Rbl对短暂脑缺血后神经元损伤的保护作用.中国老年学杂志,2008,10(28):1892-1984.
(2014-09-18收稿)
【摘要】目的观察人参皂甙单体Rb1 对大鼠实验性脑缺血的保护作用。方法健康成年雄性清洁级SD大鼠随机分为假手术组(Sham)、缺血对照组(Con)、干预组(Tre),干预组又分为Rb130 mg/kg、60 mg/kg及90 mg/kg三个不同剂量组。缺血对照组采用线栓法建立大脑中动脉闭塞模型,缺血2 h后拨出线栓再灌注;各干预组用相应剂量Rb1 ip qd×7 d,末次给药后3 h内用同样方法建立大脑中动脉闭塞模型及再灌注;假手术组不插入线栓,余操作相同。术后48 h取标本TTC染色测梗死体积、干湿重法脑组织含水量测定、Tunnel法测定调亡细胞数及NgR表达的免疫组化测定。结果各干预组的梗死体积分别为30 mg/kg组(27.629±1.401)%,60 mg/kg组(24.164±1.710)%,90mg/kg组(21.955±2.556)%,缺血对照组为(29.846±1.153)%;脑组织含水量为30 mg/kg组(80.079±0.726)%,60 mg/kg组(78.984±0.902)%,90 mg/kg组(77.855±0.258)%,假手术组与缺血对照组分别为(76.517±0.37)%、(81.799±1.065)%;调亡细胞数分别为30 mg/kg组(89.000±10.296),60 mg/kg组(59.000±12.522),90 mg/kg组(36.667±19.054),假手术组与缺血对照组分别为(1.600±1.517)、(132.667±22.223);NgR表达阳性面积分别为30 mg/kg组(84.827±3.870),90 mg/kg组(66.040±5.541),60 mg/kg组(75.577±7.150),假手术组与缺血对照组分别为(48.355±9.720)、(91.485±5.822)。结论人参皂甙单体Rb1对大鼠实验性脑缺血有保护作用,能减轻缺血再灌注损伤所致的脑水肿及梗塞面积,减少细胞调亡,并且该保护作用呈剂量依赖性。对NgR表达的干预提示Rb1可能在脑缺血死后神经可塑性中起促进作用。
【关键词】脑缺血人参皂甙再灌注损伤Rb1NgR
【DOI】10.3969/j.issn.1007-0478.2015.04.003
Experimental study on the protection of ginseng Rb1 in rats with cerebral ischemic reperfusion injuryRenQinghua,LuoJiangbing,LiChangqing.DepartmentofNeurology,thePeople’sHospitalofJiangmenCity,GuangdongProvince,Jiangmen529000
【Abstract】ObjectiveTo observe the protection of ginseng Rb1 in rats with local cerebral ischemic reperfusion injury.MethodsHealthy Sprague-Dawley rats were divided into three groups: Sham, control and treat group. Treat group was divided into three subgroups : Rb130 mg/kg、60 mg/kg and 90 mg/kg group. MCAO models were created after seven days of Rb1 ip qd in treat group with respective dose and NS ip qd in control group.Tthe line extracted after occlusion 2 h. Sham group only receives sham operation. Rats were sacrificed at 48 h. The markers such as the expression intensity of NgR protein, brain water content, volume of infarction by TTC staining, and the count of apoptosis cell were estimated.ResultsCompared with control groups, the levels of expression of NgR protein, brain water content, volume of infarction and the count of apoptosis cell were lower in treat group and showed statistical difference (P<0.05). In treat group, there was also statistical difference between three subgroups.ConclusionsThe article show ginseng Rb1 has protective effect on rats with local cerebral ischemic reperfusion injury. Rb1 can decrease brain edema, infarction volume and apoptosis cell counting induced by local ischemic perfusion injury. It also indicates Rb1 may play a role in rehabilitation after CNS injury because Rb1 reduced the expression of NgR protein.
【Key words】Cerebral ischemiaGinsengRb1Reperfusion injuryNgR
【中图分类号】R743
【文献标识码】A
【文章编号】1007-0478(2015)04-0203-04

