舟形藻在假单胞菌菌膜上的附着及对316L不锈钢腐蚀的影响
管 方,翟晓凡,段继周,张 杰,侯保荣
(1.中国科学院海洋研究所 海洋环境腐蚀与生物污损重点实验室,青岛266071;2.中国科学院大学,北京100049)
海洋生物污损是伴随着人类的海洋开发活动而对人造海洋设施产生的一类生态危害,例如造成管线堵塞,船舶航行阻力增加,海洋平台载荷增加,并可能增加腐蚀风险,生物污损会造成巨大经济损失[1]。附着于材料表面的微生物膜是诱导生物污损进一步发展的重要原因,它也是材料腐蚀发生的重要因素[2]。钢铁构筑物等设施浸入海水环境后其表面几分钟内便形成一层富含有机质的调控膜,随后细菌、硅藻等微生物相继附着进而形成生物膜[3-5],影响这一过程的因素包括材料表面形貌[6]、表面电荷[7]和表面润湿度[8]等。细菌膜作为生物膜的重要组成之一,其形态和结构很大程度上决定了后续大型生物的附着,并影响整个生物污损过程。已有研究表明,菌膜既可以促进也能抑制其他微生物的附着[9-10]。Gawne等[11]研究了细菌对硅藻附着的影响,发现硅藻的附着随基体材料的表面电荷和材料质地不同而不同,菌膜可以通过分泌多聚糖来改变基体材料的表面电荷和质地从而影响硅藻的附着。Joint等[12]在研究浮游孢子在菌膜的附着时也得到了相似的结论。
海洋微藻是重要的污损生物之一,其在水下基体的附着是诱发其他污损生物附着的重要因素,并影响随后污损生物群落的发展。舟形藻属(Navicula)隶属于硅藻门,在金属表面的附着是一个逐级有序的过程,包括到达表面后着陆、初始附着、滑行及永久附着四个步骤[13]。舟形藻通过初期附着选择最优的生存环境,初期附着可以是暂时的也可以是永久的[14]。进入新环境后,处于悬浮状态的舟形藻细胞在重力、水流作用下到达固体表面,通过与固体表面的静电引力或与附着在固体表面有机质间的相互作用同固体表面结合。此外,菌膜的形成是海洋生物污损过程中一种常见的现象,然而海洋微藻在细菌膜上的附着规律及其对金属腐蚀的影响尚未得到足够的重视。因此,本工作采用铜绿假单胞菌(Pseudomons aeruginosa PAO1)形成菌膜,对比舟形藻在无菌膜的不锈钢试片表面的附着力及电化学腐蚀行为,就菌膜对舟形藻附着的影响及其对316L不锈钢腐蚀的影响进行了初步研究。
1 试验
1.1 试样
试验采用316L不锈钢试片,其化学成分(质量分数/%)为:C 0.022,Mn 0.97,P 0.028,Si 0.69,S 0.003,Ni 10.03,Cr 6.28,Mo 2.16,N 0.015,余量为铁。试验采用2种典型的污损微生物:铜绿假单胞 菌(Pseudomons aeruginosa PAO1)和 舟 形 藻(Navicula)。
试样尺寸为10mm×10mm×2mm,试验前试片用水砂纸逐级打磨至2000号,最后用0.3μm的Al2O3抛光粉抛光,无水乙醇擦洗,放入无水乙醇中超声清洗10min。取出晾干,在紫外照射条件下30min灭菌。
1.2 细菌培养与生长曲线测定
配制LB培养基(10.0g·L-1NaCl;10.0g·L-1胰蛋白胨;5.0g·L-1酵母提取物),调节pH至7.0,121℃灭菌30min,接种铜绿假单胞菌(P.aeruginosa PAO1)微生物菌株,置于37℃的振荡培养箱中过夜培养22h,取60μL于200mL LB培养液作为试验中用到的培养基,绿铜假单胞菌浓度大约104个/mL。
在盛有200mL LB培养基的250mL广口瓶中接种菌株铜绿假单胞菌使初始浓度为104个/mL。在33℃中培养,用平板计数法连续13d进行细菌计数,得到生长曲线。
1.3 舟形藻生长周期
在盛有200mL f/2培 养 液(NaNO37.48×10-2g·L-1;NaH2PO44.4×10-3g·L-1;Na2SiO3·9H2O 8.4×10-3~16.7×10-3g·L-1;ZnSO4·4H2O 2.3×10-5g·L-1;MnCl2·4H2O 1.78×10-4g·L-1;CuSO4·5H2O 1.0×10-5g·L-1;FeC6H5O7·5H2O 3.9×10-6g·L-1;Na2MoO4·2H2O 7.3×10-6g·L-1;CoCl26·H2O 1.2×10-5g·L-1;Na2EDTA 4.35×10-6g·L-1;维生素B12 5×10-8g·L-1;维生素B1 1×10-4g·L-1;维生素H 5×10-8g·L-1)的250mL广口瓶中接种舟形藻,使体系中舟形藻的初始浓度为130个/mL,在体系中悬挂20mm×20mm×2mm载用玻璃试片,每天取出在血小板计数器上于显微镜下计数,计算单位面积上的舟形藻数目。
1.4 原子力显微镜(AFM)附着力试验
将经打磨抛光的316L试片放入P.aeruginosa PAO1浓度为104个/mL的菌液中培养,分别于不同采样时间(1d、4d、11d)取出试片,100mmol/L PBS(磷酸缓冲液)冲洗三次以除去未粘附细胞,用原子力显微镜(日本精工,SPA400)观察。
将上述在菌液中浸没处理过的试片放在舟形藻溶液中培养,分别于不同时间(1d、10d)取出试片,用原子力显微镜观察。洁净的试片在舟形藻溶液中培养,分别于不同采样时间(1d、10d)取出试片,用原子力显微镜观察。
1.5 电化学试验
试验所用电极为316L不锈钢电极,尺寸为10mm×10mm×2mm,长约15cm的铜导线连接,用环氧树脂将电极密封,只保留10mm×10mm的工作面。将制作好的316L不锈钢工作电极用水砂纸逐级打磨至2000号,无水乙醇冲洗,放入无水乙醇中超声清洗10min。
电化学试验采用三电极体系,316L不锈钢电极为工作电极,2mm×2mm铂电极作为对电极,饱和甘汞电极(SCE)作为参比电极。文中电位若无特指,均相对于SCE。电化学阻抗谱扫描频率范围为10mHz~100kHz,电压振幅为10mV。应用ZSimpWin Version3.21电化学分析软件对试验结果进行分析。
2 结果与讨论
2.1 铜绿假单胞菌(Pseudomons aeruginosa PAO1)的生长周期
铜绿假单胞菌(P.aeruginosa PAO1)的生长曲线见图1。可以看出,P.aeruginosa PAO1在5h后即进入对数生长期,该期间细菌以二次分裂的方式快速繁殖,菌含量最高达1010~1011个/mL。48h后随着培养基中营养物质的减少和代谢废物的增多,环境不再利于细菌的生长,死亡的细菌个数超过新生的细菌个数,细菌总数开始下降。
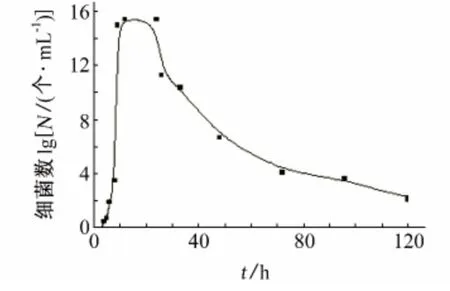
图1 铜绿假单胞菌PAO1的生长曲线Fig.1 The growth curve of Pseudomons aeruginosa PAO1
2.2 舟形藻生长周期
由图2可以看出,约5d后,舟形藻在试片表面附着,开始呈指数生长。随着环境中营养物质的消耗和代谢废物的增多,舟形藻的附着量减少,同时脱附量渐渐增多,最终达到一个动态平衡。
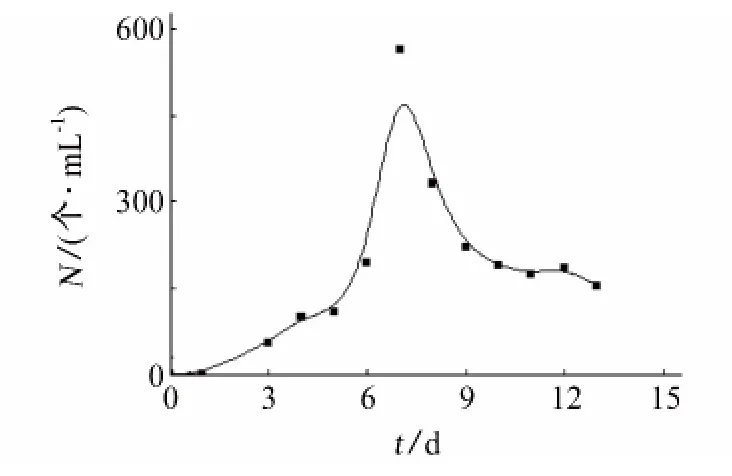
图2 舟形藻生长曲线Fig.2 The growth curve of Navicula
2.3 铜绿假单胞菌在316L不锈钢表面的附着力的变化过程
原子力显微镜观察附着力试验结果表明,不同时间内P.aeruginosa PAO1菌株在316L不锈钢表面的附着力不同。由表1可见,附着力先增大后减小,最后又增大到最大值。这可能与P.aeruginosa PAO1的活性变化及其分泌物有关,结合P.aeruginosa PAO1的生长周期可以看出,在24h内细菌处于对数增长期,繁殖迅速,细菌在试片表面附着形成菌落,故而在四种试片表面第一天时的附着力相对于其空白试样附着力都会增加,这表明了P.aeruginosa PAO1在试片表面的有效附着。随后,细菌活性下降,对试片表面的附着减弱。但是在11d的AFM附着力增大到最大值,说明PAO1细菌在316L不锈钢表面已经形成稳定的生物膜。

表1 PAO1细菌在1,4,11d时在不锈钢试片表面的附着力(nN)Tab.1 The adhesion force(nN)of PAO1on 316Lstainless steel after 1d,4d,11d
鉴于细菌在316L不锈钢表面的附着力在11d达到最大,且已经形成稳定的生物膜,因此选择菌膜形成11d时的试样与无菌膜的试样作对比,进行舟形藻在试片表面的附着试验,试验结果见表2。

表2 舟形藻在316L表面的平均附着力Tab.2 The average adhesive force of Navicula on 316Lstainless steel
由表2可知,浸泡初期(1d),有菌膜不锈钢表面的附着力低于在无菌膜不锈钢,且显著低于未浸入藻液时,这可能是因为菌膜表面物质与舟形藻间的相互作用或进入新环境后菌膜的脱落造成了附着力的降低。而浸泡后期(10d),有菌膜不锈钢表面的附着力显著高于无菌膜不锈钢,相较于初始状态也有一定升高,可见PAO1菌膜的存在显著促进了舟形藻的附着。
2.4 微生物附着的电化学分析结果
2.4.1 开路电位
如图3所示,无藻无菌膜和有藻无菌膜体系的开路电位初始值一致且明显正于有藻有菌膜的体系。试验期间,无藻无菌体系的开路电位基本稳定,仅在初始浸泡阶段有很小的波动,初始浸泡阶段2d内,开路电位发生了正移,由浸泡前的-0.228 75V升高到-0.180 67V,正移了48.08mV,可能是由于不锈钢表面钝化膜的形成造成的。随后(浸泡2~6d),电极的开路电位又逐渐负移,第6天电极的开路电位达到-0.308 78V,负移128.11mV,最后开路电位稳定在-0.31V附近。

图3 不同条件存在下的开路电位值Fig.3 The open circuit potential of 316LSS under different conditions
有藻无菌膜体系的开路电位呈现出较大的波动,光滑的316L不锈钢电极在有舟形藻溶液的开路电位明显比其在无舟形藻溶液中时更正,说明316L不锈钢在舟形藻溶液中有更大的腐蚀倾向。在有藻有菌膜的体系中,由于菌膜-硅藻-电极间复杂的相互作用[15],使得开路电位极不稳定。在有舟形藻的体系中,无论电极表面形成菌膜与否,其开路电位变化趋势一致(如图3所示):在刚浸没入培养液一周内,舟形藻的新陈代谢处于增长期,在电极表面的大量附着使316L不锈钢电极开路电位处于波动状态;一周后舟形藻的新陈代谢最高峰结束,舟形藻对电极开路电位的影响减弱,开路电位趋于稳定。
可以看出,不同体系中316L不锈钢电极的开路电位变化不同,但在浸泡大约5~8d后都趋于稳定。稳定后,各体系间开路电位大小关系为无藻无菌膜体系>有藻有菌膜体系>有藻无菌膜体系。这说明,舟形藻的存在会增加316L不锈钢的腐蚀敏感性,菌膜的形成则一定程度上降低了316L不锈钢在舟形藻Navicula溶液中的腐蚀敏感性。
2.4.2 电化学阻抗谱
图4为光滑的316L不锈钢在f/2培养液中不同条件下的Nyquist图。在无藻无菌膜、有藻无菌膜和有藻有菌膜三个体系中,316L不锈钢的容抗弧半径在经历了5~7d的迅速增大后趋于稳定。这与其开路电位5~8d后趋于稳定的变化特点相吻合。
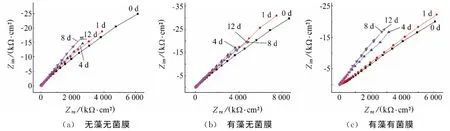
图4 光滑的316L在无舟形藻的f/2培养液中不同条件下的电化学阻抗谱Fig.4 EIS of 316LSS immersed in f/2in different conditions for different times(a) without navicula and biofilm (b) with navicula but no biofilm (c) with navicula and biofilm
图5 为316L不锈钢在f/2培养液中不同条件下的电化学阻抗谱等效电路拟合。图中,Rs表示溶液电阻,Cp表示腐蚀产物膜电容,Rp表示腐蚀产物膜电阻,Cdl表示界面双电层电容,Rct表示电荷传递电阻。相关电化学参数拟合结果见表3~表5。
由表3可知,在无藻无菌膜体系,对电阻起决定作用的是电荷传递电阻。在有藻有菌膜和有藻无菌膜体系中,出现了膜电阻。在刚开始浸泡1~2d内,有藻有菌膜的膜电阻远远大于有藻无菌膜的膜电阻,这是因为在有藻有菌膜体系的电极表面附着有稳定的菌膜。随后,有藻有菌膜体系中的伴随着菌膜的脱落,而舟形藻尚未大量附着造成膜电阻的迅速降低。有藻无菌膜体系中由于舟形藻在电极表面的大量附着,膜电阻迅速增大并趋于稳定。一周后有藻有菌膜体系中,舟形藻的大量附着使其膜电阻增大并趋于稳定。这时两个体系中的膜电阻基本相同。10~11d时,由于培养液中营养物质的消耗,附着的微藻开始大量脱落,膜电阻都急剧下降。这与AFM结果是相一致的。
2.4.3 动电位极化曲线
图6为不同条件下的316L不锈钢在f/2培养液中的动电位极化曲线。可以看出,316L不锈钢在含舟形藻培养液中的极化曲线阳极区斜率发生了明显变化,说明舟形藻的存在改变了阳极表面的腐蚀过程。表6为三种体系的动电位极化参数。

图5 316L不锈钢在f/2培养液中不同条件下的Nyquist图的等效电路拟合Fig.5 Equivalent circuit to model the Nyquist patterns of 316LSS immersed in f/2in different conditions for different times(a) without navicula and biofilm(b) with navicula but no biofilm(c) with navicula and biofilm

表3 无藻无菌膜体系的模拟电路的数据R{C[R(CR)]}Tab.3 Electrochemical parameters of 316LSS without biofilm and Navicula
由表6可见,在无藻无菌膜体系下随着时间的增长,腐蚀电位Ecorr逐渐减小,腐蚀电流密度Jcorr先增大后减小;在有藻无菌膜体系下随着时间增长,腐蚀电位Ecorr逐渐减小;腐蚀电流密度Jcorr逐渐增大。相较于无藻无菌膜体系,浸泡时间相同时,Ecorr更负,Jcorr更大。说明舟形藻存在,促进了316LSS在f/2培养液中的腐蚀。

表4 有藻无菌膜体系的模拟电路的数据R(CR)(CR)Tab.4 Electrochemical parameters of 316LSS with Navicula but no biofilm

表5 有藻有菌膜体系的模拟电路的数据R[C{R(CR)}]Tab.5 Electrochemical parameters of 316LSS with Navicula and biofilm
与前两个体系不同,在有藻有菌膜体系下随着浸泡时间增加,Ecorr和Jcorr都呈现出较大的波动,且Ecorr越负,相应的Jcorr越大。试验后期,该体系的Jcorr小于有藻无菌膜体系,表明菌膜的存在,一定程度上抑制了舟形藻对316L不锈钢的腐蚀。
3 结论
(1)原子力显微镜的附着力试验结果表明,菌膜的存在促进了舟形藻的附着。舟形藻在固体表面的附着与其生长周期呈现出一致性,说明舟形藻的附着过程与舟形藻的新陈代谢密切相关。
(2)舟形藻的存在增加了316L不锈钢的腐蚀倾向,而菌膜的存在一定程度上抑制了舟形藻对316L不锈钢的腐蚀。
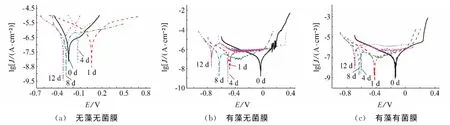
图6 不同菌膜体系下的动电位极化曲线Fig.6 Polarization curves of the 316LSS immersed in f/2culture solutionsc(a) without navicula and biofilm (b) with navicula but no biofilm (c) with navicula and biofilm

表6 不同菌膜条件下316L不锈钢在f/2培养液中的动电位极化参数Tab.6 Fitting results of polarization curves for 316LSS in f/2culture solution under different conditions
[1]MARTINEZ K,FERRER I,HERNANDO M D,et al.Occurrence of antifouling biocides in the spanish mediterranean marine environment[J].Environmental technology,2001,22(5):543-552.
[2]CASTANEDA H,BENETTON X D.SRB-biofilm in fluence in active corrosion sites formed at the steel-electrolyte interface when exposed to artificial seawater conditions[J].Corrosion Science,2008,50(4):1169-1183.
[3]许昆明.海洋生物膜的形成及其对金属腐蚀的影响[J].海洋科学,2008(9):71-75.
[4]CHAMBERS L D,STOKES K R,WALSH F C,et al.Modern approaches to marine antifouling coatings[J].Surface and Coatings Technology,2006,201(6):3642-3652.
[5]DE MESSANO L V R,SATHLER L,REZNIK L Y,et al.The effect of biofouling on localized corrosion of the stainless steels n08904and uns s32760[J].International Biodeterioration &Biodegradation,2009,63(5):607-614.
[6]SCARDINOCARDIN A J,DE NYS R.Biomimetic models and bioinspired surfaces for fouling control[J].Biofouling,2010,27(1):73-86.
[7]PETRONE L,DI F A,ALDRED N,et al.Effects of surface charge and gibbs surface energy on the settlement behaviour of barnacle cyprids(balanus amphitrite)[J].Biofouling,2011,27(9):1043-1055.
[8]SCHILP S,KUELLER A,ROSENHAHN A,et al.Settlement and adhesion of algal cells to hexa(ethylene glycol)-containing self-assembled monolayers with sys-tematically changed wetting properties[J].Biointerphases,2007,2(4):143-150.
[9]付玉斌.细菌生物膜与海洋附着生物之间的生化作用[J].材料开发与应用,1999(3):39-41.
[10]DUAN J Z,WU S R,ZHANG X,et al.Corrosion of carbon steel influenced by anaerobic biofilm in natural seawater[J].Electrochimica Acta,2008(54):22-28.
[11]GAWNE B,WANG Y,HOAGLAND K D,et al.Role of bacteria and bacterial exopolymer in the attachment of achnanthes longipes(bacillariophyeae)[J].Biofouling,1998,13(2):137-156.
[12]JOINT I,CALLOW M E,CALLOW J A,et al.The attachment of Enteromorpha zoospores to a bacterial biofilm assemblage[J].Biofouling,2000,16(2/4):151-158.
[13]WETHERBEE R,LIND J L,BURKE J,et al.Minireview-the first kiss establishment and control of initial adhesion by rapid diatoms[J].Journal of Phycology,1998,34:9-15.
[14]高运华,李建军.微生物粘膜对海洋大型污损生物附着的影响[J].材料开发与应用,1999(4):19-21,41.
[15]罗岳平,李益健,谭智群.细菌和藻类的粘附行为及其生态学意义[J].生态学杂志,1996(5):55-61.

