镉胁迫对尾巨桉幼苗生长和生理特性的影响
刘国粹,杜阿朋,李 慧,王志超,张利丽,竹万宽,陈少雄
镉胁迫对尾巨桉幼苗生长和生理特性的影响
刘国粹,杜阿朋,李 慧,王志超,张利丽,竹万宽,陈少雄*
(国家林业局桉树研究开发中心,广东湛江 524022)
以尾巨桉(DH32-29)幼苗为试验材料,以植株的生长指标(苗高、地径、叶面积)、生物量、根冠比、氮平衡指数(NBI)、叶绿素相对含量(SPAD值)、丙二醛(MDA)含量和叶绿素荧光参数为指标,通过盆栽试验设置8个10 ~ 140 mg·kg-1浓度镉(Cd)盐溶液处理,研究了不同浓度Cd胁迫处理下尾巨桉幼苗的形态和生理特性变化规律。结果显示:低浓度(10 mg·kg-1)Cd处理对尾巨桉幼苗的形态和生理特性无明显影响。当Cd浓度大于20 mg·kg-1,随着Cd浓度的逐渐增大,其对尾巨桉幼苗的伤害程度也逐渐增加,主要表现为:植株生长缓慢、生物量减小、叶绿素相对含量和叶绿素荧光参数(Fv/Fm、φPSⅡ、NP、NBI)均下降,qP无明显变化,MDA含量升高。Cd浓度大于60 mg·kg-1以上时,尾巨桉幼苗生长出现一定程度上的损伤症状和生长停滞现象。结果表明低浓度(≤20 mg·kg-1)Cd处理下尾巨桉幼苗能正常生长,随着浓度的增大,Cd处理对尾巨桉的形态和生理特性造成显著影响。同时结合部分桉树适生区土壤Cd含量调查及相关研究结果认为,尾巨桉具有一定修复Cd污染区土壤的潜力。
尾巨桉;镉(Cd)胁迫;生长指标;生理指标;生物修复
土壤是人类社会所处自然环境的一部分,也是森林生态系统的重要组成部分。随着我国工业化、城市化和农业集约化的不断发展,土壤污染问题日益突出[1],工业矿区、城市、耕地等地土壤均受到镉(Cd)、锰(Mn)、铅(Pb)等重金属的严重污染[2-5],尤其是Cd污染。与其他植物生长的非必需元素相比,Cd具有更强的从土壤向植物迁移的能力,严重威胁着人类的生命安全和健康[6]。
目前对土壤重金属修复的技术主要有工程措施、物理化学修复、化学修复、农业生态修复和生物修复5种。虽然前4种技术对重金属污染的治理效果较好,但这些方法存在实施工程量大、投资费用高、破坏土体结构、引起土壤肥力下降、暂时性修复、修复周期长、效果不显著且需要特殊仪器设备和专门技术人员等缺点,另外还可能导致二次污染,不能从根本上解决问题[7];而生物修复,尤其是植物修复效果好,易于操作,日益受到人们的重视,已经成为污染土壤修复研究的热点[8]。大量研究发现,一些草本植物如遏蓝菜属()、印度芥菜()[9]、东南景天()[10]、续断菊()[11-13]和苎麻()[14]等对Cd具有吸收和富集功能,但这些植物的经济利用价值不高。目前对经济利用价值较高的相关木本植物研究较少,仅有杨树()[15]、忍冬()[16]等少量报道。
桉树()是世界公认的三大速生丰产用材林树种之一,在我国南方有很重要的战略地位,为国民经济发展提供了大量木材。研究表明,桉树在诸多土壤重金属污染严重的矿区植被恢复中发挥了重要作用[17]。杨胜香[18]研究发现,在土壤受Mn、Pb、Cd、Cu等重金属元素严重污染的广西八一矿区,桉树树体中Cd含量均较高,远超过了正常植物含量上限值(1 mg·kg-1),且生长良好。这些都为桉树能成为重金属Cd的超累积植物提供了一定的理论参考。与相关的草本植物相比,桉树不仅能吸附可观的重金属Cd,还能将其长期固定在自身木材当中,不会对人体造成危害,并且桉树在我国南方栽植范围广、面积大,因此对桉树重金属修复能力的研究具有一定现实意义。本研究在雷州半岛通过盆栽控制试验,模拟我国南方地区土壤Cd污染状况(大多污染范围是0 ~ 10 mg·kg-1,也有污染严重的,最大值达到248 mg·kg-1[19]),设置了不同的Cd含量梯度处理。通过研究Cd胁迫下尾巨桉DH32-29无性系幼苗的形态和生理特性响应,摸索桉树对重金属Cd的耐受能力,为重金属Cd污染地区的植被恢复以及拓展桉树利用途径提供理论依据。
1 材料与方法
1.1 材料
试验在广东湛江市南方国家级林木种苗示范基地荫棚内进行,试验材料采用尾巨桉DH32-29无性系幼苗。2013年11月份选取生长健康、大小一致(株高:19.86±0.28 cm、地径:0.752±0.016 mm)的组培幼苗进行盆栽,每盆栽植1株。栽培基质为河沙:红土1:5(体积比),每盆基质为50 kg。土壤理化性质分别为:N 1.29 g·kg-1,P 0.571 g·kg-1,K 2.098 g·kg-1,有机质14.52 g·kg-1,pH 5.52,控释肥150 g·盆-1。于2014年1月11日开始进行Cd胁迫处理,分为9组,每组15株,栽植135盆,1组作为对照,其余8组进行Cd胁迫处理,以CdCl2·2.5 H2O盐溶液的形式一次性加入,设10、20、40、60、80、100、120、140 mg·kg-1共8个浓度水平,以清水作为对照,处理后第1次浇透水,之后每2 d浇水200 mL,并在盆下放置塑料托盘,浇水后,将盘内渗出水分倒回至盆中,以免Cd元素流失。
1.2 分析测定方法
处理后2个月测定各项生长和生理指标。每个浓度处理中选取3株平均幼苗,选取完全展开的第4 ~ 6片功能叶,用FMS-2型脉冲调制式叶绿素荧光分析仪测定不同Cd浓度处理幼苗的叶绿素荧光参数(Fv/Fm、φPS、qP 和qNP)并进行光适应和暗适应测定。将叶夹夹在不同处理植株的第4 ~ 6片叶中间,先对其进行光适应测定,再对其暗适应15 min,进行暗适应测定,每项测定重复3次。光化学强度为400 umol·m2·s-1,饱和闪光强度为8 000 umol·m2·s-1。
/=()/(1)
=(´)/;=(´)/(´) (2)
(3)
=(´)/() (4)
式(1) ~ (4)中:为黑暗中最大可变荧光;为暗适应下的最大荧光;为暗适应后的最小荧光;为光适应下的最大荧光;为光适应下的稳定态荧光。
用Dualex 4氮平衡指数测量仪对其进行相同叶位的氮平衡指数、叶绿素相对含量(SPAD)的测量。采取测量过的叶片,采用硫代巴比妥酸法对其进行丙二醛(MDA)含量的测定[20]。
用CI-203手持式激光叶面积仪测定植株叶面积,同时测量苗高、地径后,每浓度处理将上述选取的3株进行破坏性采样,测定各部分(根、枝干、叶)的生物量。
1.3 数据处理
用Excel软件进行数据处理和制表,用SPSS 19.0对数据进行单因素方差分析(One-way ANOVA)和Duncan多重检验。
2 结果分析
2.1 Cd胁迫对尾巨桉幼苗生长形态特性的影响
2.1.1 Cd胁迫对尾巨桉幼苗生长形态的影响
由表1可知,不同Cd浓度溶液胁迫处理2个月后,其对尾巨桉幼苗的形态指标影响显著。随着Cd处理浓度的增大,尾巨桉幼苗苗高、地径和叶面积均大致呈现减小的趋势。与对照的苗高相比,10 mg·kg-1Cd盐溶液处理下的苗高与其差异不显著(<0.05),两者处理下的苗高均显著大于其他7个处理,20 mg·kg-1Cd处理下的尾巨桉幼苗苗高与40 mg·kg-1、60 mg·kg-1和80 mg·kg-1的无显著差异,但显著大于100 ~ 140 mg·kg-1的3个处理,而40 ~ 140 mg·kg-1的6个处理之间差异不显著。
与对照的地径相比,10 mg·kg-1处理下与其差异不显著,其余7个处理均显著小于对照,20 mg·kg-1处理与10 mg·kg-1处理之间差异不显著,但两者均显著大于40 ~ 140 mg·kg-1的6个处理。
从尾巨桉幼苗的叶面积看,对照的叶面积达8 767.8cm2,显著大于8个Cd盐溶液处理,10 ~ 60 mg·kg-14个处理的叶面积大小差异显著:10 mg·kg-1(5 977.8cm2)>20 mg·kg-1(3 196.0cm2)>40 mg·kg-1(1 883.7cm2)>60 mg·kg-1(486.8cm2),80 ~ 140 mg·kg-1的4个处理间差异不显著,但4者均显著小于对照及其他4个处理。
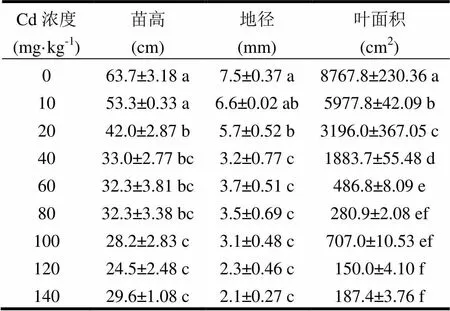
表1 Cd胁迫对尾巨桉幼苗生长形态的影响
注:同列数据后不同小写字母表示不同Cd浓度处理间差异显著(<0.05),数据为平均值±标准误,下同。
2.1.2 Cd胁迫对尾巨桉幼苗生物量的影响
由表2可知,随着Cd盐处理溶液浓度的增加,尾巨桉幼苗的根、枝干、叶和总生物量均呈不断减小的趋势。8个Cd盐处理下的尾巨桉幼苗生物量(包括根、枝干、叶和总生物量)均显著小于对照,其中表现最好的10 mg·kg-1Cd盐溶液处理下的根、枝干、叶和总生物量分别为对照的47.19%、61.06%、69.66%和62.96%,而表现最差的140 mg·kg-1Cd盐溶液处理下的根、枝干、叶和总生物量分别仅为对照的6.66%、3.06%、3.98%和4.10%。对于8个Cd盐处理的枝干、叶和总生物量,60 ~ 140 mg·kg-15个处理之间差异均不显著且均显著小于10 ~ 40 mg·kg-1的3个处理,10 ~ 40 mg·kg-1的3个处理间生物量差异显著,其大小排序均为10 mg·kg-1处理> 20 mg·kg-1处理> 40mg·kg-1处理。对于8个Cd盐处理的根生物量,40 ~ 140 mg·kg-16个处理之间差异均不显著且均显著小于10 mg·kg-1处理和20 mg·kg-1处理,后两者之间根生物量差异显著,且10 mg·kg-1处理(5.46 g·株-1)> 20 mg·kg-1处理(2.47 g·株-1)。
根冠比能反映植物幼苗地上和地下部分生长发育情况,其值高则意味着根系机能活性强,其值低则意味着根系机能活性弱[21]。经Cd处理尾巨桉幼苗后,根冠比随Cd质量浓度的增大而呈先减小再增大的趋势。本研究中对照的根冠比显著大于10 ~ 40 mg·kg-1的3个处理,但显著小于其他5个处理,9个处理中的80 mg·kg-1处理下的尾巨桉幼苗根冠比最大(0.607),10 mg·kg-1处理的最小(0.140)。
表2 不同浓度Cd胁迫处理的尾巨桉幼苗生物量分配特征
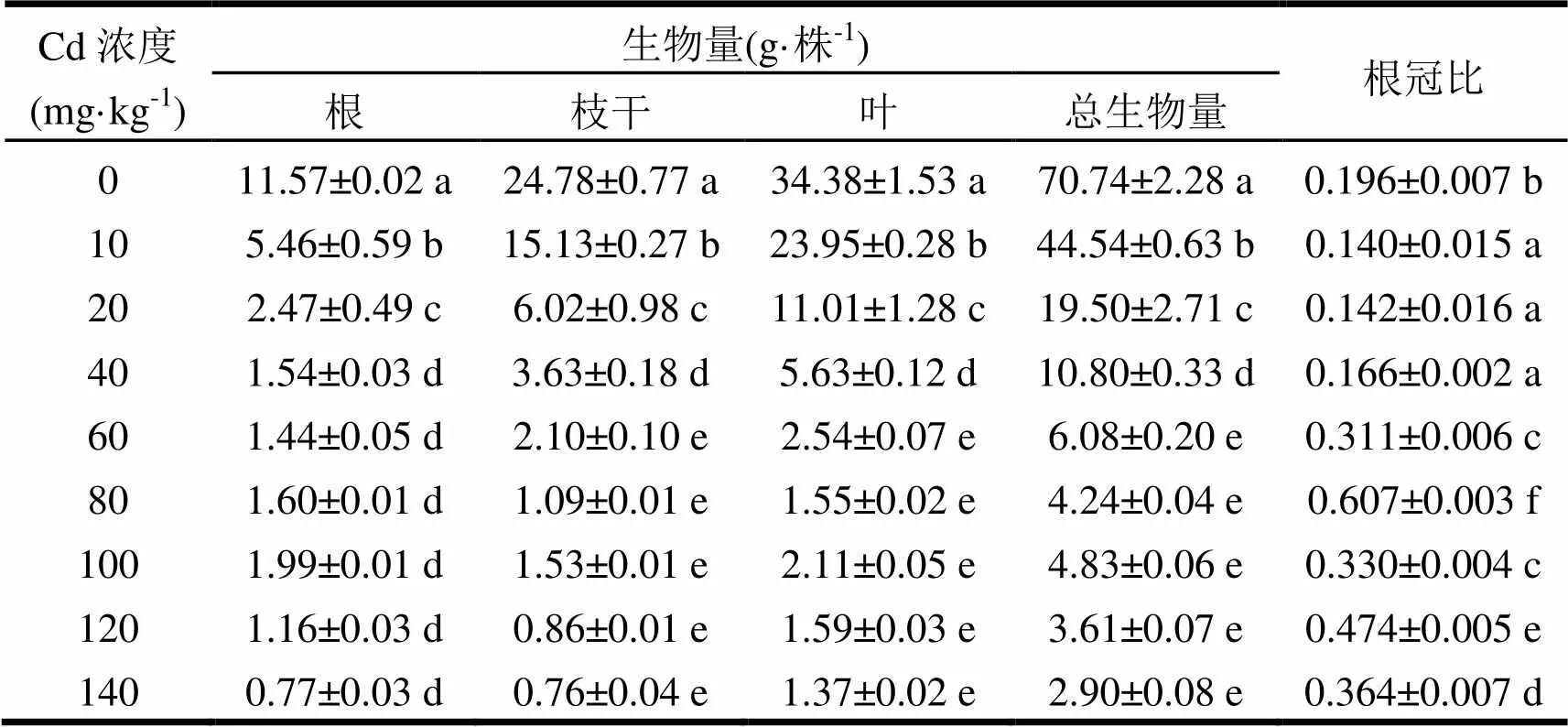
Cd浓度(mg·kg-1)生物量(g·株-1)根冠比 根枝干叶总生物量 011.57±0.02 a24.78±0.77 a34.38±1.53 a70.74±2.28 a0.196±0.007 b 105.46±0.59 b15.13±0.27 b23.95±0.28 b44.54±0.63 b0.140±0.015 a 202.47±0.49 c6.02±0.98 c11.01±1.28 c19.50±2.71 c0.142±0.016 a 401.54±0.03 d3.63±0.18 d5.63±0.12 d10.80±0.33 d0.166±0.002 a 601.44±0.05 d2.10±0.10 e2.54±0.07 e6.08±0.20 e0.311±0.006 c 801.60±0.01 d1.09±0.01 e1.55±0.02 e4.24±0.04 e0.607±0.003 f 1001.99±0.01 d1.53±0.01 e2.11±0.05 e4.83±0.06 e0.330±0.004 c 1201.16±0.03 d0.86±0.01 e1.59±0.03 e3.61±0.07 e0.474±0.005 e 1400.77±0.03 d0.76±0.04 e1.37±0.02 e2.90±0.08 e0.364±0.007 d
2.2 Cd胁迫对尾巨桉幼苗叶绿素荧光特性的影响
光系统Ⅱ(PSⅡ)是植物光合作用中光反应的重要组成部分,叶绿素荧光特性是PSⅡ光化学过程的指示器[22]。由表3可知,随着Cd盐处理浓度的增大,荧光参数PSⅡ最大光能转换效率、实际光化学效率和非光化学猝灭系数均呈下降趋势,而光化学猝灭系数却呈现出逐渐增大趋势。与对照相比,Fv/Fm下降了0.24% ~ 7.46%,10 mg·kg-1处理和20 mg·kg-1处理与对照差异不显著,其余高浓度处理均显著小于对照,20与40、60和80 mg·kg-1处理差异不显著,但与其余3个浓度差异显著。实际电子传递效率φPSⅡ比对照下降了1.20% ~ 11.84%,除120和140 mg·kg-1处理显著低于对照,其余6个低浓度处理均与对照差异不显著。当Cd浓度为140 mg·kg-1时,qP最大,比对照增加了7.23%。除最高浓度显著大于对照外,其余浓度处理的qP均与对照差异不显著。各浓度与对照相比热能耗散参数Np下降了4.00% ~ 63.33%。3个低浓度降幅不大,均与对照差异不显著。当浓度≥60 mg·kg-1,φPSⅡ显著低于对照。由分析可知,镉胁迫对尾巨桉幼苗PSⅡ功能造成了一定影响,PSⅡ反应中心受到损伤,实际光化学效率降低。
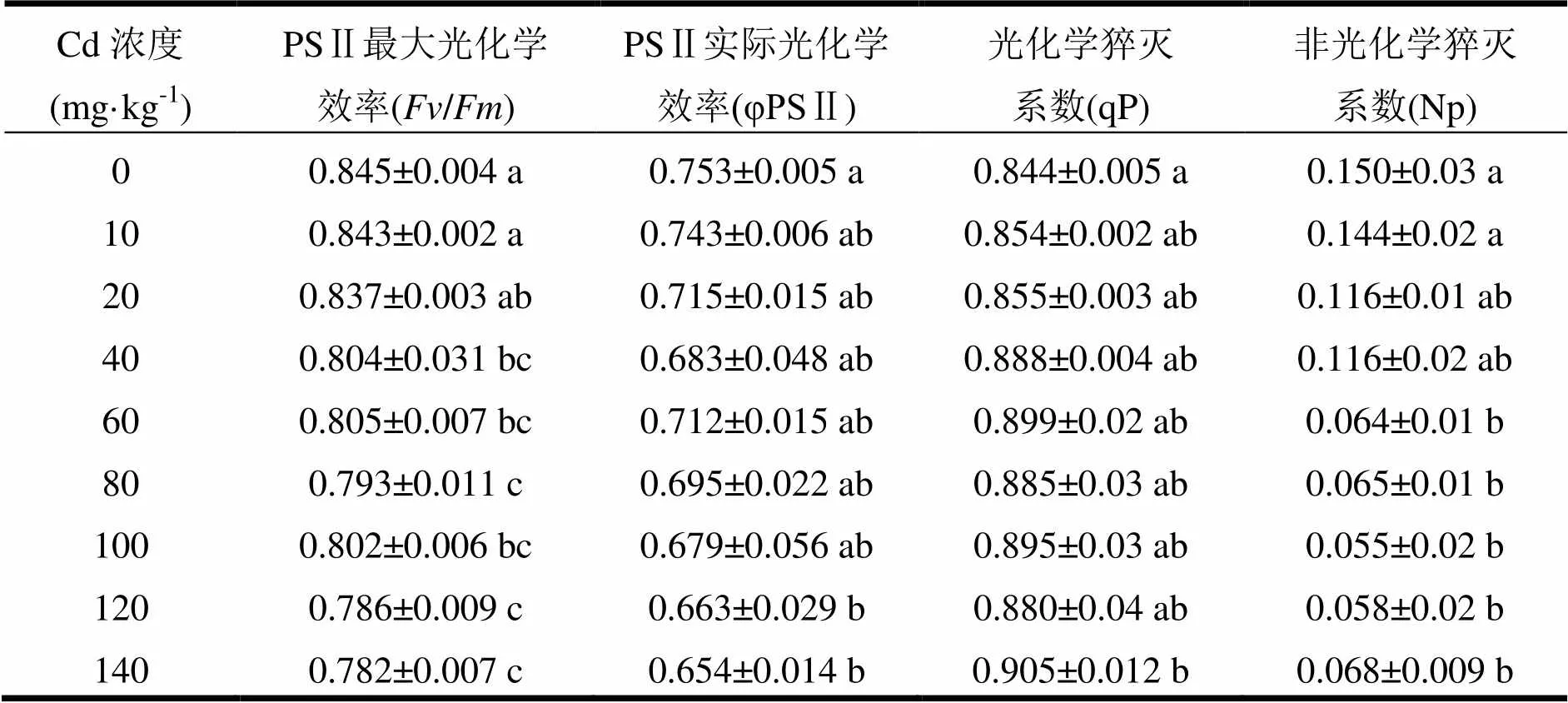
表3 Cd胁迫对尾巨桉幼苗叶绿素荧光参数的影响
2.3 Cd胁迫对尾巨桉幼苗叶绿素相对含量、氮平衡指数和丙二醛含量的影响
SPAD值是用数字来表示目前与叶片中叶绿素相对含量的参数[23],从某种程度可反映植物健康状况。由表4可知,随着Cd处理浓度的增大,SPAD值基本呈现减小趋势。8个Cd处理均显著小于对照,60 mg·kg-1处理下的SPAD值显著小于其余7个Cd处理,除60 mg·kg-1处理外的7个Cd处理下的SPAD值彼此差异不显著。

表4 Cd胁迫对尾巨桉幼苗叶绿素相对含量(SPAD值)、氮平衡指数(NBI)和丙二醛(MDA)含量的影响
氮平衡指数(Nitrogen Balance Index, NBI)是反映植物生长势的重要指标,也是重要的胁迫荧光参数[24]。本研究中随着Cd盐溶液处理浓度的增加,尾巨桉幼苗的NBI呈现逐渐减小的趋势。与对照相比,除10 mg·kg-1NBI变化不显著外,其余7个Cd盐溶液处理均显著小于对照,其NBI较对照减少了25.74% ~ 44.85%。除10 mg·kg-1外的7个Cd盐溶液处理中,20与60 mg·kg-1处理间差异不显著,40、60、80、120和140 mg·kg-1处理间差异不显著。
丙二醛(MDA)是膜脂过氧化的产物,其含量高低反映了细胞过氧化水平和膜受伤害程度[25]。MDA含量随着Cd浓度增大而明显升高,与对照相比,8个Cd处理下的MDA含量均显著大于对照(<0.05),其中120 mg·kg-1处理的MDA含量最大(3.47umol·g-1),为对照的2.31倍;10 mg·kg-1处理的最小(1.60 umol·g-1),为对照的1.07倍。除20和40 mg·kg-1、60和80 mg·kg-1差异不显著外,各浓度处理之间均呈显著性差异。
3 结论与讨论
本研究结果表明不同程度的Cd胁迫对尾巨桉幼苗的生长性状和生理特征产生了明显的影响。于静波[25]的研究表明,当环境中的Cd含量浓度达到一定程度后会对植物产生一定的毒害作用,造成植物生理代谢紊乱,抑制生长发育,甚至导致死亡。本研究结果显示,随着Cd盐溶液浓度的增加,尾巨桉幼苗的生长特征(地径、苗高、叶面积)和各部分生物量(根、枝干、叶和总生物量)均呈现降低的趋势,而根冠比呈现先降低后增大趋势,这与蔺晓晖等[26]对107杨树的研究结果有所不同,这可能是由于尾巨桉幼苗根部受到迫害比地上部分早,较低浓度时(<20 mg·kg-1)大部分Cd累积在根部,而向地上部分迁移量少[27-28],根部比地上部分生长提前进入生长停滞状态从而造成根冠比下降(20 mg·kg-1时降为0.142,仅为对照的72.45%)。但当较高浓度的Cd胁迫进一步影响到根系同化物质的能力时,其迫使尾巨桉幼苗地上部分生长停滞,从而导致了根冠比有所回升。尾巨桉幼苗地上地下生物量比例的变化正是其应对环境胁迫的基本响应机制之一[29-30]。
本试验结果中,处理2个月的尾巨桉幼苗叶片中MDA含量随着Cd浓度升高而显著升高,说明Cd处理可使活性氧含量大量增加,并对植株造成氧化损伤。不同Cd胁迫处理下植株叶片的MDA含量是对照的1.07 ~ 2.31倍,可见Cd胁迫对尾巨桉幼苗产生了明显的毒害。
有许多研究表明Cd能抑制植物光合作用[31]。低浓度的Cd处理对桉树幼苗PSⅡ功能几乎无影响,随着浓度的增大,PSⅡ功能受到影响。这与吴坤等[30]对烟草的研究结果相符。Fv/Fm的降低表明Cd对PSⅡ反应中心造成了损伤,可能是光合作用的原初反应受到抑制,阻碍了其光合电子的传递。φPSⅡ是实际光化学效率,反映了PSⅠ与PSⅡ之间的电子传递情况,其与碳同化、光呼吸和依赖O2的电子流有关。Cd胁迫造成φPSⅡ下降,可能是叶绿体膜系统受Cd影响所引起的[32]。植物吸收超过自身利用的过剩能量时,会通过把过激能量转化为热能的形式耗散(Np)的途径来保护光合机构免受伤害。Np不断下降,可能是由于随着Cd浓度的增大,叶绿素含量不断减少,PSⅡ反应中心遭到破坏,而使其吸收的光能总量不断减少,从而导致Np不断下降。
相关研究显示,在适宜桉树生长的广东、广西、福建等地区,受到重金属污染大多数地区(农田、城市、海湾等)[33-36]的土壤Cd含量均低于10 mg·kg-1(最低浓度),只有少数污染严重的重金属矿区[19,37-38](部分为表土层)超过了10 mg·kg-1。本研究中8个Cd浓度胁迫下的尾巨桉幼苗生长和生理虽受到不同程度的影响,但均能存活,尤其是10 mg·kg-1处理下的尾巨桉幼苗,部分生长和生理各指标与对照相比差异不显著。余娜等[27]的研究表明,桉树可富集Cd高达9.06 mg·kg-1,这也与先前已有的关于“桉树对Cd的抗性较强、对土壤重金属Cd污染有修复效果[27,39-40],和其他植物配置适合进行矿区修复”的结论相符。
[1] 杭小帅,王火焰,周健民.长江三角洲地区土壤重金属污染的防治与调控[J].土壤通报,2013,44(1):245‒251.
[2] 宋伟,陈百明,刘琳.中国耕地土壤重金属污染概况[J].水土保持研究,2013,20(2):293‒298.
[3] 李玲,高畅,董洋洋,等.典型煤矿工业园区土壤重金属污染评价[J].土壤通报,2013,44(1):227‒231.
[4] 王莹,陈玉成,李章平.我国城市土壤重金属的污染格局分析[J].环境化学,2012,31(6):763‒770.
[5] 鲁言波,冯茜丹.珠江三角洲土壤中重金属污染特征分析[J].广东农业科学,2012,(14):169‒171.
[6] Liu X,Song Q,Tang Y,et al.Human health risk assessment of heavy metals in soil–vegetable system:A multi‒medium analysis[J].Science of the Total Environment,2013,(463‒ 464):530‒540.
[7] 鲍桐,廉梅花,孙丽娜,等.重金属污染土壤植物修复研究进展[J].生态环境,2008,17(2):858‒865.
[8] 崔斌,王凌,张国印,等.土壤重金属污染现状与危害及修复技术研究进展[J].安徽农业科学,2012,40(1):373‒375.
[9] 李玉双,孙丽娜,孙铁珩,等.超富集植物叶用红菾菜(L)及其对Cd的富集特征[J].农业环境科学学报,2007,26(4):1386‒1389.
[10] Zhou W B, Qiu B S. Effects of cadmium hyperaccumulation on physiological characteristics ofHance (Crassulaceae)[J].Plant Science,2005,169(4):737‒ 745.
[11] Zu Y Q, Li Y, Schvartz C. Accumulation of Pb、Cd、Cu and Zn in plants and hyperaccumulator choice in lanping lead‒zinc mine area, China[J]. Envrionment Interational, 2004,30(4),567‒576.
[12] 李元,方其仙,祖艳群.2种生态型续断菊对Cd的累积特征研究[J].西北植物学报,2008,28(6):1150‒1154.
[13] 秦丽,祖艳群,李元.Cd对超累积植物续断菊生长生理的影响[J].农业环境科学学报,2010,29(S1):48‒52.
[14] 沈莉萍.重金属污染土壤上苎麻的修复作用及组合修复效果研究[D].南京:南京农业大学,2009.
[15] Vandecasteele B,Lauriks R, De Vos B,et al.Cd and Zn concentration in hybrid poplar foliage and leaf beetles grown on polluted sediment‒derived soils[J].Environmental Monitoring Assessment, 2004,89(3):263‒283.
[16] 刘周莉,何兴元,陈玮.忍冬——一种新发现的镉超富集植物[J].生态环境学报,2013,22(4):666‒670.
[17] 康敏明,陈红跃,陈传国,等.重金属污染下台湾相思和尾叶桉根区土壤微生物群落多样性[J].华东师范大学学报(自然科学版),2009,2009(2):50‒60.
[18] 杨胜香.广西锰矿废弃地重金属污染评价及生态恢复研究[D].桂林:广西师范大学,2007.
[19] 常青山,马祥庆,王志勇.南方重金属矿区重金属的污染特征及评价[J].长江流域资源与环境,2007,16(3):395‒ 399.
[20] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[21] 王同顺,孙保平,冯磊,等.不同水分处理对甘蒙柽柳幼苗根系生长特性的影响[J].生态学杂志,2013,32(3):591‒596.
[22] 孙洪刚,刘军,董汝湘,等.水分胁迫对毛红椿幼苗生长和生物量分配的影响[J].林业科学研究,2014,27(3):381‒ 387.
[23] Huang J L,He F,Cui K H,et al.Determination of optimal nitrogen rate for rice varieties using a chlorophyll meter[J].Field Crops Research,2008,105(1‒2):70‒80.
[24] 宋森楠,宋晓宇,陈立平,等.冬小麦氮平衡指数与籽粒蛋白质含量空间结构及关系[J].农业工程学报,2013,29 (15):91‒97.
[25] 于静波.Cd,Pb及其复合胁迫对樟树生理特性的影响[D].福州:福建农林大学,2012.
[26] 蔺晓晖,段爱国,何彩云,等.镉胁迫对107 杨幼苗光合作用和干物质分配的影响[J].林业科学研究,2012,25(5): 651‒656.
[27] 余娜,何淑琼,卢雅莉,等.工业污染地6种乔木树种重金属累积特征研究[J].生态环境学报,2010,19(9):2214‒ 2218.
[28] 刘旭辉,李月兰,李秋明,等.锌和镉胁迫下的桑树幼苗盆栽试验[J].江苏农业科学,2012,40(4):335‒339.
[29] Siemens D H, Duvall‒Jisha J, Jacobs J, et al. Water deficency induces evolutionary tradeoff between stress tolerance and chemical defense allocation that may help explain range limits in plants[J].Oikos,2012,121(5):790‒ 800.
[30] 吴坤,吴中红,邰付菊,等.镉胁迫对烟草叶激素水平、光合特性、荧光特性的影响[J].生态学报,2011,31(16): 4517‒4524.
[31] 王帅,梁英,冯力霞,等.重金属胁迫对杜氏盐藻生长及叶绿素荧光特性的影响[J].海洋科学,2010,34(10):38‒48.
[32] Vassilev A,Lidon F,Scotti P,et al.Cadmium‒induced changes in chloroplast lipids and photosystem activities in barley plants[J].Biologia Plantarum,2004,48(1):153‒156.
[33] 陈海珍,龚春生,李文立,等.广州市不同功能区土壤重金属污染特征及评价[J].环境与健康杂志,2010,27(8):700‒ 703.
[34] 郭鹏然,仇荣亮,王畅,等.珠江口桂山岛沉积物中重金属的污染评价和形态分布特征[J].海洋环境科学,2011, 30(2):167‒171.
[35] 刘国强,张春华,魏春雷,等.广西廉州湾沉积物重金属污染现状及其生态风险评价[J].海洋通报,2012,31(6):707‒ 712.
[36] 关共凑,李雄文,张铭康,等.佛山市城郊菜地土壤重金属污染状况调查与评价[J].佛山科学技术学院学报(自然科学版),2012,30(3):7‒12.
[37] 项萌,张国平,李玲,等.广西铅锑矿冶炼区表层土壤重金属污染的分布规律[J].矿物学报,2011,31(2):250‒255.
[38] 李雪华,徐鹏,李俊青,等.广西大厂矿区沉积物重金属污染及风险评价[J].中北大学学报(自然科学版),2012, 33(2):190‒196.
[39] 侯晓龙,庄凯,刘爱琴,等.不同植被配置模式对福建紫金山金铜矿废弃地土壤质量的恢复效果[J].农业环境科学学报,2012,31(8):1505‒1511.
[40] 张婧,杜阿朋.桉树在土壤重金属污染区土壤生物修复的应用前景[J].桉树科技,2010,27(2):43‒47.
Morphological and Physiological Characteristics of×(DH32-29) Seedlings Under Different Cadmium Concentrations
LIU Guo-cui, DU A-peng, LI Hui, WANG Zhi-chao, ZHANG Li-li, ZHU Wan-kuan, CHEN Shao-xiong
(,524022,,)
Cadmium is one of the most common heavy metals causing soil contamination problems. Bioremediation is an effective way to rehabilitate soils contaminated with this comp. An pot trial was conducted to measure various morphological and physiological indices of(DH32-29) grown under treatments of eight different soil concentrations of Cadmium (Cd) ranging from 10 to 140 mg·kg-1. There were no significant differences found among seedling grown at low concentration (10 mg·kg-1) of Cd and the control (i.e. no Cadmium). Under higher Cd concentrations (>20 mg·kg-1) seedling growth was significantly impacted. As Cd concentration increases, the biomass, chlorophyll content, fluorescent parameter (PSⅡ), maximum photochemical quantum yield (Fv/Fm), efficiency of PSⅡ photochemistry (φPSⅡ), non-photochemical quenching coefficient (Np) and nitrogen balance index (NBI) decreased, photochemical quenching (qP) showed little change, whilst malondialdehyde (MDA) increased. Seedlings of clone DH32-29show clear visible symptoms of injury at levels above 20 mg·kg-1and at plant growth stagnated at Cd concentration exceeding 40 mg·kg-1. It was concluded that DH32-29seedlings can grow normally at lower Cadmium concentrations (≤20 mg·kg-1). But as the concentration increases, above this level, the morphological and physiological characteristics of seedlings start to display significant impacts. Surveys of soil Cadmium levels in areas suited toplantations and related research results in combination with this current study illustrate the potential soil remediation value of DH32-29for areas where soils are affected by Cd pollution.
; cadmium treatment; growth index; physical sign; bioremediation
S718.55+1.2
A
2015-03-02
林业科技创新平台运行补助项目——广东湛江桉树生态系统定位观测研究站(2014-LYPT-DW-027)
刘国粹(1989— ),女,在读硕士研究生,主要从事桉树定向培育及生态经营等研究.E-mail: gcliu518@163.com
陈少雄(1965— ),男,博士,研究员,主要从事桉树培育和土壤研究.E-mail: sxchen01@163.com

