不同强度耐力运动对大鼠心房TGF-β1/miR-21信号途径的影响
王世强,常 芸,马晓雯,饶志坚
不同强度耐力运动对大鼠心房TGF-β1/miR-21信号途径的影响
王世强1,2,常 芸1,马晓雯1,饶志坚1,2
目的:通过建立长期大强度运动动物模型,研究不同强度耐力运动对大鼠心房羟脯氨酸含量的影响以及TGF-β1/miR-21信号途径的调节作用,为运动性心房纤颤的发生机制提供实验依据。方法:72只健康成年雄性SD大鼠随机分为安静组、中等强度组和大强度组,每组24只。分别进行8周、12周和16周运动,每周训练5天,休息2天,每次运动1 h。运动8周、12周和16周后24 h内处死取材摘取心脏,分离出右心房。采用酶联免疫法检测血清cTnI的含量;样本碱水解法检测羟脯氨酸的含量;荧光定量PCR检测TGF-β1和miR-21的含量。Western Blot检测TGF-β1蛋白表达。结果:大强度组8周、12周和16周大鼠血清cTnI的含量均显著高于安静组和中等强度组(P<0.01),中等强度组8周、12周和16周大鼠cTnI的含量均无显著变化。8周运动后,各组之间羟脯氨酸的含量无明显差异;12周和16周大强度组羟脯氨酸的含量显著高于各自的安静组和中等强度组(P<0.01),中等强度组和安静组之间没有显著性差异。随着运动时间延长,大强度组羟脯氨酸的含量有逐渐增加趋势,16周羟脯氨酸的含量显著高于8周大强度组(P<0.05)。8周、12周和16周大强度组TGF-β1基因和蛋白的表达均显著高于各自安静组,而中等强度组和安静组之间TGF-β1的表达无明显差异。随着运动时间延长,大强度组TGF-β1的含量有逐渐降低的趋势。8周、12周和16周运动后,与各自安静组相比,大强度组miR-21的表达均显著性增加(P<0.05),随着运动时间延长,大强度组miR-21的含量有逐渐降低的趋势,16周大强度组miR-21的表达显著低于8周大强度组(P<0.05),中等强度组和安静组之间miR-21的表达无明显差异。结论:长期大强度运动导致大鼠心肌损伤长期存在,并伴随大鼠心房胶原蛋白的持续增加,诱发了心房纤维化,构成了运动性心房纤颤的病理基础。长期大强度运动通过上调大鼠心房TGF-β1/miR-21信号通路,可能介导了运动性心房损伤纤维化的发生。
运动;鼠;心房纤维化;羟脯氨酸;转化生长因子;microRNA-21
有流行病学研究表明,长期从事耐力运动项目运动员心房纤颤(房颤)的发生率明显高于其他项目运动员[2,3]。有调查研究发现,耐力运动员房颤的发生率在0.3%~12.8%之间,远高于正常人群[49]。研究发现,耐力运动员房颤的发生与从事大强度运动的累积时间呈正相关[36]。以往多数研究认为,长期大强度运动造成的炎症反应、心房扩张、自主神经系统发生变化和电解质紊乱是造成房颤的重要发生机制[39,44,50]。近年的一些研究证实,长期大强度运动造成心肌损伤并持续存在,最终导致心房纤维化,可能是房颤发生的重要病理变化[9,12,19,21]。有研究通过天狼星红染色也发现,12周的大强度运动导致大鼠心房发生纤维化,且随时间延长,纤维化的程度逐渐增高[5]。
心房纤维化是指心房中的胶原纤维异常增加的现象。过度增加的胶原纤维影响心肌细胞间的电信号传导,促使房颤的发生与维持[25]。研究表明,转化生长因子-β1(transforming growth factor-β1,TGF-β1)在炎症和组织修复等方面具有重要作用,是最主要的促纤维化调节因子[52]。TGF-β1可通过促进心肌成纤维细胞增殖并转化为肌成纤维细胞,使成纤维细胞合成细胞外基质(主要为胶原蛋白)的合成能力增强,最终造成心肌纤维化的发生[38]。研究发现,miR-21介导了TGF-β1诱导的炎症和损伤后纤维化的发生过程[18]。Yao等发现,miR-21促进心肌组织中成纤维细胞向肌成纤维细胞转化,参与调节了TGF-β1诱导的心肌纤维化的发生过程[53]。目前,关于运动强度和运动时间对心房TGF-β1/miR-21信号途径的影响尚无文献报道。本研究拟通过观察不同运动强度和时间对心房TGF-β1和miR-21的影响,探讨其在运动性心房纤维化中的作用,为研究运动性心房纤颤的发生机制提供实验依据,也为筛选安全有效的预防和治疗运动性心房纤颤的有效治疗靶点和干预措施提供科学依据。
1 材料与方法
1.1 实验对象
8周龄SPF级健康雄性SD大鼠72只,体重为(220±8 g),购自北京维通利华实验动物技术有限公司,许可证号为SCXX(京)2012-0001。所有大鼠均以啮齿类动物普通饲料喂养,在国家体育总局体育科学研究所ABSL-3级动物房饲养,室温为22±2℃,空气湿度为45%~55%,每天光照12 h。
1.2 分组和运动方案

1.3 取材
大鼠运动8周、12周和16周后24 h内进行取材。迅速取出心脏,切取右心房,每块组织分为2份,其中1份用于羟脯氨酸含量的检测,另1份放入-80℃冰箱用于做RT-PCR和Western blot。
1.4 Elisa检测血清cTnI的含量
采用双抗体夹心法,大鼠cTnI单抗包被在96孔酶标板内,依次加入HRP(辣根过氧化物酶)标记的二抗、标准品、样品,经温育形成抗原-抗体反应体系与过氧化物酶复合物并经过洗涤后,加入底物TMB显色,颜色呈蓝色,最后加入终止液后,液体颜色呈现黄色。样品中cTnI的浓度与颜色的深浅呈正相关。在Multiskan MK3酶标仪(Thermo Fisher Scientific公司)450色nm处测定OD值,通过绘制标准曲线求出血清中cTnI的浓度。Elisa试剂盒购于Life Diagnostics公司。
1.5 羟脯氨酸含量的检测(样本碱水解法)
羟脯氨酸(hydroxyproline,Hyp)在氧化剂的作用下所产生的氧化产物与二甲氨基苯甲醛作用呈紫色,根据其呈色的深浅可推算其含量。称量组织放入试管中,加入水解液,混匀,加盖后95℃或者沸水浴水解20 min。调pH值至6.0~6.8,加入双蒸水,混匀,加入适量活性炭,混匀。按表1添加完3种试剂后,60℃水浴15 min,冷却后3 500 r/min离心10 min,取上清在波长550 nm处测定各管吸光度值。试剂盒购于南京建成生物工程研究所(货号A030-2)。
表1 本研究Hyp含量测定操作一览表
Table 1 Schedule Table of Determination of Hyp Content

空白管标准管测定管双蒸水1ml标准液1ml检测液1ml试剂1试剂20.5ml0.5ml(混匀,静置10min)0.5ml试剂30.5ml0.5ml(混匀,静置10min)0.5ml
计算公式:
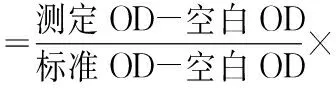
1.6 RT-PCR检测TGF-β1 mRNA的表达
采用Trizol法(购于美国Technologies)提取总RNA,每个样本按照2 μg RNA作为初始模板,配置20 μl的总反应体系,应用cDNA合成试剂盒(RR370A,购于TaKaRa公司)在核酸扩增仪(Gene Amp PCR System 9700,美国ABI公司)进行反转录成cDNA,反应条件为:37℃,15min;85℃ 5s;4℃保持。以合成的cDNA作为模板,以β-actin作为内参,配置20 μl反应体系,每个样本检测3个复孔,在实时荧光定量PCR系统(7300,美国ABI)进行扩增荧光定量,反应条件为:预变性95℃,30 s;PCR反应95℃,5 s;60℃,31 s;40个循环。荧光定量试剂盒为TaKaRa公司的RR820A。根据收集的数据通过2-△△CT公式计算样本中mRNA的相对含量,其中△△CT=(CT实验组目的基因-CT实验组内参基因)-(CT对照组目的基因-CT对照组内参基因)。实验所需引物由上海生工生物合成。
1.7 RT-PCR检测miR-21的表达
采用Trizol法(购于美国Technologies)提取总RNA,每个样本按照2 μg RNA作为初始模板,配置20 μl的总反应体系,采用在miRNA3′末端加多聚A尾Poly(A),再使用Oligo(dT)-univerl tag通用逆转录引物进行逆转录反应,最终反转录生成cDNA。以合成的cDNA为模板,以U6作为内参基因,配置20 μl反应体系,每个样本设置3个复孔,在实时荧光定量PCR系统进行扩增荧光定量,反应条件为:94℃,2 min,起始模板变性;94℃,20 s,PCR循环中模板变性,60℃,34 s,退火、延伸,40个循环。反转录、荧光定量试剂盒和miRNA引物均购于天根生化科技(北京)有限公司。根据收集的数据通过2-△△CT公式计算样本中miRNA的相对含量。
表2 本研究RT-PCR检测TGF-β1引物序列一览表
Table 2 Primer Sequence of TGF-β1 Detection by RT-PCR

引物序列长度β-actin上游引物5'-CATTGCTGACAGGATGCAGAAG-3'105bp下游引物5'-GAGCCACCAATCCACACAGAGT-3'TGF-β1上游引物5'-ATTCCTGGCGTTACCTTGG-3'120bp下游引物5'-AGCCCTGTATTCCGTCTCCT-3'
表3 本研究Real-time PCR检测miR-21引物序列一览表
Table 3 Primer Sequence of miR-21 Detection by RT-PCR

引物序列长度U6上游引物5'-CATTGCTGACAGGATGCAGAAG-3'105bpmiR-21上游引物5'-ATTCCTGGCGTTACCTTGG-3'120bp
1.8 Western Blot法检测心房TGF-β1的蛋白表达
提取总蛋白后用BCA法测定并调整蛋白浓度一致后,加入上样缓冲液沸水中10 min使蛋白变性。120 V恒压SDS-PAGE电泳1 h后,200 mA恒流转膜1 h。5%脱脂奶粉(购于美国BD公司)封闭1 h,一抗(Anti-TGF-β1,内参为β-actin,购于美国Abcam公司)置于摇床4℃过夜。TBST洗涤3次后,加HRP标记的二抗(1∶5 000,购于北京欣博盛公司),室温摇床孵育1 h。TBST洗膜3次,滴加ECL化学发光试剂(购于美国Millipore),室温静置2 min,滤纸吸干后置于保鲜膜内封存,置于暗匣内,X光片曝光约1 min,显影液中显影2 min,定影数十秒,条带用Quntity One软件进行图像分析。计算目的蛋白与内参蛋白条带的积分光密度(IOD)的相对值。
1.9 统计学分析

2 实验结果
2.1 大鼠血清cTnI的含量变化
结果如表4所示,与安静组相比,中等强度组8周、12周和16周大鼠cTnI的含量均无显著变化。而大强度组8周、12周和16周cTnI的含量均显著高于安静组和中等强度组(P<0.01)。不同时间各运动组之间无明显差异。
表4 本研究大鼠血清cTnI含量的变化一览表
Table 4 Change of Serum cTnI of Rats(ng/ml)

安静组中等强度组大强度组8周0.66±0.110.71±0.181.14±0.25*#12周0.68±0.150.65±0.121.42±0.26*#16周0.61±0.070.70±0.171.32±0.33*#
注:*表示P<0.05,与安静组相比;#表示P<0.05,与中强度组相比。
2.2 大鼠心房羟脯氨酸的含量变化
羟脯氨酸含量测量结果如图1所示,8周运动后,各组之间羟脯氨酸含量无明显改变。12周和16周大强度组羟脯氨酸含量显著高于各自的安静组和中等强度组(P<0.01),中等强度组和安静组之间没有显著性差异。大强度组大强度组之间通过比较发现,8周、12周和16周大强度组羟脯氨酸含量逐渐增加,16周羟脯氨酸含量显著高于8周大强度组(P<0.05)。

图1 本研究心房羟脯氨酸的含量示意图
注:**P<0.01,与各自安静组相比;##P<0.05,与各自中强度组相比;&P<0.05,与8周大强度组相比。
2.3 大鼠心房TGF-β1 mRNA的表达变化
荧光定量PCR结果如图2所示,经过8周、12周和16周运动后,大强度组TGF-β1 mRNA含量均高于各自安静组和中等强度组,和各自安静组相比,均具有显著性差异(P<0.05),中等强度组TGF-β1 mRNA的含量也高于各自安静组,但无统计学差异。
通过计算比较8周、12周和16周大强度组之间TGF-β1 mRNA的相对含量变化发现,12周和16周TGF-β1 mRNA的含量均显著低于8周大强度组(P<0.05),12周和16周之间无明显差异(图3)。
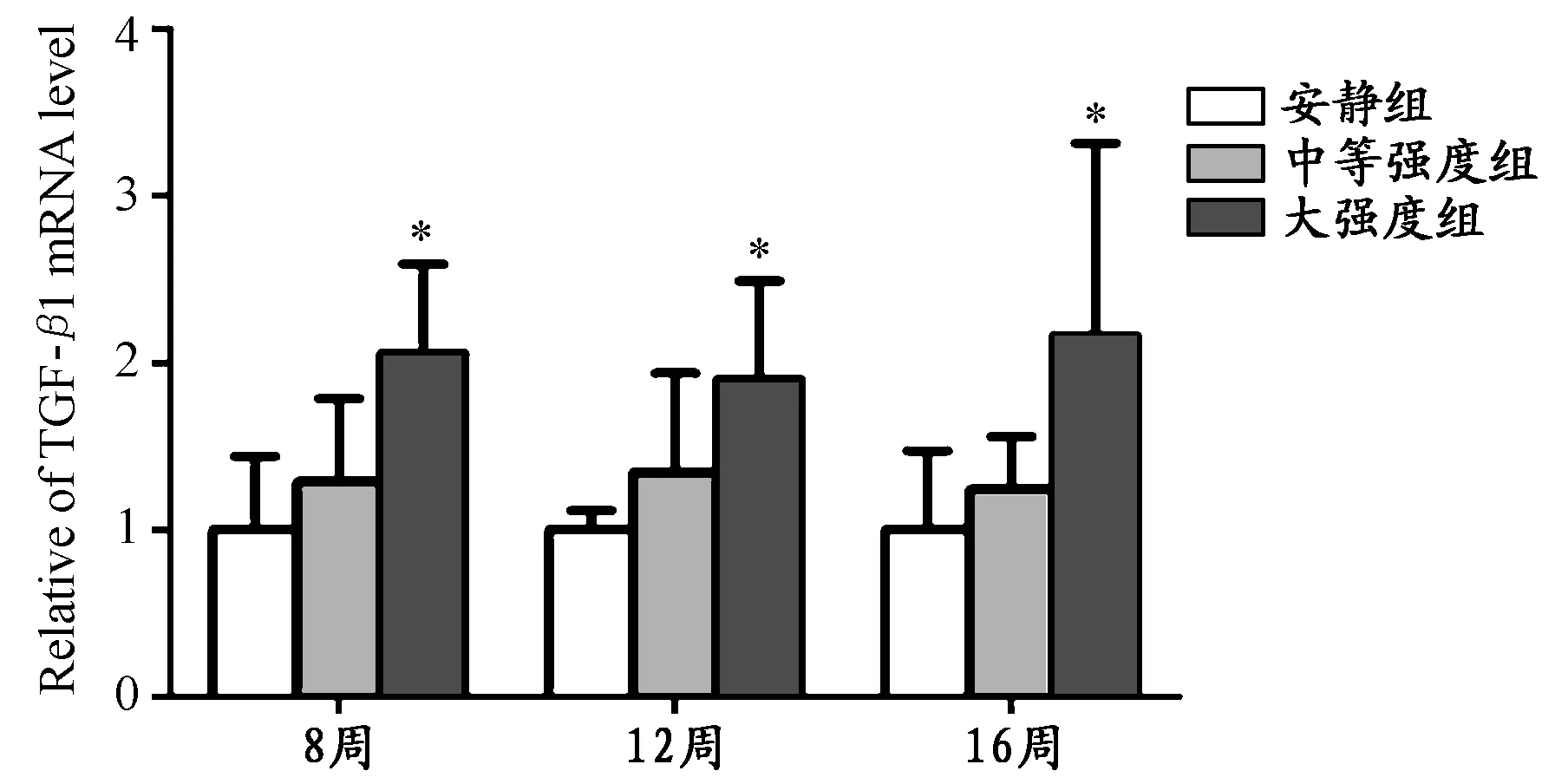
图2 本研究心房TGF-β1 mRNA的相对含量示意图
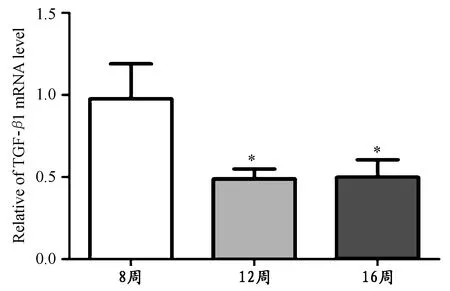
图3 本研究大强度组心房 TGF-β1 mRNA的相对含量示意图
2.4 大鼠心房TGF-β1 蛋白的表达变化
Western Blot结果如图4所示,8周运动后大强度组TGF-β1含量显著高于安静组和中等强度组(P<0.01)。中等强度组TGF-β1的表达低于安静组,但无显著性差异;12周大强度组TGF-β1的含量显著高于安静组和中等强度组(P<0.05),中等强度组TGF-β1的含量高于安静组,无显著性差异;16周大强度组TGF-β1的含量显著高于安静组和中等强度组(P<0.05),中等强度组TGF-β1的含量略低于安静组,但无显著性差异。进一步比较各训练周长之间大强度组TGF-β1 蛋白的含量发现,TGF-β1蛋白含量逐渐降低,12周和16周大强度组TGF-β1蛋白含量均显著低于8周大强度组,12周和16周之间无明显差异。
2.5 大鼠心房miR-21的表达变化
如图5所示,荧光定量PCR检测结果显示,8周运动后,和安静组相比,大强度组miR-21的表达增加3.29倍(P<0.05),中等强度组增加0.45倍,但无显著性差异;12周运动后,和安静组相比,大强度组miR-21的表达增加2.58倍(P<0.05),中等强度组增加0.16倍,但无显著性差异;16周运动后,和安静组相比,大强度组增加3.67倍(P<0.05),中等强度组miR-21的表达增加1.2倍,但无显著性差异。

图4 本研究心房TGF-β1蛋白的含量变化示意图
注:*P<0.05,**P<0.01,与各自安静组相比;#P<0.05,##P<0.01,与各自中等强度组相比;&P<0.05,&&P<0.01,与8周大强度组相比。
如图6所示,进一步比较8周、12周和16周大强度组之间miR-21的相对含量变化发现,miR-21的含量有逐渐降低的趋势,16周大强度组miR-21的表达显著低于8周大强度组(P<0.05)。

图5 本研究心房miR-21的相对含量变化示意图
注:*P<0.01,与各自安静组相比;#P<0.05,与各自中等强度组相比。

图6 本研究大强度组心房miR-21的相对含量示意图
3 分析与讨论
3.1 运动性心肌损伤、心房纤维化与房颤的研究
适当强度的运动可以降低心血管疾病的发病率,延长寿命,已经得到广泛认可[41]。但不可忽视的是,长期从事高强度运动的耐力运动员心律失常的发生率显著高于正常人群,由于其影响到运动员的身体健康、系统训练以及比赛成绩,并且耐力项目运动员和从事过大强度与大运动量训练的运动员可出现严重的心律失常,甚至发生运动性猝死[1]。其中,运动员房颤和心房扑动的发生率较为显著[13,34]。Abdulla等曾调查研究了655名耐力运动员(平均年龄为51±9岁)后发现,运动员房颤的发生率是普通人群的5.29倍[8]。Wernhart等的一项调查研究发现,耐力运动员孤立性心房纤颤的发生率在0.3%~12.8%之间,远高于正常人群[49]。Molina等调查了252名男性马拉松运动员后发现,运动员孤立性房颤的发生率显著高于安静对照人群(0.43% vs 0.11%)[33]。有研究报道,耐力运动员房颤的发生率是安静对照人群的2~10倍,并且运动性心房纤颤的发生与从事大强度运动的累积时间密切相关[34,35]。Mystad等通过对3 545名越野滑雪运动员的调查发现,12.5%的调查对象存在房颤,且其发生率和累积运动时间成正相关[36]。另有研究报道,具有长期从事滑雪经历的老龄运动人群(65~90岁)房颤的发生率显著高于普通人群。Elosua等的研究发现,一生中总的运动时间累积超过1 500 h,房颤的易感性显著增加[17]。
近年研究表明,长期大强度运动造成心房肌炎症的持续存在和累积损伤,可诱发心肌纤维化,可能是运动性心房纤颤的重要病理机制。心房纤维化是指心房中的胶原纤维过度增加的现象。胶原纤维对维持心房肌细胞正常的生理功能具有重要作用,然而,过度增加的胶原纤维将影响心肌细胞的电信号传导,促使房颤的发生与维持。Guasch等研究发现,16周每天进行1 h大强度运动的大鼠心房纤维化程度增加60%,房颤的易感性显著高于安静对照组(64% vs 15%)[21]。Benito等进一步研究发现,16周的大强度运动诱导心房纤维化相关因子显著增加[12]。
羟脯氨酸为胶原纤维所特有,测定心房羟脯氨酸含量,通过换算可得出胶原蛋白的含量,反映心肌纤维化的程度。本研究发现,和安静组比较,8周大强度组大鼠心房羟脯氨酸含量略有增加,而中等强度组羟脯氨酸含量降低,但均无显著性差异。12周和16周运动后,大强度组羟脯氨酸含量均显著高于安静组和中等强度组。而中等强度组羟脯氨酸含量也高于安静组,但两者之间无明显差异。通过天狼星红染色研究发现,12周和16周大强度运动后,大鼠心房胶原容积分数(CVF)和Ⅰ型胶原蛋白显著增加,心房发生纤维化[5]。
另外,本研究发现8周、12周和16周大强度运动后大鼠血清cTnI的含量均显著高于安静组和中等强度组,而中等强度组和安静对照组之间cTnI的含量未有显著差异。cTnI是心肌特异性和灵敏度较强的一种肌钙蛋白,已成为检测心肌损伤的“金标准”。本研究说明,不同周期的大强度运动造成大鼠心肌损伤持续存在。而心房肌细胞内肌纤维相对较少,肌浆网和横管系统不发达且线粒体较少,长期大强度运动时,心房接受回流血量大,产生较大前负荷,对氧和能量需求较高,更易发生缺氧和损伤,细胞通透性增高,cTnI漏出入血。有学者研究也发现,反复力竭运动和大强度运动后大鼠血清cTnI的含量显著增高,且与运动性心肌微损伤程度相关[4,29]。George等通过人体研究也发现,运动强度与cTnI的含量呈正相关[20]。因此,cTnI可以作为检测和监控过度运动时心肌受损程度的有效指标。
本研究中发现,羟脯氨酸含量的显著增加,可能是由于长期大强度运动后心肌损伤修复的长期累积所致。与本研究一致,Benito等发现,16周的大强度耐力运动诱导了大鼠右心室羟脯氨酸的显著升高[12]。有文章也表明,6周的大强度游泳和跑台运动造成了小鼠心房纤维化,是房颤易感性增加的重要原因[9]。
3.2 长期大强度运动上调TGF-β1/miR-21信号通路
研究表明,TGF-β1在调控炎症反应和损伤后修复过程中具有重要作用,也是目前发现的最重要的促纤维化因子之一,其可通过促进细胞增殖、分化以及胶原蛋白的合成促进损伤后修复与纤维化的形成[54]。本研究发现,8周、12周和16周大强度运动后,大鼠心房TGF-β1基因和蛋白的表达均显著增加,而中等强度运动后心房TGF-β1的变化不明显。这可能是由于大强度运动对心房产生较大的机械负荷,造成心房组织中的成纤维细胞合成分泌较多的TGF-β1,诱导细胞外基质(主要为胶原蛋白)的合成与分泌增多。适度增多的胶原蛋白对防止心肌被过度拉伸具有保护作用,而长期反复的大强度运动造成TGF-β1的持续高表达导致细胞外基质的大量增加,心脏可能由生理性重塑向病理性重塑发展。过度增加的胶原蛋白诱发心肌纤维化,影响心脏的收缩和舒张功能以及心肌的顺应性和僵硬度[42]。在组织损伤早期,TGF-β1的高表达在对组织损伤后的修复具有重要作用。然而,长期持续TGF-β1的异常表达反而会造成组织的过度修复,损伤部位可能发生纤维化。与本研究结果一致,徐明明等研究发现,急性跑台运动后,大鼠骨骼肌在顿挫伤后修复过程中TGF-β1的表达显著增加[7]。高晓嶙等研究也发现,TGF-β1在肌腱过度使用中长期高表达,可能是肌腱发生退行性病变的重要病理机制[6]。Heinemeier等研究也发现,急性大强度运动后骨骼肌中TGF-β1 mRNA的表达也显著升高[24]。人体实验研究也发现,耐力运动后血液里多种炎症相关因子表达增加,TGF-β1的含量也显著增加,但其是否来自于心肌细胞的释放入血,仍需进一步研究[14,37]。
研究证实,剧烈或较大强度运动造成活性氧(ROS)的大量增加可上调TGF-β1的表达[38]。另外,大强度运动后血管紧张素的分泌增加也会造成TGF-β1的表达增加[16]。TGF-β1可通过p38MAPK途径或者激活下游SMAD信号通路,激活生成胶原纤维的途径,使成纤维化细胞增殖,细胞外基质的合成增加,诱发心房纤维化[28,51]。有研究也发现,16周的大强度运动后,大鼠心房结缔组织生长因子(CTGF)的表达显著增加[5]。而CTGF是TGF-β1重要的下游作用因子,可促进成纤维细胞的增殖和胶原蛋白的合成,在心房纤维化和心房纤颤的发生过程中也具有重要作用[30]。
研究发现,miR-21介导了TGF-β1的促炎和促纤维化过程。miR-21主要通过调控心脏成纤维细胞的增殖而参与心肌纤维化的过程[27]。研究显示,在组织器官纤维化病变过程中miR-21表达显著增加。Thum等通过原位杂交证实,心肌的miR-21选择性的在成纤维细胞中表达。进一步研究显示,miR-21表达的上调,能抑制Spry1的水平,从而增强ERK-MAP信号通路的活性,导致成纤维细胞的增殖,促进了心肌细胞纤维化的发生。在压力负荷增加的动物模型中,用反义寡核苷酸antagomiRs抑制miR-21,心肌ERK-MAP激酶的活性降低。另外,Roy等在缺血再灌注动物模型中研究发现,miR-21在心肌成纤维细胞中表达升高,磷酸酶张力蛋白(PTEN)表达水平下调,进而激活磷脂酰基醇-3-激酶(PI3K-Akt)信号通路[40]。PI3K-Akt通路的活化能上调基质金属蛋白酶2(matrix metalloproteinase,MMP-2)的活性,从而参与心肌纤维化的调节[43]。Ma等研究报道,8周的游泳训练显著上调大鼠左心室miR-21的表达,通过降解PTEN介导了运动性心肌肥大的发生[31]。但目前不同强度运动训练对心房miR-21的影响的研究报道较少。本研究发现,8周、12周和16周大强度运动后,心房miR-21的表达均显著增加,中等强度运动后,心房miR-21的表达也具有增加趋势,但无显著性差异。这表明,长期大强度运动导致的心房纤维化的形成可能与心肌中miR-21的长期高表达密切相关。
研究报道显示,TGF-β1可通过调节miR-21的表达诱导炎症反应和纤维化的形成。Madhyastha等通过体外研究发现,在高糖条件下,TGF-β1促进了皮肤成纤维细胞miR-21的表达[32]。He等发现在血吸虫诱导的肝脏纤维化发生过程中,存在TGF-β1和miR-21的高表达,体内腺病毒转染miR-21抑制剂可有效抑制肝纤维化的发展。进一步研究则发现,TGF-β1通过激活SMAD蛋白上调肝卫星细胞中miR-21的表达,而阻断TGF-β1/Smad信号通路可显著下调肝卫星细胞miR-21的表达[23]。Jiang等发现,辐射通过激活TGF-β1/miR-21信号通路,导致ROS增加,进而导致肺组织细胞DNA损伤[26]。Villar等发现,在压力负荷过载小鼠模型中存在TGF-β1和miR-21同时高表达的现象[45]。同时,人体研究也发现,主动脉狭窄病人血浆中TGF-β1和miR-21的表达均显著高于正常对照人群,miR-21与心组织切片中胶原的含量呈正相关。在心肌间质细胞而非心肌细胞存在miR-21的高表达[46]。García等进一步研究发现,在培养的心肌成纤维细胞中,TGF-β1的过表达通过激活SMAD2/3信号通路和DICER1共同作用促进前体miR-21加工为成熟的miR-21[18]。
有研究发现,急性力竭运动和长期耐力运动能显著增加人体血液循环中TGF-β1[22,47]和miR-21[10,15,48]的含量,但其是否来源于心肌组织的释放入血尚不明确。因此,深入研究运动与TGF-β1/miR-21的关系,对我们深入了解运动性心律失常的发生机制具有重要意义。本动物实验研究对人类运动性心律失常的治疗靶点和干预措施选择提供了实验依据和借鉴思路,但对于干预措施的应用仍有一段距离,还需要进一步的研究与临床观察。使用何种干预措施可以缓解过度运动造成的心房损伤和纤维化,将是本课题组进一步研究的方向。
综上所述,本研究中发现,长期大强度运动后心房发生纤维化的现象可能与心肌发生反复损伤修复且长期累积有关,而长期中等强度运动未有纤维化的发生。研究中发现,心房组织中TGF-β1和miR-21的长期持续高表达可能参与调控了心房损伤后纤维化的发生,可能是运动性心房纤颤发生的重要机制之一。
4 结论
1.长期大强度耐力运动导致大鼠心肌损伤长期存在,并伴随大鼠心房胶原蛋白的持续增加,诱发了心房纤维化,构成了运动性心房纤颤的病理基础。
2.长期大强度耐力运动通过上调大鼠心房TGF-β1/miR-21信号通路,介导了运动性心房纤维化的发生过程。
[1]常芸.运动员心脏的热点问题与研究进展[J].体育科学,2010,30(10):70-79.
[2]常芸.运动员心脏的医务监督[M].北京:北京体育大学出版社,2011:202-218.
[3]常芸.运动性心律失常研究现状与展望[J].中国运动医学杂志,2015,34(1):59-68.
[4]高晓嶙,常芸,廉贺群.力竭运动后不同时相大鼠心肌cTnI、Mb mRNA与血清cTnI、Mb表达[J].中国运动医学杂志,2009,28(2):162-166.
[5]王世强,常芸,马晓雯,等.不同强度耐力运动对大鼠心肌胶原蛋白的影响及MMP-1/TIMP-1的调节作用[J].中国体育科技,2015,51(5):60-66.
[6]高晓嶙,白云飞,王若晗,等.肱二头肌长头肌腱过度使用中相关生长因子蛋白表达规律的研究[J].体育科学,2014,34(9):44-48.
[7]徐明明,于晓华,吴耀义,等.跑台运动对大鼠骨骼肌急性钝挫伤后TGF-β1和bFGF表达的影响[J].中国运动医学杂志,2013,32(4):327-332.
[8]ABDULLA J,NIELSEN J R.Is the risk of atrial fibrillation higher in athletes than in the general population? A systematic review and meta-analysis[J].Europace,2009,11(9):1156-1159.
[9]ASCHAR-SOBBI R,IZADDOUSTDAR F,KOROGYI A S,etal.Increased atrial arrhythmia susceptibility induced by intense endurance exercise in mice requires TNFalpha[J].Nat Commun,2015,(6):6018.
[10]BAGGISH A L,HALE A,WEINER R B,etal.Dynamic regulation of circulating microRNA during acute exhaustive exercise and sustained aerobic exercise training[J].J Physiol,2011,589(Pt 16):3983-3994.
[11]BEDFORD T G,TIPTON C M,WILSON N C,etal.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol Respir Environ Exerc Physiol,1979,47(6):1278-1283.
[12]BENITO B,GAY-JORDI G,SERRANO-MOLLAR A,etal.Cardiac arrhythmogenic remodeling in a rat model of long-term intensive exercise training[J].Circulation,2011,123(1):13-22.
[13]CALVO N,BRUGADA J,SITGES M,etal.Atrial fibrillation and atrial flutter in athletes[J].Br J Sports Med,2012,46(S1):i37-43.
[14]CZARKOWSKA-PACZEK B,BARTLOMIEJCZYK I,PRZYBYLSKI J.The serum levels of growth factors:PDGF,TGF-beta and VEGF are increased after strenuous physical exercise[J].J Physiol Pharmacol,2006,57(2):189-197.
[15]DENHAM J,O'BRIEN B J,MARQUES F Z,etal.Changes in the leukocyte methylome and its effect on cardiovascular-related genes after exercise[J].J Appl Physiol (1985),2015,118(4):475-488.
[16]DOETSCHMAN T,BARNETT J V,RUNYAN R B,etal.Transforming growth factor beta signaling in adult cardiovascular diseases and repair[J].Cell Tissue Res,2012,347(1):203-223.
[17]ELOSUA R,ARQUER A,MONT L,etal.Sport practice and the risk of lone atrial fibrillation:A case-control study[J].Int J Cardiol,2006,108(3):332-337.
[18]GARCIA R,NISTAL J F,MERINO D,etal.p-SMAD2/3 and DICER promote pre-miR-21 processing during pressure overload-associated myocardial remodeling[J].Biochim Biophys Acta,2015,1852(7):1520-1530.
[19]GAY-JORDI G,GUASH E,BENITO B,etal.Losartan prevents heart fibrosis induced by long-term intensive exercise in an animal model[J].PLoS One,2013,8(2):e55427.
[20]GEORGE K P,GRANT M C,DAVIES B,etal.The impact of short duration,high intensity exercise on cardiac troponin release[J].Clin Physiol Funct Imaging,2014.
[21]GUASCH E,BENITO B,QI X,etal.Atrial fibrillation promotion by endurance exercise:Demonstration and mechanistic exploration in an animal model[J].J Am Coll Cardiol,2013,62(1):68-77.
[22]HAMADA K,VANNIER E,SACHECK J M,etal.Senescence of human skeletal muscle impairs the local inflammatory cytokine response to acute eccentric exercise[J].FASEB J,2005,19(2):264-266.
[23]HE X,XIE J,ZHANG D,etal.Recombinant adeno-associated virus-mediated inhibition of microRNA-21 protects mice against the lethal schistosome infection by repressing both IL-13 and transforming growth factor beta 1 pathways[J].Hepatology,2015,61(6):2008-2017.
[24]HEINEMEIER K M,BJERRUM S S,SCHJERLING P,etal.Expression of extracellular matrix components and related growth factors in human tendon and muscle after acute exercise[J].Scand J Med Sci Sports,2013,23(3):e150-161.
[25]JALIFE J,KAUR K.Atrial remodeling,fibrosis,and atrial fibrillation[J].Trends Cardiovasc Med,2014,25(6):475-484.
[26]JIANG Y,CHEN X,TIAN W,etal.The role of TGF-beta1-miR-21-ROS pathway in bystander responses induced by irradiated non-small-cell lung cancer cells[J].Br J Cancer,2014,111(4):772-780.
[27]KUMARSWAMY R,VOLKMANN I,THUM T.Regulation and function of miRNA-21 in health and disease[J].RNA Biol,2011,8(5):706-713.
[28]LAN C C,FANG A H,WU P H,etal.Tacrolimus abrogates TGF-beta1-induced type I collagen production in normal human fibroblasts through suppressing p38MAPK signalling pathway:Implications on treatment of chronic atopic dermatitis lesions[J].J Eur Acad Dermatol Venereol,2014,28(2):204-215.
[29]LIAO J,LI Y,ZENG F,etal.Regulation of mTOR Pathway in Exercise-induced cardiac hypertrophy[J].Int J Sports Med,2015,36(5):343-350.
[30]LIN X,WU N,SHI Y,etal.Association between transforming growth factor beta1 and atrial fibrillation in essential hypertensive patients[J].Clin Exp Hypertens,2015,37(1):82-87.
[31]MA Z,QI J,MENG S,etal.Swimming exercise training-induced left ventricular hypertrophy involves microRNAs and synergistic regulation of the PI3K/AKT/mTOR signaling pathway[J].Eur J Appl Physiol,2013,113(10):2473-2486.
[32]MADHYASTHA R,MADHYASTHA H,PENGJAM Y,etal.NFkappaB activation is essential for miR-21 induction by TGFbeta1 in high glucose conditions[J].Biochem Biophys Res Commun,2014,451(4):615-621.
[33]MOLINA L,MONT L,MARRUGAT J,etal.Long-term endurance sport practice increases the incidence of lone atrial fibrillation in men:A follow-up study[J].Europace,2008,10(5):618-623.
[34]MONT L,ELOSUA R,BRUGADA J.Endurance sport practice as a risk factor for atrial fibrillation and atrial flutter[J].Europace,2009,11(1):11-17.
[35]MYRSTAD M,LOCHEN ML,GRAFF-IVERSEN S,etal.Increased risk of atrial fibrillation among elderly Norwegian men with a history of long-term endurance sport practice[J].Scand J Med Sci Sports,2014,24(4):e238-244.
[36]MYRSTAD M,NYSTAD W,GRAFF-IVERSEN S,etal.Effect of years of endurance exercise on risk of atrial fibrillation and atrial flutter[J].Am J Cardiol,2014,114(8):1229-1233.
[37]PERRY C,PICK M,BDOLACH N,etal.Endurance exercise diverts the balance between Th17 cells and regulatory T cells[J].PLoS One,2013,8(10):e74722.
[38]PURNOMO Y,PICCART Y,COENEN T,etal.Oxidative stress and transforming growth factor-beta1-induced cardiac fibrosis[J].Cardiovasc Hematol Disord Drug Targets,2013,13(2):165-172.
[39]REDPATH C J,BACKX P H.Atrial fibrillation and the athletic heart[J].Curr Opin Cardiol,2015,30(1):17-23.
[40]ROY S,KHANNA S,HUSSAIN S R,etal.MicroRNA expression in response to murine myocardial infarction:miR-21 regulates fibroblast metalloprotease-2 via phosphatase and tensin homologue[J].Cardiovasc Res,2009,82(1):21-29.
[41]SANCHIS-GOMAR F,SANTOS-LOZANO A,GARATACHEA N,etal.My patient wants to perform strenuous endurance exercise.What's the right advice[J].Int J Cardiol,2015,197:248-253.
[42]SUN Y,HUANG Z Y,WANG Z H,etal.TGF-beta1 and TIMP-4 regulate atrial fibrosis in atrial fibrillation secondary to rheumatic heart disease[J].Mol Cell Biochem,2015,406(1-2):131-138.
[43]THUM T,GROSS C,FIEDLER J,etal.MicroRNA-21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts[J].Nature,2008,456(7224):980-984.
[44]TURAGAM M K,VELAGAPUDI P,KOCHERIL A G.Atrial fibrillation in athletes[J].Am J Cardiol,2012,109(2):296-302.
[45]VILLAR A V,GARCIA R,LLANO M,etal.BAMBI (BMP and activin membrane-bound inhibitor) protects the murine heart from pressure-overload biomechanical stress by restraining TGF-beta signaling[J].Biochim Biophys Acta,2013,1832(2):323-335.
[46]VILLAR A V,GARCIA R,MERINO D,etal.Myocardial and circulating levels of microRNA-21 reflect left ventricular fibrosis in aortic stenosis patients[J].Int J Cardiol,2013,167(6):2875-2881.
[47]VOLAKLIS K A,SMILIOS I,SPASSIS A T,etal.Acute pro- and anti-inflammatory responses to resistance exercise in patients with coronary artery disease:A pilot study[J].J Sports Sci Med,2015,14(1):91-97.
[48]WARDLE S L,BAILEY M E,KILIKEVICIUS A,etal.Plasma microRNA levels differ between endurance and strength athletes[J].PLoS One,2015,10(4):e0122107.
[49]WERNHART S,HALLE M.Atrial fibrillation and long-term sports practice:Epidemiology and mechanisms[J].Clin Res Cardiol,2015,104(5):369-379.
[50]WILHELM M,ROTEN L,TANNER H,etal.Atrial remodeling,autonomic tone,and lifetime training hours in nonelite athletes[J].Am J Cardiol,2011,108(4):580-585.
[51]YANG L,HU J,HAO H Z,etal.Sodium tanshinone IIA sulfonate attenuates the transforming growth factor-beta1-induced differentiation of atrial fibroblasts into myofibroblasts in vitro[J].Int J Mol Med,2015,35(4):1026-1032.
[52]YANG Y,ZHANG N,LAN F,etal.Transforming growth factor-beta 1 pathways in inflammatory airway diseases[J].Allergy,2014,69(6):699-707.
[53]YAO Q,CAO S,LI C,etal.Micro-RNA-21 regulates TGF-beta-induced myofibroblast differentiation by targeting PDCD4 in tumor-stroma interaction[J].Int J Cancer,2011,128(8):1783-1792.
[54]ZEGLINSKI M R,HNATOWICH M,JASSAL D S,etal.SnoN as a novel negative regulator of TGF-beta/Smad signaling:A target for tailoring organ fibrosis[J].Am J Physiol Heart Circ Physiol,2015,308(2):H75-82.
Effects of Endurance Exercise of Different Intensity on TGF-β1/miR-21 Signaling Pathpay
WANG Shi-qiang1,2,CHANG Yun1,MA Xiao-wen1,RAO Zhi-jian1,2
Objective:To explore effects of different sustained intensive exercise on rat atrial hydroxyproline,and role of TGF-β1/miR-21 signaling pathway through establishing long-term exercise animal model,and provide experimental evidence for clarifiying the mechanism of exercise-induced atrial fibrillation.Methods:72 SD rats were divided into control group (C),moderate intensity group (M) and high instensity group (H) with 24 animals in each group.M and H group were conditioned to run for 4,8,and 16 weeks,5 days/weeks,1h/day.Rats were euthanized to obtain hearts within 24h after exercise.Right atrial were collected.cTnI was quantified by Elisa,hydroxyproline was measured by lkali hydrolysis methodwhich.TGF-β1 and miR-21 gene expression were evaluted by real-time PCR.TGF-β1 protein was quantified by Western Blot.Results:Compared with control and M group,rats serum cTnI increased at 8 weeks/12 weeks/16 weeks (P<0.01).While there was no significance between M group and C gourp.There was no significant difference in hydroxyproline at 8 weeks.Compared with C and M group,hydroxyproline content of H group showed significant increase at 12 weeks and 16 weeks (P<0.01).No difference was oberserved between C group and M group.Hydroxyproline content of H group confirmed a gradual increase with training time,with significant increase from 8 weeks to 16weeks (P<0.05).TGF-β1 gene and protein expression of H group increased compared their control group at 8/12/16 weeks.But no difference was observed between C and M group.TGF-β1 expression had a gradual decrease from 8 to 16 weeks.Compared with their control group,miR-21 expressio of H group showed a significant increase (P<0.05).miR-21 of H group confirmed a gradual decrease with training time,with significant decrease from 8 weeks to 16weeks (P<0.05).No significant difference was observed beteen C and M group.Conclusion:Long-term intensive exercise induced sustained myocardial damage,resulted in sustained collagen increase which induced myocardial fibrosis.This may be a substrate for exercise-induced atrial fibrillation.TGF-β1/miR-21 signaling pathway,upregulated by long-term intensive exercise,may involve in the pathology of intense exercise-induced myocardial damage and atrial fibrillation.
exercise;rat;artrialfibrosis;hydroxyproline;TGF-β1;microRNA-21
2015-07-25;
2015-10-25
国家体育总局体育科学研究所基本科研业务经费(15-16)。
王世强(1987-),男,山东济宁人,在读博士研究生,主要研究方向为运动心脏生理和病理,E-mail:suswsq@163.com;常芸(1957-),女,内蒙古人,研究员,医学博士,博士研究生导师,主要研究方向为运动员心脏病生理与医务监督,Tel:(010)87182526,E-mai:changyun@ciss.cn;马晓雯(1989-),女,北京人,在读硕士研究生,主要研究方向为运动心脏生理和病理;饶志坚(1989-),男,江西上饶人,在读博士研究生,主要研究方向为运动心脏生理和病理。
1.国家体育总局体育科学研究所,北京,100061;2.上海体育学院 运动科学学院,上海 200438 1.China Institute of Sports Science,Beijing 100061,China;2.Shanghai University of Sport,Shanghai 200438,China.
1000-677X(2015)11-0030-08
10.16469/j.css.201511005
G804.5
A

