脂多糖对B R L大鼠肝细胞的损伤研究
黄敏聪,潘伟,卢觅佳,张马娟,夏丽娟,宣尧仙
(浙江省医学科学院,浙江 杭州310013)
脂多糖对B R L大鼠肝细胞的损伤研究
黄敏聪,潘伟,卢觅佳,张马娟,夏丽娟,宣尧仙
(浙江省医学科学院,浙江 杭州310013)
目的研究脂多糖(LPS)对BRL大鼠肝细胞的损伤作用。方法体外培养BRL大鼠肝细胞,经不同浓度LPS处理细胞后,检测BRL大鼠肝细胞的增殖能力和凋亡率,以及谷草转氨酶(AST)、谷丙转氨酶(ALT)活性,肿瘤坏死因子(TNF-α)、白介素10(IL-10)细胞因子含量。结果脂多糖在一定程度上能抑制BRL大鼠肝细胞增殖,并且呈浓度依赖性,高浓度脂多糖(200mg/L)能够升高细胞培养上清液中AST、ALT活性,提高TNF-α含量及降低IL-10含量。结论高浓度脂多糖(200mg/L)能造成BRL大鼠肝细胞的损伤,损伤作用可能与打破促坏死因子与保肝因子之间的平衡有关。
脂多糖;BRL大鼠肝细胞;增殖;凋亡;细胞因子
脂多糖(LPS)是革兰阴性细菌细胞壁中的一种成分,又称内毒素,常被用来制备免疫型肝损伤模型[1],郭竹英等[2]报道LPS能够升高大鼠原代肝细胞细胞上清TNF-α等含量并抑制细胞生长。而周钧等[3]报道LPS在80mg/L浓度下对人正常肝细胞L02体外培养并无明显的TNF-α含量变化和毒性作用,故不宜选用人肝细胞L02细胞株来研究LPS对肝脏的损伤作用。原代大鼠肝细胞一般采用灌注法分离获得,分离成本和技术要求较高,细胞活性与稳定性差异较大,难以保证实验的重复性和可操作性。BRL大鼠肝细胞相对于大鼠原代肝细胞更容易获取和培养,并且活性和稳定性更佳,能保证实验数据的准确性。因此本研究选择BRL大鼠肝细胞作为实验对象,并设置不同浓度梯度的LPS,观察其对BRL大鼠肝细胞生长增殖的影响和对肝细胞损伤的作用。
1 材料与方法
1.1材料
1.1.1试剂与仪器 DMEM高糖培养基(吉诺生物技术有限公司,批号14032004);胎牛血清(BBI生命科学有限公司,批号WD0213B10014J);凋亡试剂盒 (生工生物工程股份有限公司,批号DY0404B14L);AST、ALT检测试剂(杭州德格医疗设备有限公司,批号00001133);CCK-8试剂盒(DOJINDO,批号FJ799);DMSO(BIOSHARP,批号D-5879);大鼠TNF-α、IL-10检测试剂盒(上海源叶生物科技有限公司,批号:20140801A)。二氧化碳培养箱 (美国热电)、全自动生化分析仪(HITACHI 7020)、IX51倒置荧光显微镜(日本OLYMPUS)、SIGMA2-6离心机(德国SIGMA)、FACS Calibur流式细胞仪 (美国BD)、BioTek Synergy HT酶标仪(美国伯腾仪器有限公司)。脂多糖(Sigma,批号043M4089V),用DMEM培养基将其溶解制成2g/L母液,现配现用。
1.1.2细胞株 BRL大鼠肝细胞购自中国科学院上海生命科学研究院细胞资源中心,用含10%胎牛血清的DMEM培养基,5%二氧化碳,37℃恒温培养箱培养。
1.2方法
1.2.1BRL大鼠肝细胞增殖试验 BRL大鼠肝细胞台盼蓝染色计数,以每孔5×104个细胞种于96孔板内,加入梯度浓度的脂多糖(2、10、20、50、100mg/L)处理细胞20小时后,加入CCK-8试剂,再培养4小时,酶标仪450nm测定吸光度(OD)值,计算细胞的存活率。存活率(%)=药物组平均吸光度/对照组平均吸光度×100%。
1.2.2BRL大鼠肝细胞损伤试验 BRL大鼠肝细胞台盼蓝染色计数,以每孔5×105个细胞种于12孔板内,设置正常对照组(溶剂培养液对照)和脂多糖高剂量组(200mg/L)和低剂量组(10mg/L)处理细胞24小时。完全吸取细胞培养液,1500r/min离心5分钟,吸取上清液用于ALT、AST、TNF-α、IL-10等指标的检测。用0.25%无EDTA胰酶消化BRL大鼠肝细胞,收集细胞置离心管,PBS洗涤后加入结合缓冲液,先加入Annexin V-FITC避光孵育15分钟后离心弃上清液,结合缓冲液重悬细胞再加入PI染色液,1小时内完成上机检测。
1.3统计学处理 数据用 ()表示,用SPSS 22.0软件进行t检验。
2 结果
2.1脂多糖对大鼠肝细胞增殖的影响 脂多糖2、10、20、50、100 mg/L组的BRL大鼠肝细胞增殖率分别为正常对照组的98%、97%、95%、90%、89%,提示脂多糖对BRL大鼠肝细胞生长增殖具有一定的抑制作用,且呈浓度依赖性。详见图1。

图1 不同浓度LPS对BRL大鼠肝细胞增殖的影响
2.2脂多糖对ALT、AST、IL-10和TNF-α含量的影响 对照组与脂多糖低浓度组比较,ALT、AST、IL-10和TNF-α四个指标差异均无统计学意义(均P>0.05),而脂多糖高浓度组较低浓度组差异均有统计学意义(P<0.05或P<0.01)。提示脂多糖10mg/L浓度对BRL大鼠肝细胞的损伤作用不明显,而20 0mg/L浓度时损伤较显著,并且对细胞的损伤作用可能与细胞因子水平具有一定的关系。详见表1。
表1 三组ALT、AST、IL-10和TNF-α含量的比较()

表1 三组ALT、AST、IL-10和TNF-α含量的比较()
与脂多糖低浓度组比较*P<0.05,**P<0.01
组别 n 浓度(m g / L) A L T(U / L) A S T(U / L) I L -1 0(n g / L) T N F -α(n g / L)对照组 6 - 0 . 7 1 ± 0 . 2 9 3 . 9 9 ± 1 . 1 1 5 6 . 5 5 ± 4 . 3 3 2 5 1 . 7 6 ± 1 1 . 2 5脂多糖低浓度组 6 1 0 1 . 1 3 ± 0 . 3 7 5 . 4 2 ± 1 . 5 6 5 4 . 4 9 ± 6 . 2 7 2 4 3 . 0 3 ± 3 1 . 1 8脂多糖高浓度组 6 2 0 0 1 . 7 8 ± 0 . 6 2*7 . 9 2 ± 2 . 1 5*4 3 . 3 1 ± 1 . 9 9**2 9 3 . 6 3 ± 1 5 . 0 8*
2.3脂多糖对大鼠肝细胞凋亡的影响 对照组与脂多糖低浓度组的细胞凋亡率比较差异无统计学意义(P>0.05);脂多糖高浓度组较低浓度组细胞的凋亡率明显升高(P<0.01),提示脂多糖200mg/L浓度能够诱导BRL细胞凋亡或坏死。详见表2。
表2 三组BRL大鼠肝细胞凋亡率比较(,%)
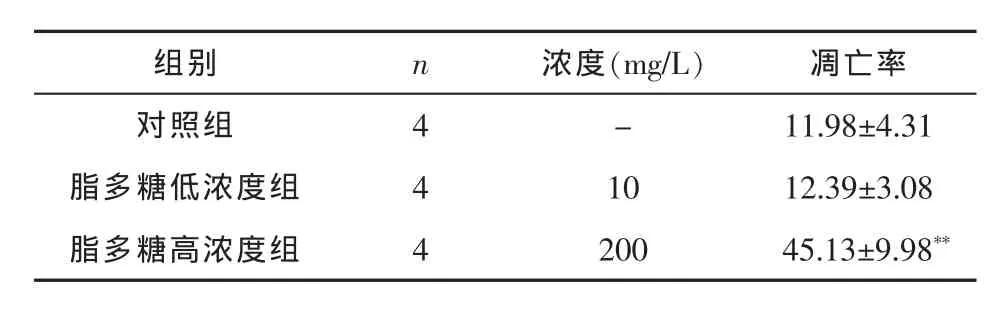
表2 三组BRL大鼠肝细胞凋亡率比较(,%)
与脂多糖低浓度组比较**P<0.01
组别 n 浓度(mg/L) 凋亡率对照组 4 - 11.98±4.31脂多糖低浓度组 4 10 12.39±3.08脂多糖高浓度组 4 200 45.13±9.98**
3 讨论
本文采用BRL大鼠肝细胞作为试验对象,观察脂多糖对BRL大鼠肝细胞的损伤作用。增殖实验结果显示,脂多糖能够一定程度上抑制BRL大鼠肝细胞增殖作用,且呈浓度依赖性,脂多糖2、10、20、50、100 mg/L浓度对BRL大鼠肝细胞增殖的抑制率分别为2%、3%、5%、10%、11%。损伤实验显示脂多糖10mg/L组细胞培养上清液中AST、ALT有上升趋势,但与对照组比较差异无统计学意义,说明脂多糖低浓度组对细胞凋亡坏死影响不明显,而脂多糖200mg/L能明显升高细胞培养上清液中AST、ALT活性,并明显升高细胞凋亡率,提示高浓度脂多糖能明显损伤BRL大鼠肝细胞,证实脂多糖有一定肝毒性。
TNF-α作为肝炎早期的改变指标而被广泛地研究,也是内毒素血症中造成肝细胞凋亡的终末介质,脂多糖能够刺激机体或细胞产生TNF-α。在脂多糖和药物共同给予的实验中,采用各种TNF-α抑制剂来减少或阻断TNF-α的产量或降低TNF-α的活性均能起到减少肝损伤的作用[4]。IL-10主要由活化的枯否氏细胞、T细胞、肝索内皮细胞及肝细胞分泌[5]。IL-10一方面可以通过降低促坏死因子(TNF-α、IL-1β、IL-8、IFN-γ等)的表达分泌[6-8],另一方面可以促进肝细胞的再生[9-10]。IL-10的抗炎症作用在许多肝损伤模型中 (如伴刀豆蛋白、四氯化碳、酒精致肝损伤等)多有所体现[11]。本组脂多糖高浓度组 TNF-α水平远高于低浓度组(P<0.01),而IL-10水平远低于脂多糖低浓度组(P<0.01),也提示肝损伤的发生与促坏死因子与保肝因子之间的平衡有一定的关系。肝脏促坏死因子如TNF-α可以通过增强炎症反应、干扰肝脏再生或直接损伤肝细胞而增加肝损伤的敏感性,肝保护因子如IL-10可以通过抑制炎症因子而起到一定的保护作用。本实验中,脂多糖高浓度组在明显地降低细胞上清中的IL-10含量的同时明显地升高了TNF-α的含量,从而导致了BRL大鼠肝细胞的损伤,提示脂多糖致肝损伤作用可能与打破促坏死因子与保肝因子之间的平衡有关,具体机制有待进一步深入研究。
[1] 蒋旭宏,黄小民.内毒素性急性肝损伤实验动物模型的建立和检测指标.中国中医急症,2009,18(8):1309
[2] 郭竹英,矫强,徐芒华,等.脂多糖对人正常肝细胞株L02损伤的实验研究.医学分子生物学杂志,2008,5(4):323
[3] 周钧,王琴,王群伟,等.去甲斑蝥素对LPS诱导的体外培养的肝细胞损伤的保护作用.中南大学学报 (医学版),2012,37(3):285
[4] Shaw PJ,Hopfensperger MJ,Ganey PE,et al.Lipopolysaccharide and trovafloxacincoexposure in mice causes idiosyncrasy-like liver injury dependent on tumor necrosis factoralpha.Toxicol Sci,2007,100(1):259
[5] Le Moine O,Louis H,Sermon F,et al.Interleukin-10 and liver diseases.Acta Gastroenterol Belg,1999,62(1):1
[6]Bogdan C,Vodovotz Y,Nathan C.Macrophage deactivation by interleukin 10.Exp Med,1991,174(6):1549
[7] Moore KW,de Waal Malefyt R,Coffman RL,et al.Interleukin-10 and the interleukin-10 receptor.Annu Rev Immunol,2001,19:683
[8] Stordeur P,Goldman M.Interleukin-10 as a regulatory cytokine induced by cellular stress:molecular aspects.Int Rev Immunol,1998,16(5-6):501
[9] Huang YH,Shi MN,Zheng WD,et al.Therapeutic effect of interleukin-10 on CCl4-induced hepatic fibrosis in rats. World J Gastroenterol,2006,12(9):1386
[10]Louis H,Van Laethem JL,Wu W.Interleukin-10 controls neutrophilic infiltration,hepatocyte proliferation,and liver fibrosis induced by carbon tetrachloride in mice.Hepatology,1998,28(6):1607
[11]Louis H,Le Moine O,Goldman M,et al.Modulation of liver injury by interleukin-10.Acta Gastroenterol Belg,2003,66(1):7
浙江省医学科学院青年基金(2013Y007);浙江省科学技术厅项目(2013F20005)

