基于网络药理学的姜黄素抗炎作用机制研究
赵萱, 傅超美,甘彦雄,何瑶
基于网络药理学的姜黄素抗炎作用机制研究
赵萱, 傅超美,甘彦雄,何瑶
目的:阐明姜黄素的抗炎机制。方法:通过基因本体论(GO)以及复合分子检测法(MCODE),建立的姜黄素蛋白质相互作用网络具有482个节点与1688个作用点。结果:其中两个模块与炎症密切相关,姜黄素的抗炎机制可能与SMAD、ERG和调节TLR系统有关,特别是TLR9作用最为显著。结论:TLR9可能为姜黄素起抗炎作用的蛋白质作用靶点。
姜黄素;功能模块;蛋白质相互作用;抗炎机制;生物信息学
姜黄(Curcuma longa Linn.)与莪术(Curcuma phaeocaulis Val.)作为传统常用中药,已有上千年的临床应用历史,许多古籍中有详细记载其具有活血化瘀、通络止痛的功效。姜黄素是姜黄、莪术等姜黄属植物的主要活性成分之一。现代研究表明,姜黄素具有抗炎[1]、抗癌[2]、抗氧化[3]以及神经保护等作用。其中炎症与心血管疾病关系密切[4],表现为肿胀与疼痛。同时,姜黄素的抗炎机制研究有助于明确中药在治疗炎症有效性的机理。因此,本文将借助网络模块及基因本体论(GO)的分析方法,系统的阐释姜黄素的抗炎机制。
蛋白质在生物机体内执行着各式各样的功能,且相互间合作密切。信号蛋白通常形成活性蛋白质对,实现多元功能、构成细胞间的信号通路以及细胞形态发育[5]。蛋白质相互作用(PPIs)是许多生物过程的关键,而基因本体论(GO)是目前被认为对于蛋白质相互作用的诠释的最有力的指标[6]。
在本研究中,我们将利用网络药理学的研究方法来分析姜黄素的抗炎机制。使用PPIs来构建生物网络,并分析其无标度、小范围的网络模块特性。通过模块化网络分析,阐释姜黄素的抗炎机制。
1 方法
1.1 网络构建
靶点信息来源于ChEMBL (https://www.ebi.ac.uk/ chembl/#)和STITCH4.0 (http://stitch.embl.de/)数据库。ChEMBL是一个有关药物及具药物类小分子属性的生物活性分子的化学数据库[7],其数据主要从原始文献中提取,然后进一步的优化数据,使得网站数据的品质得到最优保障。STITCH[8]是一个研究化学物质与蛋白质相互作用的数据库,它集成了众多实验资源,挖掘文献信息及预测相互作用来构建数据库。
蛋白质相互作用信息从实时更新的网络数据库String 9.1(http://string-db.org)获取,该网站用于检索对于靶点的预期作用[9]。在String 9.1中的所有可获取的关联数据将有信度评分。靶点的置信度大于0.7时将被筛选应用于PPI网络的建立。
1.2 网络分析
拓扑信息在获取可视化合成组织与结构的复杂网络时被广泛应用[10]。因此,我们将用Cytoscape软件中的network analyzer[11]分析聚类系数、连接组件、度分布、平均最短路径等参数。基于拓扑参数,并与随机网络相比,分析网络无标度、小范围和模块化等特性。
复合分子检测法(MCODE)将被用来进一步对PPI进行模块的划分,(网络中蛋白质)节点连接度的临界值大于3。此算法优于其他具有微调功能但却不能兼顾网络其他部分的图聚类制导模式方法,并且允许检查蛋白质集群的相互关联性[12]。基于识别模块,运用Cytoscape软件中的BingoBingo插件[13]进行GO富集分析,当超几何检验阈值P小于0.05时,基因本体论的注释功能与全面分析功能将被很好的展示。
2 结果与讨论
2.1 网络的构建
从STITCH 4.0提取了10个靶点,从ChEMBL提取了68个靶点。去掉重复靶点,共得到67个姜黄素靶点。姜黄素对ALPI与TLR9的有效剂量分别为100μM、8.36μM。因为姜黄素会抑制或激活其他蛋白,剩余靶点的IC50无法获取[13]。表1中列出了靶点的信息。PPI的靶点信息导入Cytoscape[14]。然后进行union计算和去重复,选择相关性最大的子图作为姜黄素的蛋白质网络,网络包含482个节点与1688个边,见图1。节点代表蛋白质,边则表示蛋白质间的相互作用关系。灰色节点表示种子节点,蓝色则为与种子节点相互作用的节点。由于目前研究的局限性,一些人体蛋白质相互作用仍不清楚。所以网络构建的研究并不全面,因此选择最大连通子图进行研究。

表1 姜黄素的靶点信息表
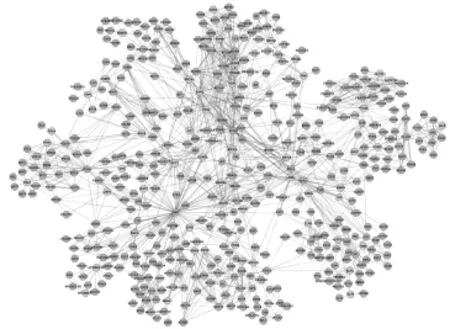
图1 姜黄素的蛋白相互作用网络
2.2 网络分析
2.2.1 拓扑分析
计算得到的拓扑参数信息见表2。
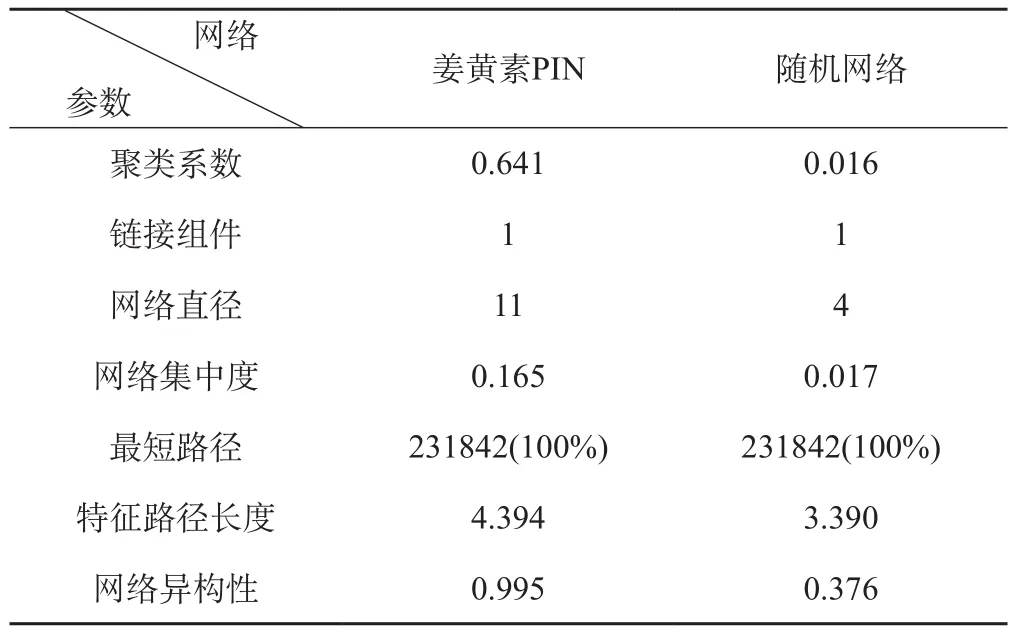
表2 关于姜黄素蛋白质相互作用网络与随机网络的参数
通过对网络中各种蛋白质间的关联数统计,用计算机求得度分布[15]。姜黄素的PIN度分布遵循幂律分布,直线方程为y=218.67x-1.359,如图2A。表明姜黄素的PIN为无标度网络。
平均最短路径指的是所有成对节点之间最短路径的平均密度[16]。如图2B,网络路径长度主要是集中在3-5步。任意两个蛋白质之间的最短路径长度为4.394。大多数蛋白质的联系非常密切,表明姜黄素的PIN具有小世界性质。
聚类系数是指节点的平均密度的区域[17]。聚类系数越高,网络的模块化程度越高。对比姜黄素PIN节点数目与边数目相同的随机网络,姜黄素的PIN聚类系数更高,表明姜黄素具有模块化的性质。综上所述,姜黄素PIN网络具有无标度、小范围和模块化的体系结构。
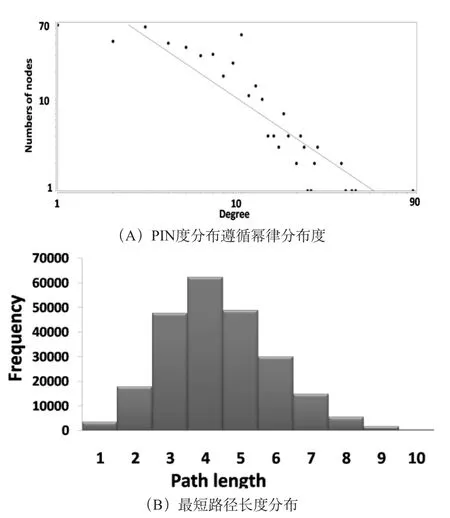
图2 姜黄素蛋白质相互作用网络与随机网络的参数
2.2.2 集群和基因本体论的富集分析
如图3所示,通过MCODE算法,获得19个模块。灰色节点表示源节点,其他为连接节点。
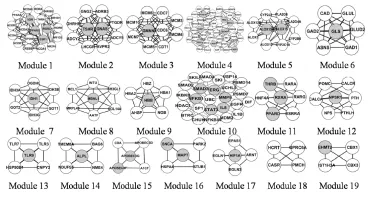
图3 GO 生物过程的模块显示部分
使用Bingo功能富集分析的结果如表3所示。结果表明,姜黄素在生物过程发挥了药效学作用,如转录调节、细胞周期、凝血酶的反向调节、过氧化氢代谢、抗炎作用等过程。其中模块10与模块13与抗炎作用有关。

表3 GO生物过程的模块显示部分

注:P 值为获得观测到的效应的概率,一个极小的P值表示观测到的效应极有可能纯属偶然,因此对无效的假设提供了证据。
模块10含有的蛋白质如IL-8、NF-κB、STAT3、SMAD3、ERG等。IL-8是引发局部炎症的关键参数[18]。核因子kappa B(NF-κB) 是炎症反应中的一个关键信号分子。STAT3被激活后可应对包括IL - 6、IL -10等各种细胞因子和生长因子。已有报道称,姜黄素通过减少IL-8水平[19]、作为NF-κB抑制剂[20]、抑制STAT3[21]从而起到抗炎作用。因此,在一定程度上证明网络模块的分析方法结果的可靠性。SMAD3的表达与激活蛋白激酶(MAPK)有关[22]。姜黄素可以通过抑制MAPK而表现出抗炎的活性[23]。所以姜黄素的抗炎活性可能与SMAD3的表达有关。ERG是红细胞完成特定转换(ETS)中的转录因子之一,可用于调节炎症[23]。C-jun可通过双磷酸化被氨基末端激酶(JNK)通道激活,将会导致炎症,ERG也被证明与C-jun具有相互作用[24]。同时,姜黄素可通过抑制JNK的活性发挥抗炎作用[25]。因此,姜黄素的抗炎作用可能与ERG有关。模块10的分析表明,姜黄素的抗炎作用可能与SMAD3与ERG相关。
模块13与toll样受体家族密切相关,包括TLR3,TLR7,TLR9,TLR3[26]可诱导激活IRF3,最终诱导的I型干扰素(IFNS)的产生。IFNS可以激活信号传感器与转录复合物(STATs),启动了Janus kinase-STAT(JAK-STAT)信号通路)。有资料显示JAK-STAT通路参与了抗炎反应[27]。TLR7和TLR9识别也使激活的细胞开始促炎反应,导致I型干扰素等细胞因子的产生[28]。此外,TLR9为种子节点,姜黄素对其有效剂量(IC50)为8.36 μM。因此,通过调节TRL蛋白群,姜黄素可能发挥抗炎作用,对于姜黄素治疗炎症TLR9可能是一个潜在的靶点。
3 结论
中药的疗效来源于历史悠久的临床实践,为保障中华民族的健康作出了重大贡献。随着现代研究的不断深入,越来越多的作用机制会被阐明。尤其对于像ChEMBL和STITCH这样的数据库而言,可为我们提供大量的可供快速筛选的蛋白质信息。
本研究基于网络拓扑结构的无标度、小世界性质、模块化性质,研究了姜黄素蛋白质相互作用。进而提出了一种模块化网络分析方法来研究姜黄素的抗炎机制。最终得到结论,姜黄素的抗炎机制可能与SMAD蛋白家族、ERG蛋白家族以及TLR调节有关。TLR9可能是姜黄素发挥抗炎作用的潜在靶点。此外,本研究还是运用模块化蛋白网络分析的例证。显然,对于预测目标化合物,这是一个行之有效的研究方法。
[1] Jurenka JS. Anti-infammatory properties of curcumin, a major constituent of curcuma longa: A review of preclinical and clinical research [J]. Alternative medicine review : a journal of clinical therapeutic, 2009,14(2):141.
[2] Wilken R, Veena MS, Wang MB, et al. Curcumin: A review of anti-cancer properties and therapeutic activity in head and neck squamous cell carcinoma [J]. Molecular cancer, 2011,10.
[3] Sun YM, Zhang HY, Chen DZ, et al. Theoretical elucidation on the antioxidant mechanism of curcumin: A dft study [J]. Organic letters, 2002,4(17):2909.
[4] Libby P. Inflammation and cardiovascular disease mechanisms [J]. The American journal of clinical nutrition, 2006,83(2):456s.
[5] Wang Z, Nakayama T. Inflammation, a link between obesity and cardiovascular disease [J]. Mediators of inflammation, 2010,535.
[6] Yeh JT, Binari R, Gocha T, et al. Papti: A peptide aptamer interference toolkit for perturbation of protein-protein interaction networks [J]. Scientifc reports, 2013,3:1156.
[7] Wang T, Ming Z, Xiaochun W, et al. Rab7: Role of its protein interaction cascades in endo-lysosomal traffic [J]. Cellular signalling, 2011,23(3):516.
[8] Maetschke SR, Simonsen M, Davis MJ, et al. Gene ontologydriven inference of protein-protein interactions using inducers [J]. Bioinformatics, 2012,28(1):69.
[9] Ashburner M, Ball CA, Blake JA, et al. Gene ontology: Tool for the unifcation of biology. The gene ontology consortium [J]. Nature genetics, 2000,25(1):25.
[10] Zhang QC, Petrey D, Deng L, et al. Structure-based prediction of protein-protein interactions on a genome-widescale [J]. Nature, 2012,490(7421):556.
[11] Ren Z, Wang X, Wang S, et al. Mechanism of action of salvianolic acid b by module-based network analysis [J]. Biomedical materials and engineering, 2014,24(1):1333.
[12] Gaulton A, Bellis LJ, Bento AP, et al. Chembl: A large-scale bioactivity database for drug discovery [J]. Nucleic acids research, 2012,40(Database issue):D1100.
[13] Kuhn M, Szklarczyk D, Pletscher-Frankild S, et al. Stitch 4: Integration of protein-chemical interactions with user data [J]. Nucleic acids research, 2014,42(Database issue):D401.
[14] Franceschini A, Szklarczyk D, Frankild S, et al. String v9.1: Protein-protein interaction networks, with increased coverage and integration [J]. Nucleic acids research, 2013,41(Database issue):D808.
[15] Albert R. Scale-free networks in cell biology [J]. Journal of cell science, 2005,118(Pt 21):4947.
[16] Almaas E. Biological impacts and context of network theory [J]. The Journal of experimental biology, 2007,210(Pt 9):1548.
[17] Barabasi AL, Oltvai ZN. Network biology: Understanding the cell's functional organization [J]. Nature reviews Genetics, 2004,5(2):101.
[18] Bader GD, Hogue CW. An automated method for finding molecular complexes in large protein interaction networks [J]. BMC bioinformatics, 2003,4.
[19] Shannon P, Markiel A, Ozier O, et al. Cytoscape: A software environment for integrated models of biomolecular interaction networks [J]. Genome research, 2003,13(11):2498.
[20] Jin W, Wang J, Zhu T, et al. Anti-inflammatory effects of curcumin in experimental spinal cord injury in rats [J]. Inflammation research : official journal of the European Histamine Research Society [et al], 2014,63(5):381.
[21] Kloesch B, Becker T, Dietersdorfer E, et al. Antiinflammatory and apoptotic effects of the polyphenol curcumin on human fibroblast-like synoviocytes [J]. International immunopharmacology, 2013,15(2):400.
[22] Assenov Y, Ramirez F, Schelhorn SE, et al. Computing topological parameters of biological networks [J]. Bioinformatics, 2008,24(2):282.
[23] Manke T, Demetrius L, Vingron M. Lethality and entropy of protein interaction networks [J]. Genome informatics International Conference on Genome Informatics, 2005,16(1):159.
[24] Przulj N. Biological network comparison using graphlet degree distribution [J]. Bioinformatics, 2007,23(2):e177.
[25] Estrada E. Virtual identifcation of essential proteins within the protein interaction network of yeast [J]. Proteomics, 2006,6(1):35.
[26] Vlahopoulos S, Boldogh I, Casola A, et al. Nuclear factor-kappab-dependent induction of interleukin-8 gene expression by tumor necrosis factor alpha: Evidence for an antioxidant sensitive activating pathway distinct from nuclear translocation [J]. Blood, 1999,94(6):1878.
[27] Klawitter M, Quero L, Klasen J, et al. Curcuma dmso extracts and curcumin exhibit an anti-infammatory and anticatabolic effect on human intervertebral disc cells, possibly by infuencing tlr2 expression and jnk activity [J]. Journal of infammation, 2012,9(1):29.
[28] Shehzad A, Ha T, Subhan F, et al. New mechanisms and the anti-inflammatory role of curcumin in obesity and obesityrelated metabolic diseases [J]. European journal of nutrition, 2011,50(3):151.
[29] Ross KR, Corey DA, Dunn JM, et al. Smad3 expression is regulated by mitogen-activated protein kinase kinase-1 in epithelial and smooth muscle cells [J]. Cellular signalling, 2007,19(5):923.
[30] Patwardhan RS, Checker R, Sharma D, et al. Dimethoxycurcumin, a metabolically stable analogue of curcumin, exhibits anti-inflammatory activities in murine and human lymphocytes [J]. Biochemical pharmacology, 2011,82(6):642.
[31] Murakami K, Mavrothalassitis G, Bhat NK, et al. Human erg-2 protein is a phosphorylated DNA-binding protein--a distinct member of the ets family [J]. Oncogene, 1993,8(6):1559.
[32] Verger A, Buisine E, Carrere S, et al. Identifcation of amino acid residues in the ets transcription factor erg that mediate erg-jun/fos-DNA ternary complex formation [J]. The Journal of biological chemistry, 2001,276(20):17181.
[33] Alexopoulou L, Holt AC, Medzhitov R, et al. Recognition of double-stranded rna and activation of nf-kappab by toll-like receptor 3 [J]. Nature, 2001,413(6857):732.
[34] Platanias LC. Mechanisms of type-i- and type-ii-interferonmediated signalling [J]. Nature reviews Immunology, 2005,5(5):375.
[35] Busch-Dienstfertig M, Gonzalez-Rodriguez S. Il-4, jak-stat signaling, and pain [J]. Jak-stat, 2013,2(4):e27638.
[36] Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity [J]. Cell, 2006,124(4):783-801.
(责任编辑:何瑶)
Research on the anti-infammatory mechanisms of Curcumin based on network pharmacology
ZHAO Xuan, FU Chaomei, GAN Yan-xiong, HE Yao//(School of Pharmacy, Chengdu University of Traditional Chinese Medicine; Key Laboratory of Standardization for Chinese Herbal Medicine, Ministry of Education; National Key Laboratory Breeding Base of Systematic Research, Development and Utilization of Chinese Medicine Resources, Chengdu 611137, Sichuan)
Objective:To elucidate the anti-infammatory mechanism of curcumin based on the analysis of protein interaction network (PIN).Method:Through the Gene ontology (GO) enrichment based on Molecular complex detection (MCODE), a PIN of curcumin with 482 nodes and 1688 interactions was created and analyzed.Result:Two modules were found to be intimately associated with infammation. In addition, the anti-infammatory effect of curcumin may be related to SMAD, ERG and mediate TLR family.Result:TLR9 might be a potential target of curcumin to treat infammation.
curcumin; module-based; PPI; anti-infammatory; bioinformatics
R28
A
1674-926X(2015)04-019-05
成都中医药大学药学院中药材标准化教育部重点实验室 中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川 成都 611137
赵萱(1986-),女,四川德阳,硕士研究生,讲师,研究方向:中药新制剂和新剂型的研究Email:626098860@qq.com
傅超美(1961-),男,四川简阳,教授,博导,研究方向:中药新制剂和新剂型的研究Email:chaomeifu@126.com
2014-12-06

