贫血患者外周血中T淋巴细胞亚群和CD55+、CD59+检测的意义*
何 苗,乔静巧,陈吉祥,马海珍,白 海(兰州军区兰州总医院血液科,兰州730050)
T淋巴细胞是一类具有特殊标志的人胸腺输出细胞,介导机体的细胞免疫,主要功能是调节蛋白质抗原引起的所有免疫应答,并清除细胞表面抗原或细胞内微生物的效应作用[1-2]。机体免疫功能主要由不同的T淋巴细胞亚群决定,最重要的是辅助性细胞(CD4+)和杀伤抑制细胞(CD8+)。在正常情况下,T淋巴细胞各亚群之间相互拮抗,达到平衡,维持机体免疫功能的稳定,但是其中任一种或几种细胞水平发生紊乱,即可引起机体免疫功能的异常,临床上通过淋巴细胞的百分比或各T细胞亚群水平来了解免疫系统的变化[3]。膜结合调节蛋白CD55(decay-accelerating factor,DAF)和 CD59 (membrane inhibitor of reactive lysis,MIRL)作为补体调节蛋白的主要成分,参与T淋巴细胞的活化、增殖、分化以及凋亡,能够调控T淋巴细胞免疫反应[4],CD55和CD59可能就是连接自然免疫和适应性免疫的重要分子。有研究发现CD55、CD59在各类贫血性疾病中均有不同程度的表达异常[5-6]。目前,有关贫血患者外周血细胞T细胞亚群水平和CD55+、CD59+的表达程度及其之间的关系尚未见文献报道。在本研究中,通过检测巨幼细胞贫血(megaloblastic anemia,MA)、缺铁性贫血(iron deficiency anemia,IDA)和再生障碍性贫血(aplastic anemia,AA)患者外周血细胞T细胞亚群水平和CD55+、CD59+的表达程度,以探讨其临床意义,为临床更有效地治疗提供一定的基础。
1 资料与方法
1.1 一般资料 收集本院2014年6月至2015年3月住院的贫血患者100例,男43例,女57例,年龄14~82岁,其中MA患者25例,IDA患者40例,AA患者35例。健康对照组30名,为来本院进行体检的人员,其中男13名,女17名,年龄
1.3 统计学处理 采用SPSS17.0统计软件处理数据,计量资料采用±s表示,用t检验方法比较各组间差异。计量资料用率表示,以P<0.05表示差异有统计学意义。
2 结 果
2.1 各种贫血与健康对照组 CD3+、CD4+、CD8+和 CD4+/CD8+比值水平检测 如表1所示,MA、IDA和AA患者的CD3+T细胞水平与健康对照组相比均降低,分别降低了10.8%、9.2%,1.3%,差异均无统计学意义(P>0.05);与健康对照组相比,3类贫血患者的CD4+T细胞水平依次为(34.2±3.43)%、(33.9±2.95)%、(32.2±3.37)%,略有降低,差异均无统计学意义(P>0.05);健康对照组CD8+T细胞水平为(22.9±2.35)%,MA、IDA和 AA患者的CD8+T细胞水平与健康对照相比分别增加了0.5%、2.3%、11.6%,其中AA患者增高最为显著(P<0.05);CD4+/CD8+的比值健康对照组为1.69±0.15,IDA和MA患者稍低于健康对照组,差异均无统计学意义(P>0.05),而 AA患者的比值为0.94±0.59,低于健康对照组,且差异有统计学意义(P<0.05),CD4+/CD8+的比值由大到小排列为:健康对照组、MA组、IDA组、AA组。25~65岁,均排除近期有感染情况和其他疾病。
1.2 方法 采集患者外周静脉血2mL,用乙二胺四乙酸(EDTA)抗凝备用。流式细胞仪检测,样品处理:白细胞处理方法,10μL抗体(CD3、CD4、CD8、CD55、CD59)与100μL血样混合避光孵育20min,加入1mL红细胞裂解液裂解10 min,再加入1mL PBS洗涤,离心1 000r/5min,弃上清液,加入500μL PBS;红细胞处理方法,5μL抗体(CD55、CD59)与5 μL血样混合避光孵育20min,充分混匀之后加入500μL PBS上机检测。
表1 各组CD3+、CD4+、CD8+、CD4+/CD8+比值水平检测结果 (±s,%)

表1 各组CD3+、CD4+、CD8+、CD4+/CD8+比值水平检测结果 (±s,%)
*:P<0.05,与健康对照组比较。
组别 n CD3+ CD4+ CD8+ CD4+/CD8+25 58.4±5.08 34.2±3.43 23.4±2.07 1.50±1.45 IDA 组 40 60.0±4.0 33.9±2.95 25.2±2.06 1.32±0.65 AA组 35 67.9±2.44 32.2±3.37 34.5±2.44* 0.94±0.59*健康对照组MA组30 69.2±3.62 38.7±3.56 22.9±2.35 1.69±0.15
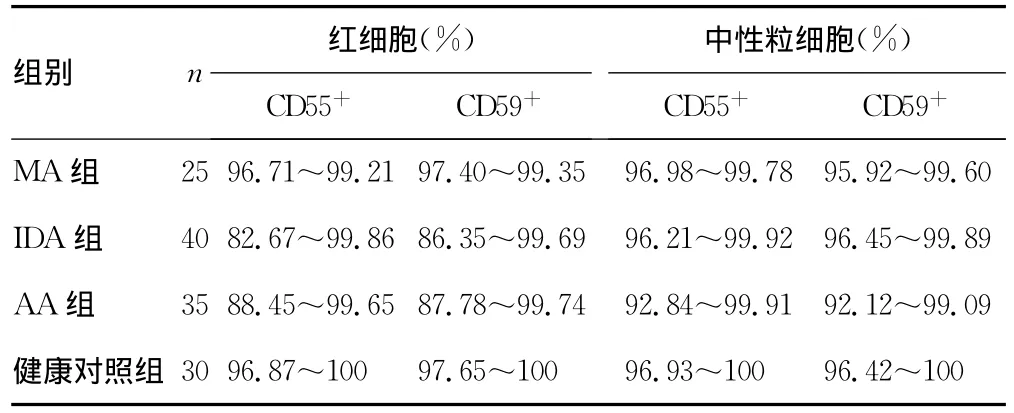
表2 各种贫血与健康对照组CD55+、CD59+水平检测
2.2 各种贫血与健康对照组CD55+、CD59+水平检测 结果如表2所示,健康对照组及MA患者外周血中红细胞和中性粒细胞膜CD55+、CD59+百分率均大于95%。40%(16/40)的IDA患者红细胞膜CD55+、CD59+表达异常,其中40例IDA患者中红细胞膜CD55+百分率在80%~95%的有15例,CD59+红细胞膜百分率在85%~95%的有17例,CD55+、CD59+中性粒细胞的百分率均大于95%。约34%的AA患者中存在CD55+、CD59+表达异常,在35例AA患者中红细胞膜CD55+百分率在85%~95%有11例,CD59+百分率在85%~95%有13例;中性粒细胞膜CD55+百分率90%~95%有14例,CD59+百分率在90%~95%有10例。
3 讨 论
目前,临床上用来判断贫血患者细胞免疫功能状态最常用的指标是CD3+T、CD4+T和CD8+T细胞水平,其中CD4+/CD8+比例是监视人体免疫功能、反映机体免疫状态的最重要指标[1-2]。CD3+T细胞与 T细胞受体(TCR)通过带正负电荷的氨基酸装配在一起形成复合物,在细胞免疫中起关键作用[3]。CD4+T细胞利用细胞因子调节免疫应答,可协助B细胞分泌抗体,且CD4+具有辅助造血的功能。静止或天然的CD8+T细胞在与抗原结合后,会分化成细胞毒细胞(CTL),在生理条件下,CTL的产生需要CD4+T细胞的帮助,所以CD4+T和CD8+T细胞相对存在,并且CD8+T细胞具有抑制造血的作用[3,7-8]。
MA是由于体内缺乏维生素B12和叶酸,导致细胞的DNA合成减慢,大部分巨幼红细胞在骨髓内未到成熟阶段即遭到破坏的一种贫血现象。许多实验证实,叶酸缺乏时细胞出现增殖受抑和过度凋亡,同时伴有粒细胞和血小板的减少,这可能与骨髓内粒系及巨核系细胞亦有类似的DNA合成障碍和成熟障碍(无效应生成)有关[9]。本文数据显示,CD3+、CD4+T细胞与健康对照组相比均降低,CD8+T细胞水平高于健康对照组,CD4+/CD8+比值略低于健康对照组。表明 MA患者可出现轻微的免疫功能紊乱,而细胞膜CD55+、CD59+均在正常范围之内,说明MA患者免疫功能紊乱与CD55+、CD59+的表达无关。
从细胞生物学角度来讲,T细胞免疫主要通过T细胞的增殖分化来实现,这是一个消耗能量、依赖核酸、蛋白质合成的复杂过程。研究表明,三羧酸循环中50%以上的酶和因素含铁或有铁存在时才能发挥作用。如果铁缺乏,将使各类含铁酶或铁依赖酶的功能受到影响,细胞色素含量减少,核糖核酸酶活性降低,DNA和蛋白质合成受到抑制,能量代谢障碍,从而影响T细胞的增殖和分化,使T淋巴功能受损,导致免疫功能低下和免疫调节紊乱[10-11]。在本研究中还发现40%(16/40)的IDA患者红细胞膜CD55+、CD59+百分率在80%~95%,而中性粒细胞的百分率均大于95%,缺铁是造成小细胞低色素贫血的主要因素,而阵发性夜间血红蛋白尿(PNH)患者也出现了小细胞低色素贫血的表现。已有研究证实PNH患者细胞由于造血干细胞基因突变,其异常细胞膜上糖基磷脂酰基醇(GPI)生成障碍,导致细胞膜上GPI链接锚蛋白异常,部分细胞上补体衰变加速因子CD55缺失和膜反应性溶解移植物CD59缺陷,导致红细胞破坏加速,出现频繁的血红蛋白尿[4]。因此IDA患者的红细胞膜CD55+、CD59+表达异常。至于为何缺铁性贫血患者红细胞会有阵发性睡眠性血红蛋白尿症样异常细胞出现,而中性粒细胞正常的原因还不清楚。因此IDA患者免疫功能紊乱可能是由缺铁引起的,而与CD55+、CD59+的表达异常没有直接关系。
AA是一种Th1细胞功能亢进,以造血细胞为靶目标的自身免疫性疾病,发病机制极为复杂,近年来研究发现,部分AA患者骨髓造血干/祖细胞和外周血中性粒细胞膜CD55+、CD59+表达水平下降[6],并有研究提示AA的免疫发病机制可与补体分子的表达异常有关。
CD55作为信号分子在介导淋巴细胞免疫应答过程中,可能参与多种自身免疫性疾病的发生[12],已证实PNH患者血细胞表达CD55缺失,自身免疫性疾病发生后,DAF基因表达水平下降,增加T淋巴细胞活化,从一定程度上解释CD55的缺失更容易引起自身免疫性疾病恶化这一现象[13]。体内实验发现CD55对T淋巴细胞免疫具有抑制作用,CD55的缺失可以引起T细胞免疫功能的增强。Liu等[13]发现在敲除DAF基因的小鼠淋巴细胞对抗原的免疫反应比野生(wild-type,WT)小鼠更强烈,更易于引起Th1/Th2平衡向Th1方向漂移,另外Kwan等[14]也证实了DAF缺失的APCs刺激T淋巴细胞向IFN-γ介导方向分化,可见,补体成分在CD55调控T淋巴细胞免疫反应中具有一定的作用。然而有关研究证实AA发病过程中存在Th1/Th2比值显著增加,且Th1/Th2失衡的严重程度与AA患者体内造血衰竭程度相关,其机制可能是抗原对免疫系统刺激后,Th1细胞过度活化,并产生大量造血负调控因子如IFN-γ和IL-12,促进CD8+T细胞增殖,进而阻止细胞周期的进行和通过Fas信号通路促进造血干细胞免疫损伤与诱导凋亡[15-16],因此,CD55+表达异常可能是引起 Th1/Th2失衡的前期事件,从而导致AA的发生。
CD59在T淋巴细胞活化、分化、调控中的作用及机制也日益成为热点。Sivasankar等[17]研究发现CD59缺失可以明显提高CD4+T免疫反应,提示CD59过度表达可能会抑制T细胞免疫。有关研究发现,患者活化的CD8+T细胞表面CD59减少,认为CD59表达的变化同患者自身疾病活动有关,也可能参与活化诱导的凋亡,提示CD59减少可能引起活化的T细胞增多[18]。这与AA中T细胞亚群水平的变化相一致。在本研究中AA患者的平均CD8+T细胞水平达36.5%,CD4+/CD8+的比值为0.94,两个指标与健康对照组相比均明显增高,并且差异有统计学意义(P<0.05)。所以CD55和CD59是T淋巴细胞亚群水平变化的决定性因素。
MA、IDA、MA 3类贫血的机制均不相同,IDA免疫紊乱可能直接是由缺铁引起的,AA患者免疫紊乱可能是由CD55和CD59表达异常引起的。本研究仅在T细胞亚群水平上对IDA、MA、AA 3类贫血患者的免疫机能进行探讨,不同贫血患者的免疫机能都可以通过T细胞亚群指标来反应,而T细胞活化信号又由磷脂酰肌醇途径所调节,这在临床上有针对性调整贫血患者体内异常的调控造血因子、高效地恢复造血功能、有效地提高贫血治疗靶点具有更大的临床意义。
[1] 王永才.最新血液骨髓细胞诊断学多媒体图谱[M].北京:人民军医出版社,2008:176-241.
[2] 礼征楠,王亚男,董敏,等.T-淋巴细胞亚群在血液病中的诊断应用[J].中国医疗前沿,2010,5(4):63,73.
[3] 张之南.血液病学[M].2版.北京:人民卫生出版社,2011:975-980.
[4] 张亚军,陈佩杰,王茹.补体调节蛋白CD55、CD59调控T淋巴细胞免疫研究进展[J].中国运动医学杂志,2010,29(4):502-505.
[5] 欧阳红梅,张芹,甸自金,等.CD55、CD59在健康者红细胞及中性粒细胞上表达的研究[J].国际检验医学杂志,2010,31(2):109-110,112.
[6] Ruiz-Delgado GJ,Vázquez-Garza E,Méndez-Ramírez N,et al.Abnormalities in the expression of CD55and CD59 surface molecules on peripheral blood cells are not specific to paroxysmal nocturnal hemoglobinuria[J].Hematology,2009,14(1):33-37.
[7] Dufour C,Ferretti E,Bagnasco F,et al.Changes in cytokine profile pre-and post-immunosuppression in acquired aplastic anemia[J].Haematologica,2009,94(12):1743-1747.
[8] Moon HW,Kim BH,Park CM,et al.CD4+CD25highFoxP3+regulatory T-cells in hematologic diseases[J].Korean J Lab Med,2011,31(4):231-237.
[9] 揭旭日,陆翔,王小超.巨幼细胞性贫血患者同型半胱氨酸与淋巴细胞亚群及血细胞变化的关系[J].广东医学,2013,34(22):3449-3451.
[10]张文娟,徐丽,刘加军.缺铁性贫血患儿免疫功能变化的研究[J].临床医学工程,2013,20(7):793-794.
[11]王腊梅,周红彬.3~6岁缺铁性贫血患儿免疫功能变化研究[J].西南军医,2004,6(4):9-10.
[12]Barros MM,Yamamoto M,Figueiredo MS,et al.Expression levels of CD47,CD35,CD55,and CD59on red blood cells and signal-regulatory protein-alpha,beta on monocytes from patients with warm autoimmune hemolytic anemia[J].Transfusion,2009,49(1):154-160.
[13]Liu J,Miwa T,Hilliard B,et al.The complement inhibitory protein DAF(CD55)suppresses T cell immunity in vivo[J].J Exp Med,2005,201(4):567-577.
[14]Kwan WH,Van Der Touw W,Paz-Artal E,et al.Signaling through C5areceptor and C3areceptor diminishes function of murine natural regulatory T cells[J].J Exp Med,2013,210(2):257-268.
[15]Ballesteros-Tato A,León B,Graf BA,et al.Interleukin-2 inhibits germinal center formation by limiting T follicular helper cell differentiation[J].Immunity,2012,36(5):847-856.
[16]Kaito K,Otsubo H,Usui N,et al.Th1/Th2lymphocyte balance in patients with aplastic anemia[J].Rinsho Byori,2004,52(7):569-573.
[17]Sivasankar B,Longhi MP,Gallagher KM,et al.CD59blockade enhances antigen-specific CD4+T cell responses in humans:a new target for cancer immunotherapy?[J].J Immunol,2009,182(9):5203-5207.
[18]Alegretti AP,Schneider L,Piccoli AK,et al.Diminished expression of complement regulatory proteins on peripheral blood cells from systemic lupus erythematosus patients[J].Clin Dev Immunol,2012(3):725684.

