27例成人Ph染色体阳性急性淋巴细胞白血病的临床分析
杨 嫄,王 利
(重庆医科大学附属第一医院血液内科 400016)
论著·临床研究
27例成人Ph染色体阳性急性淋巴细胞白血病的临床分析
杨 嫄,王 利△
(重庆医科大学附属第一医院血液内科 400016)
目的研究伊马替尼及造血干细胞移植治疗Ph+急性淋巴细胞白血病(ALL)的临床疗效。方法收集初诊Ph+ALL患者27例,19例采用伊马替尼联合化疗诱导治疗(IVD组8例,伊马替尼联合VDLP组8例,伊马替尼联合VDP组3例),其余8例给予VDLP常规化疗。22例达完全缓解(CR)后给予伊马替尼联合化疗序贯治疗,3例给予常规维持及巩固化疗,定期监测血常规、骨穿、ABL基因突变及转阴情况。6例行造血干细胞移植,其中1例为自体移植。结果伊马替尼联合化疗诱导治疗CR率可达89.5%,诱导死亡率为0;常规化疗组诱导CR率为50.0%,诱导死亡率为12.5%,两组相比较,差异有统计学意义(P<0.05)。伊马替尼联合化疗诱导治疗组中位缓解持续时间为(10.0±1.4)个月,而常规化疗组仅为2.0个月(P<0.05)。移植患者2年总生存(OS)率75.0%,无病生存期(DFS)为83.3%;未移植患者2年OS率为14.0%,DFS率为12.6%;但两组患者OS率差异无统计学意义(P>0.05),而DFS差异明显(P<0.05)。BCR/ABL转阴患者的OS及DFS均明显高于未转阴患者。结论伊马替尼联合化疗诱导治疗Ph+ALL能提高患者的CR率和缓解持续时间,造血干细胞移植能提高患者的DFS率。
费城染色体;白血病,淋巴样;急性病;伊马替尼;造血干细胞移植
费城染色体(Philadelphia chromosome,Ph染色体)阳性在成人急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)细胞遗传学异常中最常见,发病率为20%~40%。Ph染色体是一种特异性染色体,是第9号染色体上的ABL(abelson)基因易位到22号染色体上的BCR基因(breakpoint cluster region),产生嵌合体BCR/ABL融合基因。该融合基因可产生一种具有持续活性的酪氨酸激酶,在白血病形成中起关键作用[1-2]。Ph+ALL具有持续缓解时间短、复发率高和生存率低等特点,常规化疗疗效不理想,酪氨酸激酶抑制剂(Tyrosine kinase inhibitors,TKI)的引入,大大提高了Ph+ALL患者的总体生存(overall survival,OS)率,获得较好的临床疗效[3]。伊马替尼是首个用于临床治疗的TKI,提高了Ph+ALL患者的生存质量,改善了预后。BCR/ABL融合蛋白具有酪氨酸激酶活性,其通过与ATP结合和将ATP上的磷酸基转移到不同底物的酪氨酸残基上起作用,这一活动导致骨髓细胞过度增殖,从而形成白血病细胞。伊马替尼通过阻断ATP与BCR/ABL酪氨酸激酶结合,从而抑制其活性,使BCR/ABL起作用所需的底物不能被磷酸化,从而抑制包含 BCR/ABL 蛋白的白血病细胞增殖,达到抗肿瘤的目的[4]。本研究回顾性分析了27例初诊Ph+ALL患者的临床资料,探讨其临床特征、疗效等情况,现报道如下。
1 资料与方法
1.1 一般资料 收集2011~2014年本院血液内科收治的初诊成人Ph+ALL患者27例。所有患者经血常规、骨髓穿刺术、流式细胞术(白细胞免疫分型)、RT-PCR、荧光原位杂交技术(FISH)检查明确诊断。根据《血液病诊断及疗效标准》来诊断和评价疗效。27例患者无其他恶性肿瘤病史,其中男12例,女15例,中位年龄31(18~57)岁,随访时间4~31个月。有18例患者初诊时白细胞大于30×109个/L,有24例患者初诊时血小板小于80×109个/L,其中12例低于20×109个/L。
1.2 检测方法 (1)形态学检查:取骨髓及外周血标本涂片,采用瑞氏染色以及组织化学染色,包括过氧化物酶染色、碱性磷酸酶染色、糖原染色,进行形态学分型。(2)流式细胞术:取骨髓标本2~4 mL,与生理盐水等比例混合,予以肝素抗凝后,采用淋巴细胞分离液分离单个核细胞,制作成单细胞悬液,通过活细胞免疫荧光法标记,识别淋巴系统抗原包括T系和B系、髓系抗原、人类白细胞DR抗原、CD34、TdT以及浆细胞系抗原等。(3)RT-PCR:骨髓标本肝素抗凝,采用Trizol法提取细胞总RNA,上下游两对引物,先进行逆转录反应合成cDNA,再进行PCR扩增,扩增后取约10 μL产物,用2%的琼脂糖凝胶进行电泳,在仪器下观察结果。(4)FISH:对骨髓标本进行处理、变性、杂交后洗脱等操作,应用双色标记双融合信号探针BCR(光谱绿)和ABL(光谱桔红)在单细胞上检测,然后在显微镜下观察杂交的信号。
1.3 治疗方案
1.3.1 诱导治疗 8例给予IVD方案(伊马替尼400 mg/d,长春新碱1~2 mg/m2,第1、8、15、22天,地塞米松 10~20 mg/m2,第1~28天)。8例采用伊马替尼400 mg/d联合VDLP方案(长春地辛1~2 mg/m2,第1、8、15、22天;柔红霉素40 mg/m2或去甲氧柔红霉素10 mg/m2第1~3天;门冬酰胺酶 1万U/d,连续10 d;地塞米松10~20 mg/m2,第1~28天)。3例采用伊马替尼 400 mg/d联合VDP方案(长春地辛1~2 mg/m2,第1、8、15、22天;柔红霉素40 mg/m2第1~3天;地塞米松10~20 mg/m2,第1~28天)。8例患者予以VDLP首次诱导化疗,但未联合伊马替尼。
1.3.2 巩固治疗 患者达完全缓解(CR)后,序贯给予CAM、CHOP/L-asp+MTX、VP、Hyper-CVAD(C:环磷酰胺,A:阿糖胞苷/表阿霉素,M:6巯基嘌呤,H:柔红霉素,O/V:长春地辛,P/D:地塞米松,L-asp :门冬酰胺酶,MTX:甲氨喋呤)加入伊马替尼联合化疗。化疗间歇期继续给予伊马替尼治疗,服药期间每周查血常规及肝肾功情况。若用药过程中,患者白细胞小于1×109个/L,血小板小于20×109个/L,则酌情减量或停药。23例患者使用TKI治疗的中位时间为7.0个月,4例患者全程治疗中未服用TKI治疗。所有患者定期监测血常规、骨穿、ABL基因突变及转阴情况。
1.3.3 造血干细胞移植 共有6例接受了造血干细胞移植(HSCT):5例行异基因HSCT,其中1例为同胞全相合,1例为无关供者全相合,另3例均为亲缘性半相合;1例行自体干细胞移植。移植后予以TKI维持治疗,自体移植患者在移植后还予以VP方案维持化疗。异体移植中1例移植前BCR/ABL基因未转阴,其余全部转阴。
2 结 果
2.1 血常规及骨穿特点 (1)白细胞计数:白细胞中位数为75.34×109个/L ,大于30×109个/L患者18例,占66.7%,其中大于100×109个/L患者11例,占40.7%。(2)血小板计数:血小板中位数为21×109个/L,大于80×109个/L患者3例,占11.1%;小于20×109个/L有12例,占44.4%。(3)骨髓原始细胞:原始细胞为27%~97%。
2.2 RT-PCR或FISH检测 23例(85.2%)患者经RT-PCR检测BCR/ABL融合基因,其中10例表达P190蛋白,占43.5%,13例表达P210蛋白,占56.5%。14例(51.8%)患者通过FISH检测到BCR/ABL融合基因。
2.3 总体生存 27例患者诱导化疗后获得CR 21例(77.8%),部分缓解6例(22.2%),其中1例诱导期死亡(未联合TKI),1例失访,另4例PR患者继续诱导化疗最终达CR。目前有16例(61.5%)患者存活,其中有10例患者处于CR期。平均生存时间(18.0±2.5)个月,平均无疾病生存期(DFS)为(13.9±2.8)个月,见图1、图2。
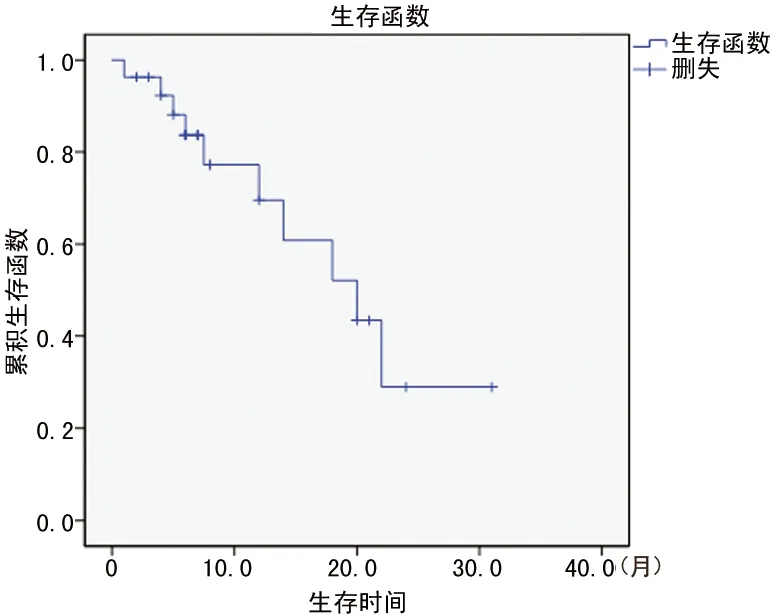
图1 所有患者OS生存分析
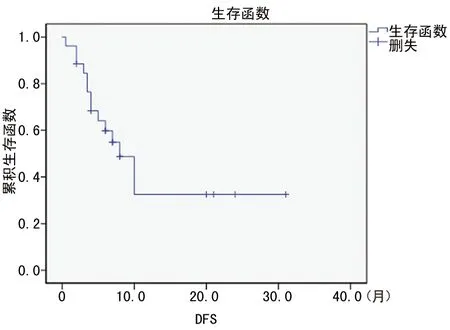
图2 所有患者DFS生存分析
2.4 并发症 2例合并中枢性白血病,1例合并败血症,5例合并真菌感染。
2.5 伊马替尼疗效 19例使用伊马替尼联合化疗诱导治疗的患者中有17例(89.5%)达CR,其中使用IVD方案诱导化疗组有7例(87.5%)患者获CR,使用伊马替尼联合VDLP组有7例(87.5%)患者获CR,伊马替尼联合VDP诱导CR率为100%。3组CR率比较差异无统计学意义(P>0.05)。IVD组、VDLP联合伊马替尼组以及VDP联合伊马替尼组诱导期感染率分别为12.5%,87.5%和66.7%(仅IVD组与伊马替尼联合VDLP组相比差异有统计学意义,P<0.05),诱导死亡率均为0。伊马替尼联合化疗方案诱导治疗的总体CR率可达89.5%,诱导死亡率为0;常规化疗组诱导CR率为50.0%,诱导死亡率为12.5%。两组的CR率及诱导缓解率相比,差异有统计学意义(P<0.05)。22例采用伊马替尼联合化疗治疗的中位持续CR为(10.0±1.4)个月,中位OS为(22.0±2.5)个月。3例未用TKI,给予常规巩固、维持治疗,中位持续CR为2.0月,中位OS为(5.0±0.8)个月。使用伊马替尼治疗的患者CR持续时间及OS均明显高于未用伊马替尼患者(P<0.05)。
2.6 移植疗效 5例患者在CR后行异基因HSCT,1例行自体HSCT,平均生存时间(25.0±5.0)个月,平均缓解持续时间(26.0±4.0)个月,2年OS率75.0%,DFS率为83.3%;未进行移植的患者,平均生存时间(16.0±1.8)个月,平均缓解持续时间(8.2±1.9)个月,2年OS率为14.0%,DFS率为12.6%。移植组的DFS明显比未移植组高(P<0.05)。可能与病例数较少有关,移植组与未移植组的OS差异无统计学意义(P>0.05)。
2.7 BCR/ABL转阴及突变 有10例(40.0%)患者BCR/ABL融合基因转阴,转阴组与未转阴组的1年OS率分别为85.0%和63.0%(P<0.05),中位DFS分别为(21.8±4.0)个月和(4.0±0.9)个月(P<0.01)。移植前ABL基因转阴患者无复发,未转阴患者移植后复发。有15例患者进行ABL基因突变检测,其中7例患者检测到ABL基因突变(其中1例患者有2种突变类型),8例无突变,BCR/ABL基因突变类型如下:Y253H 2例、S438C 1例、E255K 1例、F359C 1例、T315I 3例;有突变组与无突变组的2年OS率分别为16.7%和100%(P<0.05),复发率分别为85.7%和12.5%(P<0.05)。
2.8 疾病转归 接受长期随访的25例患者中共有14例(56.0%)患者复发,中位缓解时间4.0个月,9例复发患者死亡,其中1例为半相合异基因HSCT,移植后2.5个月复发,ABL基因未转阴且合并T315I突变,复发后予以达沙替尼联合化疗治疗后未达缓解,于移植后6.0个月死亡。
3 讨 论
Ph+ALL的临床特征包括:年龄越大发病率越高,初诊时白细胞计数高,幼稚细胞数高,血小板计数较低,和易导致中枢性白血病等[5]。在本研究中大于30×109个/L患者占66.7%,这一特点与慢性粒细胞白血病类似。过去认为成人Ph+ALL治疗效果不理想,CR率低而复发率高,是临床治疗中的一大难题。进入TKI时代后,不管从CR率、CR持续时间还是OS时间,均有明显提高,为更多的Ph+ALL患者赢得了移植时机。并且TKI可降低患者移植前肿瘤的负荷,减少移植后的复发率[6]。Eom等[7]对29例Ph+ALL和31例Ph-ALL初诊患者进行研究,Ph+ALL患者给予伊马替尼加hyper-CVAD A方案化疗,Ph-ALL患者予以hyper-CVAD A方案化疗,达CR后予以MA方案维持治疗,并行降低强度预处理异基因-HSCT。经过长期随访,Ph+ALL组与Ph-ALL组5年OS率分别为54.8%和53.7%(P>0.05),5年DFS率分别为51.6%和49.8%(P>0.05)。两组OS率及DFS率无明显差异,由此可见,伊马替尼降低了Ph+ALL的危险度。尽管伊马替尼的加入提高了Ph+ALL的CR持续时间,但单药治疗预后并不理想。本研究中伊马替尼联合常规化疗诱导治疗Ph+ALL CR率可达89.5%,诱导死亡率为0;常规化疗诱导缓解率为50.0%,诱导死亡率为12.5%。两组患者的CR率及诱导死亡率相比差异有统计学意义(P<0.05)。所有患者采用伊马替尼联合化疗治疗的中位生存时间为(22.0±2.5)个月。国外的一项临床实验显示,伊马替尼联合化疗的5年OS率明显高于单纯化疗组[8]。伊马替尼联合常规化疗诱导可分为伊马替尼+IVD方案和VDLP/VDP方案,在本研究中各方案CR率差异无统计学意义(P>0.05),但IVD组诱导感染率明显低于伊马替尼联合VDLP组。
在CR1期行异基因HSCT是现阶段国内外公认的最佳治愈Ph+ALL的方案。英国一项多中心临床试验显示Ph+ALL患者行异基因HSCT治疗后,相比单纯化疗5年复发率可从81.0%下降至32.0%, 5年无疾病生存率从17.0%上升至26.0%,OS率从19.0%提高到42.0%[9]。在本研究中的6例移植患者,移植患者2年OS率75.0%,DFS为83.3%;未移植患者2年OS率为14.0%,DFS率为12.6%;两组患者OS率可能因病例数较少缘故,差异无统计学意义(P>0.05),而DFS则有显著差异(P<0.05)。
但近年来,部分患者由于不能长期持续缓解及对伊马替尼的耐药,从而失去移植机会。成人Ph+ALL对伊马替尼产生耐药最常见的原因则是BCR/ABL基因突变。ABL激酶区域中最常见的突变为P-Loop突变,包括G250E、Q252H、Y253H、E255K/V几种类型,发生率为46.0%;而看门基因T315I突变,发生率为15.0%[10]。在本研究中,有ABL基因突变的患者复发率高达85.7%,而2年OS率仅16.7%。由于对伊马替尼耐药的频繁产生,相继出现新的TKI药物,如达沙替尼、尼洛替尼、博舒替尼,目前正逐步用于临床治疗中。二代TKI与伊马替尼相比,作用更强,特别是达沙替尼,它能同时抑制酪氨酸激酶和SRC激酶,还能透过血脑屏障[11]。由于T315I突变位于ABL基因疏水区,使得达沙替尼及尼洛替尼不能与之结合,而新型TKI普纳替尼则巧妙地避开了突变产生的空间位阻,并且可与其具有活性的氢键结合从而达到抑制作用。目前普纳替尼正用于临床试验中[12]。
综上所述,本研究证明了伊马替尼联合化疗治疗Ph+ALL,能提高患者的CR率和OS时间,HSCT能提高患者的DFS率。伊马替尼能使Ph+ALL患者赢得移植时间,但需监测ABL基因拷贝数及突变情况,以了解有无伊马替尼耐药。由于本研究例数偏少,随访时间偏短,疗效及转归尚需进一步观察。另外,移植后是否需继续使用伊马替尼以及移植时间的把握仍需更多的研究。
[1]Couban S,Savoie L,Mourad YA,et al.Evidence-based guidelines for the use of tyrosine kinase inhibitors in adults with Philadelphia chromosome-positive or BCR-ABL-positive acute lymphoblastic leukemia:a Canadian consensus[J].Curr Oncol,2014,21(2):265-309.
[2]Zhang FH,Ling YW,Zhai X,et al.The effect of imatinib therapy on the outcome of allogeneic stem cell transplantation in adults with Philadelphia chromosome-positive acute lymphoblastic leukemia[J].Hematology,2013,18(3):151-157.
[3]Lee HJ,Thompson JE,Wang ES,et al.Philadelphia chromosome-positive acute lymphoblastic leukemia:current treatment and future perspectives[J].Cancer,2011,117(8):1583-1594.
[4]Zhu Y,Qian SX.Clinical efficacy and safety of imatinib in the management of Ph(+) chronic myeloid or acute lymphoblastic leukemia in Chinese patients[J].Onco Targets Ther,2014,7:395-404.
[5]Hernández JM,Granada I,Solé F,et al.From conventional cytogenetics to microarrays.Fifty years of Philadelphia chromosome[J].Medicina Clínica,2011,137(5):221-229.
[6]王建祥.Ph染色体阳性急性淋巴细胞白血病的诊治[J].中华血液学杂志,2014,35(2):98-99.
[7]EomKS,ShinSH,YoonJH,etal.Com-parable long-term outcomes after reduced-intensity conditioning versus myeloablative conditioning allogeneic stem cell transplantation for adult high-risk acute lymphoblastic leukemia in complete remission[J].Am J Hematol,2013,88(8):634-641.
[8]Lickliter JD,Taylor K,Szer J,et al.An imatinib-only window followed by imatinib and chemotherapy for Philadelphia chromosome-positive acute leukemia:long-term results of the CMLALL1 trial[J].Leuk Lymphoma,2015,56(3):630-638.
[9]刘霆.Ph阳性急性淋巴细胞白血病的治疗进展与思考[J].中华血液学杂志,2012,33(2):73-75.
[10]Gruber F,Mustjoki S,Porkka K.Impact of tyrosine kinase inhibitors on patient outcomes in Philadelphia chromosome-positive acute lymphoblastic leukaemia[J].Br J Haematol,2009,145(5):581-597.
[11]Piccaluga PP,Paolini S,Martinelli G.Tyrosine kinase inhibitors for the treatment of Philadelphia chromosome-positive adult acute lymphoblastic leukemia[J].Cancer,2007,110(6):1178-1186.
[12]Miller GD,Bruno BJ,Lim CS.Resistant mutations in CML and Ph(+)ALL - role of ponatinib[J].Biologics,2014,8:243-254.
Clinical analysis of 27 patients with philadelphia positive acute lymphoblastic leukemia
YangYuan,WangLi△
(DepartmentofHematology,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China)
ObjectiveTo study the clinical effects of imatinib and hematopoietic stem cell transplantation in Ph+acute lymphocytic leukemia(ALL).MethodsCollecting 27 new diagnosed patients with Ph+ ALL in which 19 were assigned to induction treatment with imatinib combined with chemotherapy(8 of IVD,8 of VDLP and imatinib,3 of VDP and imatinib),the other 8 cases were treated with conventional VDLP chemotherapy.22 patients after complete remission(CR) had maintenance therapy combined with imtinib,3 patients had maintenance therapy without imtinib.Followed-up the blood routine examination,bone marrow aspiration and ABL fusion gene,6 patients had hematopoietic stem cell transplantation(one was auto-HSCT).ResultsThe CR rate of imatinib combined was higher than the patients without imatinib(89.5%vs. 50.0%,P<0.05),the induction mortality rate was also higher (0vs. 12.5%,P<0.05).The median remission duration of imatinib combined and without imatinib were (10.0±1.4)months and 2.0 months (P<0.05).The disease-free survival(DFS) was significantly longer in patients received allo-HSCT than in those received chemotherapy only (83.3%vs. 12.6%,P<0.05),but the 2 year overall survival(OS) rate was not significantly different(75.0%vs. 14.0%,P>0.05).ConclusionImatinib is effective for the induction therapy of Ph+ ALL.The remission duration of patients who received HSCT is obviously longer than those who received chemotherapy only.
philadelphia chromosome;leukemia,lymphoid;acute disease;imatinib;hematopoietic stem cell transplantation
10.3969/j.issn.1671-8348.2015.29.006
杨嫄(1989-),硕士,主要从事血液方面的研究。△
,Tel:18623015252,E-mail:liwangls@yahoo.com。
R733.71
A
1671-8348(2015)29-4048-03
2015-04-08
2015-06-12)

