1,25-(OH)2D3对哮喘小鼠体内髓系抑制细胞及气道炎症的影响
陶秋影,雷瑞瑞,王亚哲,韩 影,王 祯,陈 茜(河南省驻马店市中心医院儿内科 463000)
支气管哮喘病症的成因是非常复杂的,其是多种细胞因子及多种的炎症细胞和气道结构细胞共同作用的结果,其病变特征也较多,主要是以气道慢性炎症、气道高反应性(airway hyperresponsiveness,AHR)、可逆性气道阻塞为主要表现,可引起反复的咳嗽、喘息、胸闷[1]。目前其发病机制复杂,影响因素众多。近年来,髓系抑制细胞(myeloid derived suppressor cells,MDSCs)一种在肿瘤免疫中研究较多,具有负向调节机制的细胞,国外小鼠实验研究表明MDSCs在哮喘发病中同样起重要调节作用[2]。1,25-(OH)2D3是维生素D3的活性代谢产物,目前认为它不仅是微量元素,还是激素和免疫调节剂。体外研究证实1,25-二羟基维生素D3[1,25-(OH)2D3]能够延缓气道高反应和气道重塑的发生[3],但是尚不清楚其作用的机制。在本研究中,主要是对哮喘小鼠气道重塑模型进行建立,同时在腹腔内注射1,25-(OH)2D3,对于注射后的哮喘小鼠的气道重塑的情况进行观察,观察其改善情况及其体内的 MDSCs变化,从而试图了解1,25-(OH)2D3在哮喘发病中作用,为哮喘的治疗寻找新的靶点,现报道如下。
1 材料与方法
1.1 材料 30只雌性、健康、8周龄的BALB/c系小鼠,体质量(20±3)g,于华中科技大学同济医学院实验动物中心购买,许可 证 号:SCXK(鄂)2010-0007;卵 清 蛋 白 (OVA)、1,25-(OH)2D3(美国Sigma公司);FACS Calibur型流式细胞仪(美国BD公司);FITC标记鼠抗人CD11b,PE标记鼠抗人Gr1抗体(美国BD公司);HE染色试剂盒(南京凯基生物科技发展有限公司)。
1.2 方法
1.2.1 动物分组及哮喘模型的制备 将30只小鼠分成3组,每组有10只,分别是对照组、哮喘组以及1,25-(OH)2D3干预组,在实验前对各组的小鼠进行饲养,时间为1周,然后进行实验。哮喘组,致敏阶段:在此阶段将抗原混合液0.2mL,分别于第1、8、15天注射到小鼠的腹腔中,该抗原混合液包含生理盐水和10%氢氧化铝分别为0.05mL和0.15mL及OVA 50 μg;激发阶段:该阶段从第22天开始,激发的方式是吸入1%OV,每天1次,每次持续30min,一共进行两周,从而实现哮喘
气道模型的重塑。干预措施:在进行雾化激发前的0.5h进行生理盐水的注射,注射量0.1mL。1,25-(OH)2D3干预组:混合液的注入及雾化的吸入与哮喘组相同。干预措施:在进行雾化激发前的30min进行1,25-(OH)2D3混合液的注射,注射量0.1mL[5],从而实现对其的干预治疗。对照组:在各个阶段的操作与上述的操作相同,注射的溶液均用生理盐水来代替相应的混合液。
1.2.2 小鼠外周血收集 在模型制作成功以后,对各组的小鼠进行摘眼球取血,将所采集的血液加入到有肝素的管子中。将小鼠的血样分成3份,均进行染色。在每1份的样本中均加入30μL血及荧光标记的抗Gr1和抗CD11b抗体,在室温的环境下进行10min的染色。同时加入100μL的红细胞裂解液,同样室温下裂解10min,加入两次1mL PBS洗两遍后再加入0.5mL,而后通过FACS Calibur型流式细胞仪对其进行检测。
1.2.3 小鼠脾脏收集 在模型制作成功以后,将其处死取其脾脏。用预冷的PBS进行洗涤后进行研磨和过滤,而后收集细胞的悬液进行离心处理(1 500r/min,5min)除去上清液后用15mL PBS进行洗涤,而后加入红细胞分解液1mL,将其置于4℃环境放置5min,继续用10mL PBS进行洗涤,洗涤两次,调整细胞的体积,然后进行计数,将其分成3份进行染色。在每份的样本中加入1×106个细胞,而后分别加入荧光标记的抗Gr1以及抗CD11b抗体,在4℃避光的环境下进行15min染色,而后继续用PBS进行冲洗,两遍,而后加入PBS 0.5mL,FACS Calibur流式细胞仪检测。
1.2.4 肺组织收集 在雾化结束后1d以内对小鼠运用乙醚进行麻醉,将其在操作台上进行固定,使得其组织及心脏得以暴露,将其气管剪断取出其心脏以及右肺组织,置于甲醛溶液中,在避光的环境下放置48h以上。运用石蜡进行包埋,进行切片,厚度为3μm,同时运用HE进行染色。
1.3 统计学处理 采用SPSS17.0进行统计学分析,计量资料采用±s表示,比较采用单因素方差分析,检验方法为LDS方法,以P<0.05为差异有统计学意义。
2 结 果
2.1 小鼠造模过程中的表现 反复给予致敏及激发后,1,25-(OH)2D3干预组及哮喘组的小鼠均出现典型喘息发作,可能会出现呼吸困难及口鼻周发绀等状况。进行多次的激发,两组小鼠出现活动、进食减少,活力明显降低,体质量下降。然而1,25-(OH)2D3干预组哮喘的情况出现了明显的减缓。对照组未出现明显的不适。
2.2 病理形态学表现 在光学显微镜下进行观察:哮喘组其气管壁出现了增厚及受损,气管管腔变窄,平滑肌层出现增厚,同时出现了上皮细胞及杯状细胞的脱落及增生,无论是支气管还是血管周围炎性细胞的浸润都增多,这说明分泌了大量的黏液。1,25-(OH)2D3干预组也出现了上述的变化,但是都有所缓解的。对照组气管壁的结构完整,光滑,上皮细胞较为整齐,未出现杯状细胞的发生,气道壁正常。将其支气管壁厚度进行比较,差异有统计学意义(P<0.05),见表1,图1。
2.3 MDSCs流式细胞检测结果 哮喘组MDSCs较对照组、1,25-(OH)2D3干预组下降;1,25-(OH)2D3干预组 MDSCs较对照组、哮喘组升高,差异有统计学意义(P<0.05),见表1,图2、3。
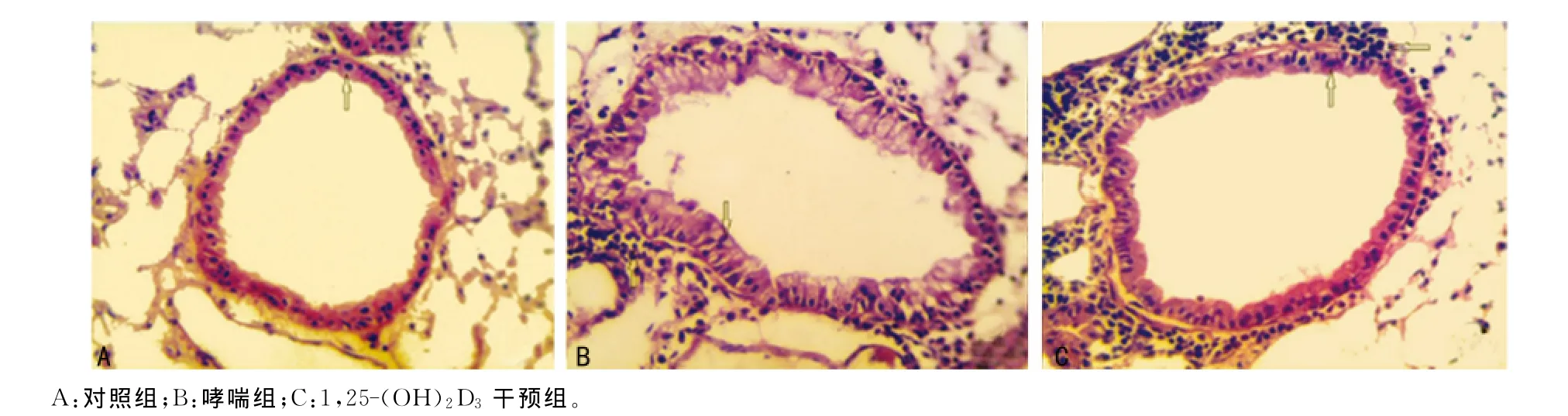
图1 小鼠肺组织支气管壁HE染色(×400)

图2 3组小鼠外周血CD11b+Gr1+MDSCs比例比较
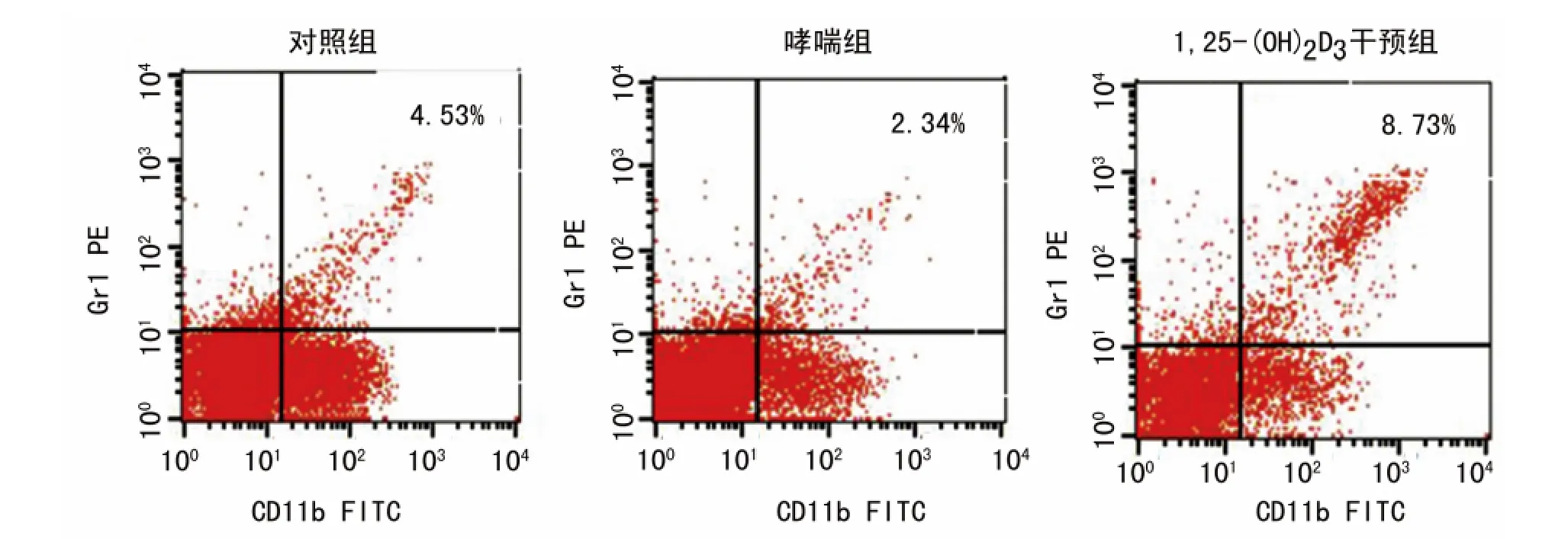
图3 3组小鼠脾脏中CD11b+Gr1+MDSCs比例比较
表1 3组小鼠气道壁厚度、MDSCs比例(±s,n=10)
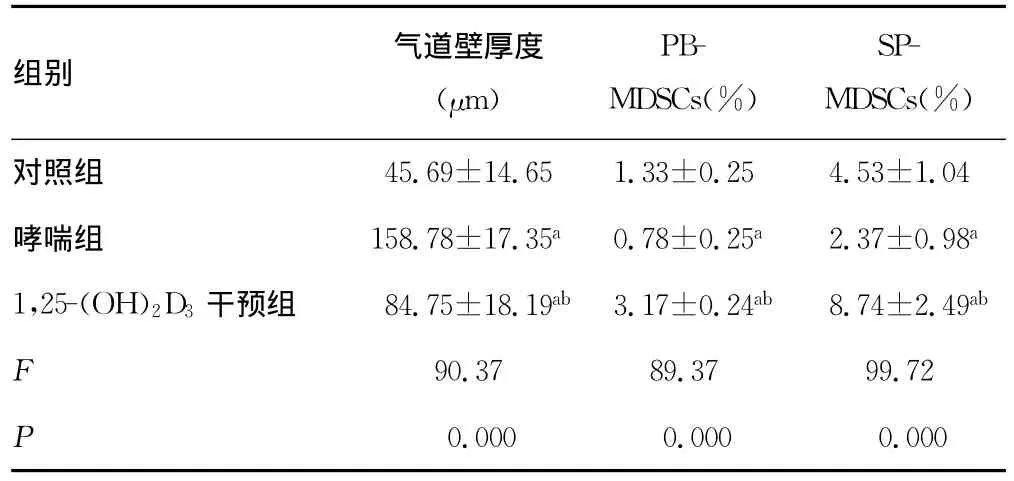
表1 3组小鼠气道壁厚度、MDSCs比例(±s,n=10)
a:P<0.05,与对照组比较;b:P<0.05,与哮喘组比较;PB:外周血;SP:小鼠脾脏。
组别 气道壁厚度(μm)PBMDSCs(%)SPMDSCs(%)45.69±14.65 1.33±0.25 4.53±1.04哮喘组 158.78±17.35a0.78±0.25a 2.37±0.98a 1,25-(OH)2D3 干预组 84.75±18.19ab 3.17±0.24ab 8.74±2.49ab F 90.37 89.37 99.72 P对照组0.000 0.000 0.000
3 讨 论
MDSCs是近年来在肿瘤免疫中研究较多具有一种负向调节机制的细胞,研究证实免疫学机制在支气管哮喘具有重要作用,许多研究发现MDSCs参与炎性反应、哮喘气道重塑。Deshane等[4]通过研究致敏小鼠,认为 MDSCs能够对于肺部的炎症及气道的高反应性起到非常重要的介导作用。Sinha等[5]通过用GR-1抗体来阻止小鼠体内 MDSCs的增殖,发现小鼠体内Th2转化受到了明显的抑制;MDSCs还可通过分泌IL-10等细胞因子使机体由Th1型免疫反应转为对免疫耐受的Th2型[6],由此可见MDSCs可通过调节Th1/Th2平衡来发挥炎性反应,这点与哮喘免疫机制相吻合。本实验哮喘小鼠体内MDSCs明显低于对照组,由此可以推测MDSCs参与小鼠哮喘发病,且哮喘小鼠体内存在MDSCs低水平状态。
1,25-(OH)2D3是维生素 D3的活性代谢产物,目前认为其不仅是微量元素,同时也存在激素及免疫的调节,但是对于其调节的特性来说尚不是非常的清楚[7-9]。VDR介导在1,25-(OH)2D3的免疫学效应中发挥较大的作用。VDR与维生素D受体结合后发挥生物学效应,维生素D受体多样性被发现与以T辅助淋巴细胞发展失衡有关的免疫系统代谢病有关[12]。但体内外研究发现,树突状细胞是1,25-(OH)2D3最主要作用目标[13],其能够使得树突状细胞未成熟化,同时能够使得IL-10和IL-12的分泌增加和降低,从而减轻哮喘炎性反应。另外1,25-(OH)2D3可选择性抑制Th1细胞的活性,促使Th1/Th2细胞平衡打破,偏向Th2细胞分化,减少其细胞因子的分泌,这正好与哮喘免疫机制相吻合。本实验向哮喘小鼠体内干预注射1,25-(OH)2D3后,小鼠的哮喘的发作与哮喘组相比明显的减缓,其气管壁受损的厚度及程度也是如此,同时无论是平滑肌层增生程度还是杯状细胞化生程度都是低于哮喘组,这说明1,25-(OH)2D3能够对于哮喘气道的炎症起到减缓的作用。本实验还发现经1,25-(OH)2D3干预小鼠体内 MDSCs明显高于对照组,提示1,25-(OH)2D3可能通过上调 MDSCs水平发挥其免疫抑制的作用,从而减轻哮喘气道炎症。
目前关于MDSCs免疫逃逸在哮喘中的机制逐渐受到重视,本研究首次测定1,25-(OH)2D3干预后哮喘小鼠体内MDSCs的变化,推断1,25-(OH)2D3可能通过上调 MDSCs水平发挥免疫抑制的作用,为哮喘治疗提供新的思路。
[1] WHO/NHLBI workshop report.National heart lung and blood institute[S].Global Strategy for Asthma Management and Prevention,Revised,2006.
[2] Arora M,Poe SL,Oriss TB,et al.TLR4/MyD88+induced CD11b+Gr-1int F4/80+non-migratory myeloid cells suppress Th2effector functionin the lung[J].Mucosal Immunol,2011,4(1):124.
[3] Song Y,Qi H,Wu C.Effect of 1,25-(OH)2D3on passively sensitized human airway smooth muscle cells[J].Respirol,2007,12(4):486-494.
[4] Deshane J,Zmijewski JW,Luther R,et al.Free radicalproducing myeloid-derived regulatory cells:potent activators and suppressors of lung inflammation and airway hyperresponsiveness[J].Soc Muc Immunol,2011,4(5):503-518.
[5] Sinha P,Clements VK,Bunt SK,et al.Cross-talk between myeloid-de-rived suppressor cells and macrophages subverts tumor immunity toward a type 2response[J].J Immunol,2007,179(2):977-983.
[6] Cuenca G,Delano MJ,Kelly-Scumpia KM,et al.A paradoxical role for myeloid-derived suppressor cells in sepsis and trauma[J].Mol Med,2011,17(3/4):281-292.
[7] Brehm JM,Celedn JC,Soto-Quiros ME,et al.Serum vitamin D levels and markers of severity of childhood asthma in Costa Rica[J].Am J Respir Crit Care Med,2009,179:765-771.
[8] Devereux G,Lit onjua AA,Tu rner SW,et al.Maternal vitamin D in take during pregnancy and early childhood wheezing[J].Am J Clin Nutr,2007,85:853-859.
[9] Agrawal T,Gupta GK,Agrawal DK.Vitamin D deficiency decreases the expression of VDR and prohibitin in the lungs of mice with allergic airway inflammation[J].Exp Mol Pathol,2012,93(1):74-81.
[10]Geldmeyer-Hilt K,Heine G,Hartmann B,et al.1,25-dihydroxyvitamin D3impairs NF-κB activation in human naive B cells[J].Biochem Biophys Res Commun,2011,407(4):699-702.
[11]Chen Y,Kong J,Sun T,et al.1,25-dihydroxyvitamin D3suppresses inflammation-induced expression of plasminogen activator inhibitor-1by blocking nuclear factor-κB activation[J].Arch Biochem Biophys,2011,507(2):241-247.
[12]李飞,高金明.维生素D、维生素D受体与支气管哮喘[J].中华哮喘杂志,2010,4(1):38-43.
[13]Dickie LJ,Church LD,Coulthard LR,et al.1,25(OH)2D3down-regulates intra-cellular Toll-like receptor 9-induced IL-6production in human monocytes[J].Rheumatology,2010,49(8):1466-1471.

