氢化可的松琥珀酸钠对感染性休克时血清感染标志物水平的影响研究
董雄军,徐忠诚
(湖北省荆门市第一人民医院,湖北 荆门 448000)
氢化可的松琥珀酸钠对感染性休克时血清感染标志物水平的影响研究
董雄军,徐忠诚
(湖北省荆门市第一人民医院,湖北 荆门 448000)
目的探讨氢化可的松琥珀酸钠对感染性休克患者血清感染标志物水平的影响。方法50例感染性休克患者根据治疗方法分为治疗组和对照组。2组确诊为感染性休克后均给予经验抗菌药物治疗及支持治疗。观察组在上述治疗基础上加用氢化可的松琥珀酸钠200mg/d静脉滴注。2组患者治疗前及治疗后24h、48h分别清晨空腹采集静脉血5mL,ELISA法测定血清中肿瘤坏死因子(TNF-α)、白细胞介素-10(IL-10);免疫化学发光法检测血清血清降钙素原(PCT)水平;免疫散射比浊法测定血清CRP水平。结果治疗后24h,观察组血清TNF-α水平明显降低(P<0.05)。治疗后48h,观察组、对照组血清TNF-α水平明显低于治疗前及治疗后24h(P均<0.05)。治疗后48h,2组血清IL-10水平均明显高于治疗前(P均<0.05)。观察组治疗后48h血清TNF-α、IL-10水平均明显高于对照组(P均<0.05)。治疗后24h,2组PCT、CRP水平均较治疗前明显降低(P均<0.05)。治疗后48h,2组PCT、CRP水平均较治疗后24h明显降低(P均<0.05)。观察组治疗后24h、48h的PCT、CRP水平均明显低于对照组(P<0.05)。结论氢化可的松琥珀酸钠能够通过抑制免疫反应,降低感染性休克患者血清TNF-α、PCT、CRP,增加血清IL-10水平,减轻炎症反应。
氢化可的松琥珀酸钠;炎症;免疫反应;血清;感染性休克
感染性休克发病率和病死率均较高,是急诊常见病症,多继发于全身性感染。当全身性感染发生时,下丘脑-垂体-肾上腺轴(HPA轴)通过影响机体内白细胞及其分泌的细胞因子等物质的变化间接参与炎症反应的发生过程[1-2]。炎症因子一方面抑制皮质醇对促肾上腺皮质激素的反应,一方面与细胞内糖皮质激素受体竞争结合糖皮质激素,表现出来的生物学效应分别为肾上腺产生糖皮质激素不足和糖皮质激素抵抗[3]。氢化可的松琥珀酸钠为短效糖皮质激素,具有抗炎和免疫调节作用,机体内小剂量的氢化可的松琥珀酸钠即能使糖皮质激素受体上调[4]。研究发现,感染性休克患者给予常规治疗结合糖皮质激素能够明显减轻机体炎症反应症状[5]。肿瘤坏死因子-α(TNF-α)为早期促炎因子,白细胞介素-10(IL-10)为抗炎因子,血清降钙素原(PCT)、C反应蛋白(CRP)为判断感染及炎症疾病的特异敏感标志物。本研究通过观察氢化可的松琥珀酸钠对感染性休克患者上述血清感染标志物水平的影响,探讨其在抑制免疫反应方面的作用机制。
1 临床资料
1.1一般资料 收集2010年9月—2013年6月本院急诊内科收治的感染性休克患者50例。所有患者均符合2001年危重病学会/外科感染学会关于全身性感染定义国际会议制定的感染性休克诊断标准。其中肺炎27例,胆管感染13例,尿路感染10例。排除标准:①既往有严重高血压、心脏病患者;②伴有肾功能衰竭的患者;③属于低血容量休克、梗阻性休克、心源性休克的患者;④患有自身免疫性疾病,长期服用激素及免疫抑制剂的患者。2组性别、年龄、慢性健康状况评分系统Ⅱ(APACHEⅡ)评分等比较差异无统计学意义(P均>0.05),基线资料均衡,具有可比性。见表1。
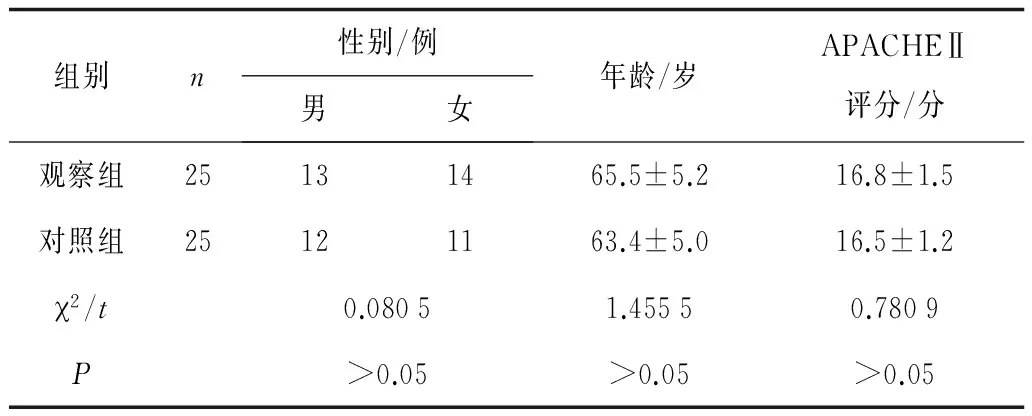
表1 2组基线资料比较
1.2治疗方法 2组确诊为感染性休克后第1小时内静脉输入林格液500mL,人血白蛋白(5%)250mL,晶体500~1 000mL/h或胶体300~500mL/h,直至中心静脉压达到8~12mmHg(1mmHg=0.133kPa)。经验性使用广谱及联合抗生素。观察组在上述治疗基础上加用氢化可的松琥珀酸钠(国药集团容生制药有限公司,国药准字H20030727)200mg/d静脉滴注。
1.3观察项目 各组患者治疗前、治疗后24h、48h分别清晨空腹采集静脉血5mL,ELISA法测定血清中TNF-α、IL-10;免疫化学发光法检测血清PCT水平;免疫散射比浊法测定血清CRP水平。
2 结 果
2.12组治疗前后血清TNF-α、IL-10水平变化情况 2组治疗前血清TNF-α、IL-10水平比较差异无统计学意义(P均>0.05)。治疗后24 h,观察组血清TNF-α水平明显降低,与治疗前比较差异有统计学意义(P<0.05)。治疗后48 h,观察组、对照组血清TNF-α水平明显低于治疗前及治疗后24 h,差异有统计学意义(P均<0.05)。2组治疗后24 h血清IL-10水平均与治疗前比较差异无统计学意义(P均>0.05)。治疗后48 h,2组血清IL-10水平均明显高于治疗前(P均<0.05)。观察组治疗后48 h血清TNF-α、IL-10水平均明显高于对照组(P均<0.05)。见表2。

表2 2组治疗前后血清TNF-α、IL-10水平变化比较
注:①与治疗前比较,P<0.05;②与治疗后24 h比较,P<0.05;③与对照组比较,P<0.05。
2.22组治疗前后血清PCT、CRP水平比较 2组治疗前血清PCT、CRP水平比较差异无统计学意义(P均>0.05)。治疗后24 h,2组PCT、CRP水平均较治疗前明显降低(P均<0.05)。治疗后48 h,2组PCT、CRP水平均较治疗后24 h明显降低(P均<0.05)。观察组治疗后24 h、48 h PCT、CRP水平均明显低于对照组(P均<0.05)。见表3。

表3 2组治疗前后血清PCT、CRP水平比较
注:①与治疗前比较,P<0.05;②与治疗后24 h比较,P<0.05;③与对照组比较,P<0.05。
3 讨 论
各种致病微生物及其毒素存在于血液或组织中引起全身炎症反应综合征,将进一步导致全身性感染和感染性休克。感染性休克发生时,血液中的细菌内毒素能够刺激机体免疫细胞释放炎症因子,炎症因子刺激效应细胞释放下游炎症因子,扩大炎症反应,释放抗炎递质[6]。
糖皮质激素能够通过抗炎反应、免疫抑制等作用阻断全身炎症反应综合征的瀑布效应,避免过度炎症反应对机体产生的损伤。但是否能够对感染性休克患者应用糖皮质激素治疗取决于患者对液体复苏及血管活性药物的反应程度。一项多中心随机对照研究结果显示,对血管活性药物无反应性的感染性休克患者,其机体存在肾上腺功能不全现象,若给予皮质醇治疗能够逆转感染性休克,降低死亡率[7]。除此项研究以外,近年来的多项大规模回顾性分析研究均肯定了糖皮质激素对感染性休克的逆转作用,但对其是否能够改善预后尚存争议[8-10]。
TNF-α为早期促炎因子,全身性感染发生早期机体释放大量TNF-α,TNF-α能够促进其他炎症因子进一步释放,扩大炎症反应,促进全身炎症反应综合征的发生与发展。本研究发现,感染性休克患者治疗后24 h,观察组血清TNF-α水平明显降低(P<0.05)。而对照组血清TNF-α水平则与治疗前比较无明显下降。治疗后48 h,观察组、对照组血清TNF-α水平明显低于治疗前及治疗后24 h(P均<0.05)。观察组治疗后48 h血清TNF-α水平明显高于对照组(P<0.05)。由此可得出以下结论,外源性给予糖皮质激素能够补充机体内皮质醇相对不足的状态,令体内TNF-α水平下调,减轻炎症反应程度,达到改善感染性休克的目的。
IL-10为抗炎因子,由T细胞、B细胞、巨噬细胞分泌,是促进机体代偿性抗炎反应综合征的典型细胞因子之一,可通过抑制辅助性T细胞发挥免疫抑制作用,从而抑制炎症反应发展。感染性休克后机体IL-10水平的持续释放能够抑制单核细胞对前炎症因子的释放,抑制免疫反应紊乱现象的发生发展[11]。本研究中,2组治疗后24 h血清IL-10水平与治疗前比较差异无统计学意义(P均>0.05)。治疗后48 h,2组血清IL-10水平明显高于治疗前(P均<0.05)。观察组治疗后48 h血清IL-10水平明显高于对照组(P<0.05)。可见小剂量氢能够明显升高感染性休克患者血浆IL-10水平。
CRP、PCT是感染、炎症性疾病诊断的特异性标志物[12],是预测感染性休克的病情、反映其疗效的重要指标。PCT由甲状腺C细胞产生,当感染性休克发生时,甲状腺外组织大量合成并释放PCT,导致血液中PCT水平明显升高。而动态观察感染性休克患者血清中CRP水平,有助于及时发现病情危重程度及转化。本研究中,治疗后24 h,2组PCT、CRP水平均较治疗前明显降低(P均<0.05)。治疗后48 h,2组PCT、CRP水平均较治疗后24 h明显降低(P均<0.05)。观察组治疗后24 h、48 h时的PCT、CRP水平均明显低于对照组。
综上所述,对于感染性休克患者,氢化可的松琥珀酸钠的应用能够维持全身抗炎反应综合征与机体代偿性抗炎反应综合征之间的平衡状态,减轻机体促炎反应,增强抗炎反应。
[1] 崔娜,刘大为,曾正陪,等. 严重感染患者下丘脑-垂体-肾上腺轴功能的再评价[J]. 中华内分泌代谢杂志,2007,23(5):432-434
[2] 崔娜,刘大为. 糖皮质激素在严重感染和感染性休克中的应用[J]. 中国危重病急救医学,2005,17(4):241-243
[3] Amaya-Mejía AS,Galindo-Pacheco LV,O’Farrill-Romanillos PM,et al. Utility of challenge test in immediate hypersensitivity to hydrocortisone sodium succinate[J]. Rev Alerg Mex,2014,61(1):32-37
[4] Hölz W,Ludwig A,Forst H. Anaphylactic shock following intravenous hydrocortisone succinate administration[J]. Anaesthesist,2002,51(3):187-190
[5] 孙昀. 糖皮质激素在感染性休克中的应用研究进展[J]. 中国急救医学,2014,34(4):297-301
[6] 张雪峰. 小剂量糖皮质激素对感染性休克患者免疫功能影响的临床研究[D]. 南京:东南大学,2013
[7] Tilahun AY,Chowdhary VR,David CS,et al. Systemic inflammatory response elicited by superantigen destabilizes T regulatory cells, rendering them ineffective during toxic shock syndrome[J]. J Immunol,2014,193(6):2919-2930
[8] 牛吉瑞,王旭东. 糖皮质激素在严重感染及感染性休克中的应用[J]. 中国医刊,2013,48(9):8-10
[9] Antonucci E,Fiaccadori E,Taccone FS,et al. Glucocorticoid administration in sepsis and septic shock: time for a paradigm change[J]. Minerva Anestesiol,2014,80(9):1058-1062
[10] 韩旭东,孙华,黄晓英,等. 垂体后叶素与去甲肾上腺素治疗感染性休克比较的临床研究[J]. 中国危重病急救医学,2012,24(1):33-37
[11] Rearte B,Landoni V,Laborde E,et al. Differential effects of glucocorticoids in the establishment and maintenance of endotoxin tolerance[J]. Clin Exp Immunol,2010,159(2):208-216
[12] Prkno A,Wacker C,Brunkhorst FM,et al. Procalcitonin-guided therapy in intensive care unit patients with severe sepsis and septic shock-a systematic review and meta-analysis[J]. Crit Care,2013,17(6):R291
徐忠诚,E-mail:570481572@qq.com
10.3969/j.issn.1008-8849.2015.29.020
R0631.4
B
1008-8849(2015)29-3246-03
2014-12-01

