黄芪多糖、丹参酮联合醛固酮受体拮抗剂对CHF模型大鼠MIF、TNF-α、IL-6的影响
肖大刚
(铁煤集团总医院,辽宁 铁岭 112700)
黄芪多糖、丹参酮联合醛固酮受体拮抗剂对CHF模型大鼠MIF、TNF-α、IL-6的影响
肖大刚
(铁煤集团总医院,辽宁 铁岭 112700)

目的研究黄芪多糖、丹参酮联合醛固酮受体拮抗剂对慢性心力衰竭(CHF)模型大鼠巨噬细胞移动抑制因子(MIF)、肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)水平的影响。方法将60只成年雄性SD大鼠随机分为对照组、模型组、黄芪多糖+丹参酮组、螺内酯组、黄芪多糖+丹参酮+螺内酯组和阿托伐他汀组,每组10只。除对照组外,其余组均采用阿霉素腹腔注射复制CHF大鼠模型。造模成功后,各给药组灌胃相应药物,模型组和对照组灌胃等量蒸馏水。在造模及灌胃过程中观察各组大鼠的症状及体征,灌胃结束后测空腹体质量,行超声心动图检查,计数左心室质量指数(LVWI),采用ELISA法检测血清MIF、肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)水平。结果与对照组比较,模型组大鼠出现精神萎靡、活动量少、食欲下降等CHF症状;超声心动图显示左心室舒张末内径(LVEDD)、左心室收缩末内径(LVESD)明显增加,左心室射血分数(LVEF)和左室短轴缩短率(LVFS)明显下降;LVWI和血清MIF、TNF-α和IL-6水平明显上升。各给药组大鼠CHF症状明显改善,LVEDD、LVESD和LVWI明显下降,LVFS和LVEF明显增加,血清MIF、TNF-α和IL-6水平明显下降,其中黄芪多糖+丹参酮+螺内酯组各指标改善更明显。结论黄芪多糖、丹参酮联合醛固酮受体拮抗剂能下调CHF模型大鼠血清MIF、TNF-α、IL-6的水平,逆转心肌重构,改善CHF的心功能。
慢性心力衰竭;黄芪多糖;丹参酮;螺内酯;巨噬细胞移动抑制因子
慢性心力衰竭(chornic heart failure, CHF)是心脏结构性和功能性损伤引起心室充盈和射血能力受损的综合征,是多种心血管疾病的最终结果[1],其病死率高达50%[2]。近年来研究表明,神经激素和前炎性细胞因子的过度激活及由此而导致的心肌重塑是CHF发生和发展的根本原因[3]。巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)作为前炎症因子,可诱导自然杀伤细胞(NK)、T细胞产生γ-干扰素(IFN-γ),促进肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和人粒细胞-巨噬细胞集落刺激因子(GM- CSF) 等炎症因子的表达,通过抑制心肌收缩力,引起心肌重塑及心肌细胞的凋亡,是导致心力衰竭发生的一个重要炎性指标[4]。他汀类药物除具有调血脂作用外,还具有抗氧化、调节NO合成、改善内皮功能、抑制炎症因子和逆转心肌重构等作用[5],是一种新的抗心室重塑剂,能延缓心力衰竭进展。黄芪和丹参酮是分别从黄芪和丹参酮中提取获得的有效成分,二者具有抗炎、抗氧化和免疫调节作用,对CHF具有改善作用[6]。随着现代医学研究的不断深入,醛固酮受体拮抗剂(aldosterone receptor antagonists, ARA)的改善内皮功能、抗炎、抗血栓等作用逐渐广为人知,成为继血管紧张素转化酶(ACE)抑制剂和β受体拮抗剂后用于治疗CHF的第3类药物[7],但其单独应用对心功能的改善作用有限。本研究观察了黄芪多糖、丹参酮、醛固酮受体拮抗剂螺内酯单用及联合应用对CHF模型大鼠心功能及MIF、TNF-α、IL-6的影响,并与阿托伐他汀对照,旨在探讨单纯西药、中药及中西医结合治疗CHF的效果,为临床提供治疗依据。
1 实验资料
1.1材料
1.1.1实验动物 成年雄性SD大鼠60只,体质量(230±20)g,由南京医科大学动物中心提供,动物许可证号为SCXK(苏)2013-005。动物分笼饲养,自由摄食和饮水,通风良好,室温18 ~ 25 ℃,12 h光照昼夜循环。实验中SD大鼠的使用严格按照《中华人民共和国实验动物管理条例》和《实验动物质量管理方法》进行。
1.1.2药物与试剂 阿霉素(ADR),上海禾丰制药有限公司,批号:02140702;黄芪多糖,广东惠州东方植物科技有限公司,提取方法:原药粉末50g经水浸泡30min,水提取3次,再经过30min/次浓缩成3g/(kg o d)。丹参酮ⅡA,上海第一生物制药厂,批号:100603。阿托伐他汀片,德国辉瑞制药有限公司,批号:J20110098。MIF、TNF-α和IL-6检测试剂盒由南京建成生物工程研究所提供,批号分别为:20140923,20140912,20140929。
1.1.3仪器 TGL-16R高速离心机(上海安亭),Vivid7.0彩色超声仪(美国GE公司),电热恒温培养箱(DH4000A,天津泰斯特),半自动洗板机(Thermo, USA)。
1.2实验分组、造模及给药 将大鼠随机分为对照组、模型组、黄芪多糖+丹参酮组、螺内酯组、黄芪多糖+丹参酮+螺内酯组和阿托伐他汀组,每组10只。除对照组常规饲养、蒸馏水灌胃外,其余组大鼠均参照文献[8],给予ADR3.0mg/kg腹腔注射,3次/周,间隔1d,持续2周。之后模型组给予蒸馏水灌胃6周,黄芪多糖+丹参酮组给予黄芪多糖3g/ (kg·d)灌胃+丹参酮ⅡA 5mg/(kg·d)静脉注射6周,螺内酯组给予螺内酯40mg/(kg·d)灌胃6周,黄芪多糖+丹参酮+螺内酯组给予黄芪多糖3g/ (kg·d)灌胃+丹参酮ⅡA 5mg/(kg·d)静脉注射+螺内酯40mg/(kg·d)灌胃6周,阿托伐汀片组给予阿托伐他汀10mg/(kg·d)灌胃6周。
1.3检测指标
1.3.1大鼠形态、体征观察及体质量测定 在造模及灌胃过程中观察各组大鼠的形态及体征,灌胃结束后测各组大鼠空腹体质量(BW)。
1.3.2超声心动图检查 实验结束后,各组大鼠腹腔注射戊巴比妥25 mg/kg行全身麻醉,固定后左前胸备皮,采用70%的乙醇消毒。应用 GE Vivid 7. 0 超声仪12L 探头行经胸高频超声检查,频率13MHz,在二维超声引导下用M 型超声经胸骨左心长轴切面测量左心室舒张末内径(LVEDD)、左心室收缩末内径(LVESD),求3个心动周期的平均值,并按照 Teichholtz公式[9]计算左心室射血分数(LVEF) 、左室短轴缩短率(LVFS)。
1.3.3心室重塑指标的测定 实验结束后处死大鼠,开胸切取心脏,剪去大血管、心外膜脂肪组织,剪除心房及右心室,滤纸吸干后将左心室和室间隔准确称质量,并计算心室质量(LVW)与BW的比值,即左心室质量指数 (LVWI)[10]。
1.3.4血清MIF、TNF-α和IL-6水平测定 动物处死前,经颈动脉取血,于干净促凝管中室温凝固0.5h后1000r/min离心 15min,收集血清并分装。按 ELISA试剂盒说明书操作检测血清MIF、TNF-α及IL- 6 水平。
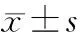
2 结 果
2.1各组大鼠一般形态和体征的变化 实验结束时,对照组大鼠全部存活,模型组死亡3只,黄芪多糖+丹参酮组死亡2只,螺内酯组死亡1只,黄芪多糖+丹参酮+螺内酯组死亡2只,阿托伐汀片组大鼠全部存活。造模2周,模型大鼠出现毛色暗淡、活动量下降、精神萎靡、进食减少、呼吸急促等明显心力衰竭体征。给药6周后,各给药组大鼠心力衰竭体征与模型组比较明显改善,表现为自发活动增加、毛色改善、腹水减轻、食欲增加。
2.2各组大鼠心功能比较 实验结束时,超声心动图测定显示模型组大鼠心室壁增厚,心室扩张,LVEDD、LVESD增加,LVFS和LVEF下降,与对照组比较差异均有统计学意义(P均<0.05);各给药组LVEDD、LVESD下降,LVFS和LVEF增加,与模型组比较差异均有统计学意义(P均<0.05),其中黄芪多糖+丹参酮+螺内酯组改善情况更明显。见表1。

表1 各组大鼠心功能比较
注:①与对照组比较,P<0.05;②与模型组比较,P<0.05;③与黄芪多糖+丹参酮+螺内酯组比较,P<0.05。
2.3各组大鼠BW、LVW和LVWI比较 各组BW、LVW和LVWI的结果如表2所示。模型组LVW低于对照组,各给药组LVW均高于模型组,但各组间比较差异均无统计学意义。模型组BW明显低于对照组(P<0.05),LVWI明显高于对照组(P<0.05)。与模型组比较,各给药组BW明显高于模型组(P<0.05),LVWI明显低于对照组(P<0.05),且各给药组间BW和LVWI比较差异无统计学意义(P均>0.05)。见表2。

表2 各组大鼠BW、LVW和LVWI比较
注:①与对照组比较,P<0.05;②与模型组比较,P<0.05。
2.4各组大鼠血清MIF、TNF-α和IL-6水平比较 模型组大鼠血清MIF、TNF-α和IL-6水平均明显高于对照组(P均<0.05)。各给药组大鼠血清MIF、TNF-α和IL-6水平均明显低于模型组(P均<0.05),其中黄芪多糖+丹参酮+螺内酯组各指标水平均明显低于黄芪多糖+丹参酮组和螺内酯组(P均<0.05)。见表3。
3 讨 论

表3 各组大鼠血清MIF、TNF-α和IL-6水平比较
注:①与对照组比较,P<0.05;②与模型组比较,P<0.05;③与黄芪多糖+丹参酮+螺内酯组比较,P<0.05。
P心肌重构是CHF发生的病理生理基础,而细胞炎症因子的调控网络在CHF心肌重构中发挥着重要作用[11]。当CHF心肌重构发生时,血管紧张素-醛固酮系统(RASS)和交感神经系统兴奋性增强,多种内源性神经分泌系统和细胞因子的长期慢性激活,如NF-κB、MIF、TNF-α、IL-6、IL-8、IL-10等,进一步加重心肌重构的发展[12]。血清IL-6和TNF-α水平与心力衰竭有关,二者可能通过抑制肌浆网Ca2+-ATP酶,推迟舒张心肌细胞钙离子的再吸收和衰减,导致心功能不全[13]。而MIF作为IL-6和TNF-α上游调控因子,在CHF发病中起着非常关键的作用,现成为CHF治疗的新靶点。
在CHF发生和发展过程中,RASS和交感神经系统与其病情的发展密切相关。在神经内分泌系统中,醛固酮具有独立和相加于AngⅡ对心脏结构和功能的不良,因此醛固酮受体拮抗剂成为CHF治疗的主要策略之一[14]。吴萃荣等[15]临床研究表明,螺内酯可以通过抑制心肌纤维代谢、减轻心肌细胞坏死及抑制炎症反应改善CHF患者左心室重构。孙爱华等[16]研究发现螺内酯不仅可以抑制RASS系统,而且能完全阻断醛固酮对心肌的损害。除此之外,螺内酯可以调节多种神经内分泌因子如BNP、TNF-α、IL-6、TGF-β的分泌[17]。但CHF的发生是一个复杂的病理生理过程,单独应用西药治疗效果不是十分理想,对CHF的并发症几乎不产生治疗作用。而中医药具有多组分、多靶点、多途径和多层次的药理作用特点,在CHF防治中可起到改善血流动力学,改善心功能,抑制炎症因子释放,扩张外周血管,减轻心脏负荷,抑制心肌重构的作用[18]。黄芪多糖为黄芪的主要成分,其可通过抑制心脏微血管内皮细胞NF-κB信号级联反应,减少炎症因子的表达[19]。丹参酮ⅡA是丹参的主要成分,具有良好的抗炎、抗氧化、免疫调节作用[5]。本研究结果显示,黄芪多糖+丹参酮组、螺内酯组、黄芪多糖+丹参酮+螺内酯组大鼠血清MIF、TNF-α和IL-6水平均明显低于模型组,LKWI、LVEDD、LVESD、LVFS和LVEF均较模型组明显改善,且黄芪多糖+丹参酮+螺内酯组各指标改善情况明显优于黄芪多糖+丹参酮组和螺内酯组。表明黄芪多糖+丹参酮和螺内酯均可明显改善CHF大鼠心肌重构,降低MIF、TNF-α和IL-6水平,但联合应用有效果叠加作用。
综上所述,黄芪多糖、丹参酮联合醛固酮受体拮抗剂可以明显下调CHF模型大鼠MIF、TNF-α和IL-6水平,逆转心肌重构,改善CHF的心功能,为中西医结合治疗CHF提供了理论依据。
[1] 王翔,易省阳. 慢性心力衰竭诊断及治疗新进展[J]. 中华实用诊断与治疗杂志,2015,29(1):10-12
[2] 黄峻. 慢性心力衰竭诊断和治疗2012:现状和进步[J]. 心血管病学进展,2012,33(1):1-5
[3]TomasiL,ZanottoG,ZanollaL,etal.Physiopathologiccorrelatesofintrathoracicimpedanceinchronicheartfailurepatients[J].PacingClinElectrophysiol,2011,34(4):407-413
[4]BoucekRJJr,SteeleJ,JacobsJP,etal.Exvivoparacrinepropertiesofcardiactissue:Effectsofchronicheartfailure[J].JHeartLungTransplant,2015,34(6):839-848
[5] 王蕾,张世杰,王海鹏,等. 阿托伐他汀对兔舒张性心力衰竭模型心室重构的影响[J]. 中国循环杂志,2010,25(3):223-226
[6] 宋杰,胡阳黔,刘坚,李静. 黄芪多糖对慢性心衰大鼠心肌AMPK活性和FFA代谢的影响[J]. 中国病理生理杂志,2015,31(1):28-32
[7]GuichardJL,ClarkD3rd,CalhounDA,etal.Aldosteronereceptorantagonists:currentperspectivesandtherapies[J].VascHealthRiskManag, 2013,9:321-331
[8] 曾瑾,崔凤娟,王海珍,等. 阿霉素诱导和腹主动脉缩窄术复制大鼠慢性心力衰竭模型的比较[J]. 皖南医学院学报,2014,38(3):189-192
[9] 吴运香,张野,谢春林,等.SD大鼠阿霉素慢性心力衰竭模型的建立与评价[J]. 中国药理学通报,2011,27(8):1170-1173
[10]HuangLL,PanC,WangL,etal.ProtectiveeffectsofgrapeseedproanthocyanidinsoncardiovascularremodelinginDOCA-salthypertensionrats[J].JNutrBiochem, 2015,26(8):841-849
[11]ZerneckeA,BernhagenJ,WeberC.Macrophagemigrationinhibitoryfactorincardiovasculardisease[J].Circulation,2008,117(12):1594-1602
[12]AsareY,SchmittM,BernhagenJ.Thevascularbiologyofmacrophagemigrationinhibitoryfactor(MIF).Expressionandeffectsininflammation,atherogenesisandangiogenesis[J].ThrombHaemost, 2013,109(3):391-398
[13]NairJ,GhatgeM,KakkarVV,etal.Networkanalysisofinflammatorygenesandtheirtranscriptionalregulatorsincoronaryarterydisease[J].PLoSOne, 2014,9(4):e94328
[14] 代大顺,曾垂义. 螺内酯对慢性心力衰竭患者肾素-血管紧张素-醛固酮系统及脑利钠肽的影响[J]. 中国药房,2011,22(28):2610-2612
[15] 吴萃荣,周凝刚,张小辉,等. 螺内酯对慢性心力衰竭患者左室重构的作用机制[J]. 广东医学,2014,35(18):2924-2926
[16] 孙爱华,赵强,梅克治,等. 螺内酯对慢性心力衰竭患者神经内分泌激素的影响[J]. 中国心血管病杂志,2007,12(1):34-37
[17]WidimskJSr.Effectofspironolactoneinpatientswithheartfailureandpreservedleftventricularfunction-TOPCATstudy[J].VnitrLek,2015,61(5):376-380
[18] 崔燕. 慢性心力衰竭中西医结合治疗新进展[J]. 现代中西医结合杂志,2015,24(19):2163-2166
[19] 杨志霞,李振彬,林谦,等. 黄芪多糖联合丹参酮阻断慢性心衰大鼠NF-κB激活MIF、TNF-α及IL-6表达的研究[J]. 中华中医药杂志,2012,27(12):3221-3225
Effect of astragalus polysaccharides, tanshinone combined with aldosterone receptor antagonist on MIF, TNF-α and IL-6 in chronic heart failure model rats
(The Second People’s Hospital of Guangdong Province, Guangzhou 510317, Guangdong, China)
XIAO Dagang (General Hospital of Tiemei Group, Tieling 112700, Liaoning, China)
Objective It is to study the effects of astragalus polysaccharide, tanshinone combined with aldosterone receptor antagonist on macrophage migration inhibitory factor (MIF), TNF-α and IL-6 in chronic heart failure (CHF) model rats. Methods 60 male SD rats were randomly divided into six groups: control group, model group, astragalus polysaccharides+tanshinone group, spironolactone group, astragalus polysaccharides+tanshinone +spironolactone group and atorvastatin group each group had 10 rats. All the rats except that in control group were given adriamycin by intraperitoneal injection to establish CHF models. After successfully establishing, every treatment group was given respective medicine by intragastric administration, control group and model group was given normal saline. The symptoms and signs of the rats during establishing and treatment were observed, body weight was measured, LVWI were detected by echocardiography, the levels of serum MIF, TNF-α and IL-6 were determined by ELISA. Results Compared with control group, the rats in model group showed CHF symptoms such as listlessness, little activity, loss of appetite, echocardiography showed left ventricular end-diastolic diameter (LVEDD), left ventricular systolic diameter (LVESD) increased significantly, left ventricular ejection fraction (LVEF) and left ventricular short axis shortening rate (LVFS) significantly decreased; Left ventricular mass index (LVWI) and right ventricular mass index (RVWI) increased significantly; the levels of serum MIF, TNF-α and IL-6 increased obviously. In every treatment group, CHF symptoms improved obviously; LVEDD, LVESD decrease obviously, LVFS and LVEF increased significantly; the levels of serum MIF, TNF-α and IL-6 decreased obviously, and the improvements were the best in astragalus polysaccharides+tanshinone+spironolactone group. Conclusion Astragalus polysaccharides, tanshinone combined with aldosterone receptor antagonist can down-regulate the levels of serum MIF, TNF-α and IL-6,reverse myocardial remodeling, improve cardiac function in the rats with CHF.
chronic heart failure; astragalus polysaccharides; tanshinone; spironolactone; macrophage migration inhibitory factor
肖大刚,男,主治医师,研究方向为慢性心力衰竭的诊治。
10.3969/j.issn.1008-8849.2015.29.004
R-332
A
1008-8849(2015)29-3203-04
2015-01-18

