子痫前期患者胎盘中miRNA-21及Th17相关因子的表达及其关系
朱 丽,朱华英,徐玲娣,陈廷美,刘颂平
(1. 江苏大学医学院,江苏 镇江 212000;2. 江苏大学附属第四人民医院/镇江市妇幼保健院,江苏 镇江 212000)
论 著
子痫前期患者胎盘中miRNA-21及Th17相关因子的表达及其关系
朱 丽1,朱华英2,徐玲娣2,陈廷美2,刘颂平2
(1. 江苏大学医学院,江苏 镇江 212000;2. 江苏大学附属第四人民医院/镇江市妇幼保健院,江苏 镇江 212000)

目的探讨胎盘中Th17细胞相关因子IL-17、IL-21、RORc、人类白细胞抗原-G(HLA-G)蛋白及胎盘中微小RNA(micro-ribonucleic acid,miRNA)-21在子痫前期发病中的作用。方法选择孕33~37周行剖宫产分娩的子痫前期产妇20例作为子痫前期组,选择孕38周以上自愿要求行剖宫产产妇20例作为正常对照组。采用实时荧光定量-聚合酶链反应技术检测胎盘组织中IL-17、IL-21、RORc 、HLA-G蛋白以及miRNA-21的表达量。结果子痫前期组胎盘中IL-17、IL-21及miRNA-21相对表达量均明显高于正常对照组(P均<0.01),RORc和HLA-G相对表达量明显低于对照组(P均<0.05)。2组胎盘组织中IL-17、IL-21及miRNA-21表达均呈正相关,RORc和HLA-G表达均呈负相关。结论子痫前期患者胎盘组织中miRNA-21表达升高,促使Th17细胞激活,导致IL-17和IL-21分泌增加;同时miRNA-21表达升高,使得RORc mRNA和HLA-G mRNA的稳定性降低,产生基因沉默影响转录,导致RORc和HLA-G表达减少。IL-17、IL-21、RORc 、HLA-G蛋白以及miRNA-21可能与子痫前期发病有关。
子痫前期;miRNA-21;Th17细胞相关因子
怀孕前血压正常的孕妇在妊娠20周以后出现高血压、蛋白尿称为子痫前期或前兆子痫(preeclampsia,PE),其是妊娠期孕妇的并发症之一,有2%~7%首次受孕的健康孕妇深受其害[1]。子痫前期常伴随早产、胎儿生长受限、围生期胎儿死亡以及子女成年后长期健康问题等[2],并会增加孕产妇和婴儿在未来患心血管疾病以及2型糖尿病(T2DM)的危险[3]。目前子痫前期的致病机制尚未阐明[4]。随着对表观遗传调控机制研究的深入,逐渐发现表观遗传调控在多种复杂疾病的发生发展中起重要作用,其中微小RNA(micro-ribonucleic acid,miRNA)是近年来发现的最重要的表观遗传调控现象之一[5]。本研究探讨了子痫前期患者胎盘中miRNA-21及Th17相关因子IL-17、IL-21、RORc、HLA-G的表达情况及其相关性,旨在为子痫前期针对性治疗提供新的想法和依据。
1 临床资料
1.1研究对象 选择2012年3月—2014年5月在镇江市妇幼保健院行剖宫产分娩的孕33~38周子痫前期孕妇20例作为子痫前期组,年龄25~29(28.5±2.2)岁。孕前子痫前期诊断参照《妇产科学》[6]标准:BP≥160/110 mmHg(1 mmHg=0.133 kPa);尿蛋白≥2.0 g/24 h或定性试验≥();血清肌酐>106 μmol/L,除非以前就已有升高;血小板<100×109L-1;毛细血管病性溶血(LDH升高);ALT或AST升高;持续性头痛或其他大脑或视觉障碍;持续性上腹痛。选择孕38周以上自愿要求行剖宫产正常产妇20例作为正常对照组,年龄25~28(27.9±3.0)岁。2组产妇均无高血压、心脏病、肾病、糖尿病、血小板减少等病史,无近期感染证据,未经生殖技术帮助,无免疫性疾病,未经免疫药物治疗,2组产妇年龄比较差异无统计学意义。
1.2标本的采集 待胎盘娩出后,于胎盘正中母体面避开钙化灶取1 cm×1 cm×1 cm大小的全层胎盘组织1块,经无菌生理盐水反复漂洗后置入无RNA酶的EP管中,保存于-80 ℃冰箱待PCR成批检测。
1.3检测方法 采用实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)技术检测2组胎盘组织中miRNA-21的相对表达量: ①Tiangen Biotech提取胎盘组织总RNA,按说明书操作。②逆转录合成cDNA,于-20 ℃保存。③PCR扩增:试剂盒(FP401)购自日本Toyobo公司,采用U6 RNA(一种小核RNA,参与前体RNA剪接体的构成)作为内参照。所用引物由试剂公司设计合成。荧光定量PCR条件设置:95 ℃预变性15 min,95 ℃变性15 s,60 ℃退火60 s,进行35个循环。采用PCR技术检测2组绒毛和蜕膜中目的基因IL-17、IL-21、RORc及HLA-G表达量:①Tiangen Biotech提取细胞总RNA,按说明书操作。②逆转录合成cDNA,于-20 ℃保存。③PCR扩增:采用ABI 7500 PCR 系统及SYBRgreen I染料法进行荧光定量PCR检测,采用β-actin作为内参照。所用引物由试剂公司设计合成,PCR条件设置:95 ℃ 10 min,95 ℃ 15 s,61 ℃ 1 min,共35个循环。

2 结 果
2.1胎盘组织中miRNA-21表达情况 子痫前期组胎盘中miRNA-21相对表达量为0.155±0.01,正常对照组为0.087±0.01,2组比较差异有统计学意义(t=4.360,P<0.01)。见图1。
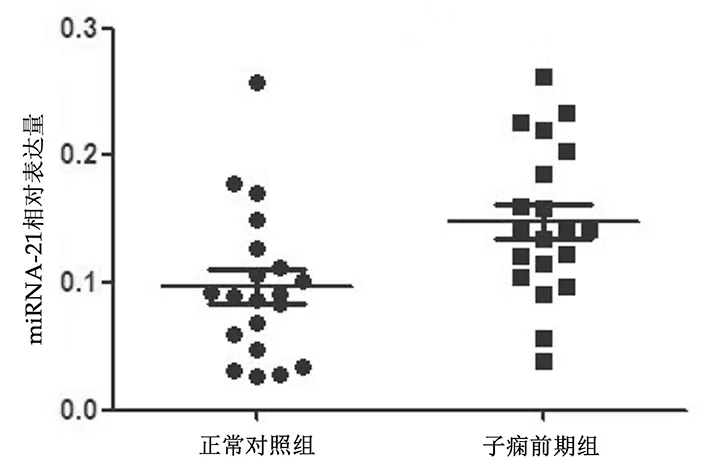
图1 2组胎盘组织中miRNA-21相对表达量散点图
2.2胎盘组织中IL-17、IL-21、RORc以及HLA-G表达情况 子痫前期组胎盘组织中IL-17和IL-21相对表达量均明显高于对照组(P均<0.01),RORc和HLA-G相对表达量均明显低于对照组(P均<0.05),见表1,2组各指标相对表达量散点图见图2~5。

表1 2组产妇胎盘组织中IL-17、IL-21、RORc以及HLA-G表达情况
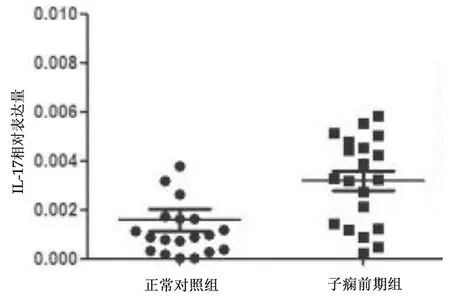
图2 2组胎盘组织中IL-17相对表达量散点图
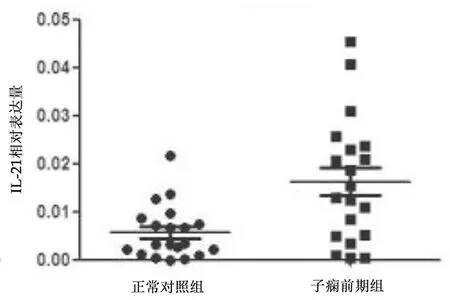
图3 2组胎盘组织中IL-21相对表达量散点图

图4 2组胎盘组织中RORc相对表达量散点图
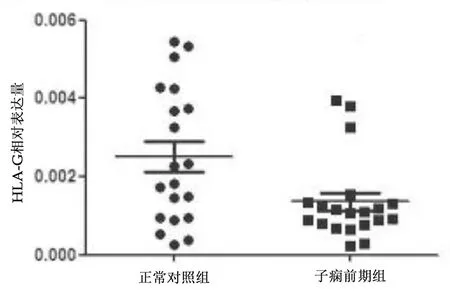
图5 2组胎盘组织中HLA-G相对表达量散点图
2.3miRNA-21、IL-17、IL-21、RORc及HLA-G表达的关系 2组产妇胎盘组织中IL-17、IL-21及miRNA-21表达均呈正相关(r=0.490 6,0.471 3,0.413 6,P<0.05),2组RORc和HLA-G表达均呈负相关(r=-0.380 9,-0.409 3,P<0.05)。
3 讨 论
子痫前期是正常孕妇在妊娠20周后出现,并伴随血管内皮发生功能障碍和血管痉挛的一类免疫系统疾病。子痫前期在发展中国家的发病率高达4%~18%,同时它也成为发展中国家造成死产以及早产儿死亡的第二大元凶[7]。目前已有文献报道Th17细胞参与了子痫前期的发生发展过程[8],也有文献提及miRNA家族可能促进子痫前期的发病[9],但这三者之间的联系以及子痫前期发病的确切机制尚未完全阐明。故本研究通过对miRNA-21以及Th17相关因子相对表达量的检测来探索三者间的关系。
miRNA家族是一类长约22个核苷酸的非编码RNA,通过与靶基因mRNA的3’端非翻译去相互作用,从而调控靶基因的表达,进而广泛地作用于生长发育、衰老凋亡、肿瘤发生、免疫应答等各种生物学过程[10]。本研究发现子痫前期组孕产妇的胎盘血中miRNA-21的相对表达量远远高于正常对照组,提示miRNA-21与子痫前期的发病成正相关关系,说明miRNA-21在子痫前期的发生发展中起到关键性的调控作用。
最近有研究表明,Th17细胞可以介导炎症反应、自身免疫性疾病、肿瘤和移植排斥等的发生发展,其可以通过产生IL-17、IL-6、IL-21和其他炎症递质来调节促炎反应过程[11]。另有报道称,除了Th1/Th2之间的平衡,Th17,Treg细胞之间的比例失衡也会导致子痫的发生[12]。本研究结果显示子痫前期组产妇的胎盘组织中IL-17和IL-21的相对表达量明显高于正常对照组,提示子痫前期产妇体内Th17细胞曾被激活,导致Th17,Treg细胞之间的比例失衡,IL-17和IL-21释放增加。
RORc1或RORc2属于RTK家族,是被广泛研究的非典型Wnt受体成员,和人类几种疾病息息相关。研究发现在小鼠体内RORc1或RORc2的缺失是致命的,将会导致骨骼、肺脏和心脏的发育缺陷[9]。HLA-G首次在母胎界面的滋养层细胞中被发现,在病毒性感染和几种自身免疫性疾病中也会特异性表达。有研究表明,HLA-G可以通过激活细胞毒性淋巴细胞从而防止角化细胞的破坏[13];而且其在胎盘滋养层细胞中高度表达,在孕期调节免疫耐受和继续妊娠方面发挥着重要的作用[8]。本研究发现子痫前期组产妇胎盘组织中RORc和HLA-G的相对表达量都低于正常对照组,表明子痫前期产妇体内调控RORc和HLA-G的基因的稳定性降低,产生基因沉默影响转录,导致RORc和HLA-G表达减少,从而导致了一系列子痫前期患者现有的表现如早产、胎儿生长受限、围生期胎儿死亡等。
综上所述,子痫前期的发病可能是激活了miRNA-21的过表达,促使Th17细胞激活,从而导致IL17和IL21分泌增加,引起全身免疫性炎症反应。同时可能由于miRNA-21在子痫前期患者胎盘组织中表达升高,从而使得RORc mRNA和HLA-G mRNA的稳定性降低,产生基因沉默影响转录,导致RORc和HLA-G表达减少,有待试验研究进一步证实。目前人们对于子痫前期的研究还处于起步阶段,深入研究子痫前期的生理、病理变化以及其发病机制,对日后子痫前期的早发现、早诊断、早治疗具有重大的理论和实际意义。
[1] Buke B,Topcu HO,Enqin-Ustun Y,et al. Comparison of serum maternal adiponectin concentrations in women with isolated intrauterine growth retardation and intrauterine growth retardation concomitant with preeclampsia[J]. Turkish-German Gynecological Association,2014,15(3):173-176
[2] Urquia ML,Glazier RH,Gaqnon AJ,et al. Disparities in pre-eclampsia and eclampsia among immigrant women giving birth in six industrialized countries[J]. BJOG,2014,121(12):1492-1500
[3] Schoenaker DA,Soedamah-Muthu SS,Mishra GD. The association between dietary factors and gestational hypertension and pre-eclampsia:a systematic review and meta-analysis of observational studies[J]. BMC Medicine,2014,12:157
[4] Johnson AC,Tremble SM,Chan SL,et al. Magnesium sulfate treatment reverses seizure susceptibility and decreases neuroinflammation in a rat model of severe preeclampsia[J]. PLoS One,2014,9(11):e113670
[5] Ye X,Zhang L,Wang H,et al. The role of IL-23/Th17 pathway in patients with primary immune thrombocytopenia[J]. PLoS One,2015,10(1):e0117704
[6] 乐杰. 妇产科学[M]. 北京:人民卫生出版社,1980:92-98
[7] ZohrehTavana,SaraHosseinmirzaei.ComparisonofMaternalSerumMagnesiumLevelinPre-eclampsiaandNormalPregnantWomen[J].IranRedCresMed,2013,15(12):e10394
[8]DorotaDarmochwal-KolarzandJanOlesacauk.ThecriticalroleofTh17cells,tregcellsandcostimulatorymoleculesinthedevelopmentofpre-eclampsia[J].DevelopmentalPeriodMedicine,2014,18(2):141-147
[9]BainbridqeTW,DeAlmeidaVI,Izrael-TomasevicA,etal.EvolutionarydivergenceinthecatalyticactivityoftheCAM-1,RORc1andRORc2kinasedomains[J].PLoSOne,2014,9(7):e102695
[10]GentileA,DiasLi,MattosRS,etal.MicroRNAsanddroughtresponsesinsugarcane[J].FrontPlantSci,2015,6:58
[11]GiuntiL,daRosM,VinciS,etal.Anti-miR21oligonucleotideenhanceschemosensitivityofT98Gcelllinetodoxorubicinbyinducingapoptosis[J].AmJCancerRes,2015,5(1):231-242
[12] 盛佳佳,刘雨生,吴莉,等. 子痫前期患者外周血中Th17、Treg细胞变化及意义[J]. 临床输血与检验,2013,15(1):7-10
[13]RizzoR,BortolottiD,BolzaniS,etal.HLA-Gmoleculesinautoimmunediseasesandinfections[J].FrontImmunol,2014,5:592
Expression of miRNA-21 and correlation factors associated with Th17 cells and analysis their relations in placenta of patients with preeclampsia
ZHU Li1, ZHU Huaying2, XU Lingdi2, CHEN Tingmei2, LIU Songping2
(1.Medical College of Jiangsu University, Zhenjiang 212000, Jiangsu, China; 2.The Fourth People’s Hospital of Jiangsu University/Zhenjiang Maternal and Child Care Hospital, Zhenjiang 212000, Jiangsu, China)
Objective It is to study the predictive value of IL-17, IL-21, RORc, HLA-G associated with Th17 cells and micro-ribonucleic acid-21(miRNA-21) in placenta on the pathogenesis of preeclampsia. Methods 20 pregnant women with preeclampsia with 33-37weeks’ gestation undergoing cesarean section were selected as preeclampsia group, 20 healthy pregnant women with more than 38 weeks’ gestation volunteered for cesarean section as normal control group. Expression of IL-17,IL-21,RORc ,HLA-G and miRNA-21 in placenta were measured by Polymerase Chain Reaction (PCR). Results The relative expressions of IL-17 and IL-21 in placenta were higher, while that of RORc and HLA-G were lower in preeclampsia group than those in normal control group (P<0.01 or <0.05).The relative expressions of IL-17, IL-21 and miRNA-21 in placenta in both groups were positively correlated,.the relative expressions of RORc and HLA-G in placenta were negatively correlated. Conclusion We found that the relative expressions of miRNA-21in placenta was more higher in preeclampsia group.Higher expression of miRNA-21 may make Th17 cells activated, then increased IL-17 and IL-21 secretion. At the same time ,higher expression of miRNA-21 may influence the RORc mRNA and HLA-G mRNA stability, then reduced the expression of RORc and HLA-G.
preeclampsia; miRNA-21; correlation factors associated with Th17 cells
朱丽,女,在读研究生,研究方向为影像医学与核医学。
朱华英,E-mail:zhuhuaying1@163.com
江苏省卫生厅重大项目(H201249)
10.3969/j.issn.1008-8849.2015.29.001
R0714.245
A
1008-8849(2015)29-3193-04
2015-05-10

