乙肝后肝硬化与糖耐量异常、胰岛素抵抗的相关性探讨
李洪焱,唐科江
(重庆市南川区人民医院,重庆 408400)
乙肝后肝硬化与糖耐量异常、胰岛素抵抗的相关性探讨
李洪焱,唐科江
(重庆市南川区人民医院,重庆 408400)
目的 探讨乙型肝炎后肝硬化患者与糖耐量异常及胰岛素抵抗的相关性。方法 选取35例乙型肝炎后肝硬化患者作为观察组,同时选取40例同期健康体检者作为对照组1,选取40例同期收治的2型糖尿病患者作为对照组2,比较3组患者糖耐量、胰岛素指标及不同Child-Pugh分级多项指标,探讨乙型肝炎后肝硬化患者与糖耐量异常及胰岛素抵抗的相关性。结果 ①肝硬化组血糖水平与2型糖尿病组具有统计学意义(P<0.05),但2组患者血糖高峰出现时间一致。肝硬化患者C肽分泌曲线基本正常,2型糖尿病患者C肽分泌曲线偏低。肝硬化组各时间点胰岛素敏感指标(ISI)明显高于2型糖尿病组(P<0.05)。②肝硬化组服糖后各个时段血糖水平均明显高于健康体检者(P<0.05),且各个时段血清胰岛素水平明显高于健康体检者(P<0.05)。③不同Child-Pugh分级肝硬化组患者空腹血糖FBG水平比较差异无统计学意义(P>0.05),B级患者餐后2h血糖(2hPG)、血清空腹胰岛素(FINS)水平均明显高于A级(P均<0.05),C级患者2hPG、FINS、胰岛素释放指数(IRI)及ISI水平均明显高于A级(P均<0.05),C级患者FINS水平明显高于B级(P<0.05)。结论 乙型肝炎后肝硬化患者往往存在糖耐量异常及胰岛素抵抗现象,临床定期进行糖耐量、胰岛素及C肽指标测定对制定相关治疗措施、预防肝源性糖尿病意义重大。
乙型肝炎;肝硬化;糖耐量异常;胰岛素抵抗
肝脏是葡萄糖代谢的重要器官,对调节机体血糖浓度起着重要作用。当肝脏发生病变时,往往可引起糖代谢异常,甚至出现糖耐量异常或糖尿病,这种继发于慢性肝实质损害而发生的糖尿病称为肝源性糖尿病。我国近年来各型肝炎、肝硬化和各种慢性肝病的发病率均较高,而上述原因引起的肝脏损害则增加了临床糖耐量异常和糖尿病人群[1]。因此,临床及时诊断和治疗原发病对于有效预防和控制糖耐量异常及胰岛素抵抗是十分必要的。本研究通过比较乙肝后肝硬化者与2型糖尿病、健康人群的糖代谢指标,旨在探讨乙肝后肝硬化与糖耐量异常、胰岛素抵抗之间的相关性,现报道如下。
1 临床资料
1.1 一般资料 选取我院收治的35例乙型肝炎后肝硬化患者作为观察组,同时选取40例同期体检健康者作为对照组1,选取40例同期收治的2型糖尿病患者作为对照组2。观察组病例均符合全国传染病、寄生虫病学术会议通过的乙肝后肝硬化临床诊断标准[2]。对照组2中2型糖尿病患者符合1999年WHO制定的2型糖尿病诊断标准[3]。均排除垂体、肾上腺、甲状腺等疾病引起的继发性糖代谢异常、肿瘤、免疫系统疾病、妊娠哺乳期、原发性高血压及冠心病史,观察组患者排除肝硬化前糖尿病史者。观察组35例患者中男21例,女14例;年龄37~68(48.7±6.3)岁;肝功能Child-Pugh分级[4]A级13例,B级18例,C级4例;肝硬化病程1~3(1.4±0.8)年。对照组1中40例健康体检者男24例,女16例;年龄34~71(47.5±5.8)岁。对照组2中40例2型糖尿病患者男27例,女13例;年龄32~68(48.1±6.1)岁;病程2~17(5.7±1.4)年。3组年龄、性别比较差异无统计学意义(P均>0.05),具有可比性。
1.2 研究方法 3组受检者均进行口服葡萄糖耐量试验(OGTT),采用放射免疫测定血清胰岛素及C肽水平,测定空腹血糖(FBG)、餐后2 h血糖(2hPG)、血清空腹胰岛素(FINS)水平,计算胰岛素敏感指数(ISI)及释放指数(IRI)[5]。

2 结 果
2.1 观察组与对照组2检测结果比较 观察组血糖水平与对照组2比较差异具有统计学意义(P<0.05),但2组患者血糖高峰出现时间一致。观察组FBG水平基本接近正常或稍偏高,服糖后各时间点血糖水平均明显低于对照组2(P均<0.05)。观察组C肽分泌曲线基本正常,对照组2患者C肽分泌曲线偏低,高峰出现较前者晚。观察组各时间点ISI明显高于对照组2(P均<0.05)。见表1。
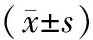
表1 观察组与对照组2检测结果比较
2.2 观察组与对照组1检测结果比较 观察组FBG、FINS及C肽水平与对照组1比较差异无统计学意义(P均>0.05),且血糖、胰岛素及C肽分泌高峰表现一致。但观察组服糖后各个时段血糖水平均明显高于对照组1(P均<0.05),且各个时段血清胰岛素水平均明显高于对照组1(P均<0.05)。观察组均存在不同程度高胰岛素血症,胰岛素敏感性明显较对照组差。见表2。
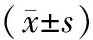
表2 观察组与对照组1检测结果比较
2.3 不同Child-Pugh分级观察组患者各项指标比较 观察组不同Child-Pugh分级患者FBG水平比较差异无统计学意义(P>0.05),B级患者2hPG、FINS水平均明显高于A级(P均<0.05),C级患者2hPG、FINS、IRI及ISI水平均明显高于A级(P均<0.05),C级患者FINS水平明显高于B级(P<0.05)。见表3。
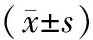
表3 观察组不同Child-Pugh分级患者各项指标比较
注:①与A级比较,P<0.05;②与B级比较,P<0.05;③与C级比较,P<0.05。
3 讨 论
肝脏是维持血糖动态平衡的主要器官,也是胰岛素、胰高血糖素等激素作用的靶器官和降解转化的场所,所以肝功能异常可干扰葡萄糖的产生或葡萄糖的利用机制,引起糖类代谢障碍。肝病患者空腹血糖浓度降低或增高,视肝病的性质、程度及期限而异。一般临床上低血糖发生在肝损害(病毒性或中毒性肝炎)、尤以病情加重或伴有肝肿瘤患者,肝硬化患者则常见高血糖现象。据有关报道,肝硬化病例中12%~32%有糖尿病,肝硬化患者葡萄糖耐量轻度减退者的发生率可高达80%。通常肝硬化可早于糖尿病或与糖尿病同时出现[6]。当肝细胞损伤尤其为肝炎后肝硬化时,肝内糖代谢有关酶类的特征性变化是:活性增高的酶有葡萄糖-6-磷酸脱氢酶、磷酸甘油醛脱氢酶、丙酮酸磷酸激酶、乳酸脱氢酶等;活性降低的酶有醛缩酶、磷酸甘油脱氢酶、异柠檬酸脱氢酶、琥珀酸脱氢酶、苹果酸脱氢酶等。由上述酶谱变化可以看出:肝细胞损伤时糖代谢变化的特点是磷酸戊糖途径及糖酵解途径相对增强,严重肝损伤时糖有氧氧化及三羧酸循环运转不佳,血中丙酮酸量可显著上升[7]。
本研究结果显示,乙肝后肝硬化患者可出现明显的糖代谢紊乱,主要可表现为空腹葡萄糖损伤及葡萄糖耐量降低,同时肝硬化患者存在不同程度的高胰岛素血症,胰岛素分泌水平也较正常人明显增加,但胰岛素敏感性却明显降低,表明乙肝后肝硬化患者存在胰岛素抵抗现象。许多研究也证实慢性肝病患者均存在一定的胰岛素抵抗。Sibley等[8]对24例肝硬化患者进行高胰岛素正糖钳夹试验,发现所有病例都存在严重胰岛素抵抗和肝糖输出增加。造成肝病患者胰岛素抵抗的原因尚不清楚,既往研究认为与肝细胞数目减少,肝细胞、肌肉和脂肪细胞膜上的胰岛素受体数目减少、亲和力下降,以及肝病患者血中胰高血糖素、生长激素、糖皮质激素和游离脂肪酸增多有关[9]。此外,门体分流和肝脏内血流动力学紊乱,使胰岛分泌的胰岛素不易达到肝小叶中央区域与肝细胞表面的胰岛素受体结合。近年来的研究证实,炎症与糖尿病关系密切,低度炎症存在于糖尿病患者体内,既是糖尿病的重要发病机制之一,也是糖尿病引发的病理生理改变[10]。在肝病状态下,肝细胞的炎症损伤促使其产生C反应蛋白(CRP)、白细胞介素-1(IL-1)、IL-6、肿瘤坏死因子-α(TNF-α)等炎症因子并释放入血,这些炎症因子可使多种丝/苏氨酸激酶激活,造成胰岛素受体底物1(IRS1)及胰岛素受体底物2(IRS2)的丝氨酸磷酸化增加而酪氨酸磷酸化减少,从而使胰岛素受体后信号传导通路受阻,胰岛素作用减弱,出现肝脏及全身胰岛素抵抗[11]。此外,最近的动物肝组织研究显示,肝病模型动物肝组织内葡萄糖激酶、葡萄糖转运因子-2表达减少,可造成肝脏对胰岛素的应答下降,从而降低胰岛素敏感性[12]。
我国由病毒性肝炎引起的肝硬化十分常见,当肝功能失去代偿后,肝脏可发生不可逆转的器质性改变,而糖代谢紊乱也不可避免。本研究结果证实,肝功能损害程度越严重,其糖代谢紊乱水平也就越明显。表3中按照Child-Pugh分级对肝硬化患者的糖代谢指标进行了组间比较,结果表明,肝功能损害越严重,高胰岛素血症越明显,且胰岛素敏感性越差。在肝损害早期,由于胰岛素分泌增加和胰岛素清除减少,可出现高胰岛素血症,此时胰岛素水平可较正常人群高5~6倍[13]。当胰岛素抵抗持续存在,胰岛β细胞功能长期代偿性增加而导致其功能下降,即可出现肝源性糖尿病。此外,在慢性病毒性肝炎情况下,肝炎病毒及其免疫产物或毒性产物也可间接损害胰岛β细胞。肝炎病毒可出现肝外感染,并可能造成胰岛炎,加重胰岛β细胞的破坏[14]。因此,在临床上对肝硬化患者的糖代谢异常必须给予高度重视,早期出现的空腹及餐后高胰岛素血症往往预示着糖耐量异常及胰岛素抵抗的产生,持续发展则可能成为肝源性糖尿病。同时,我们不仅要注重血糖水平,还应定期进行胰岛素及C肽指标测定,若患者存在高胰岛素血症、葡萄糖耐量异常则应注意改善肝功能,注重饮食及运动治疗;当发展为肝源性糖尿病时,则应及早给予短效胰岛素治疗,辅助增强胰岛素增敏剂,这样才能达到较佳的治疗效果,以阻断肝脏损坏对胰岛素分泌及胰岛β细胞的破坏。
综上所述,乙肝后肝硬化患者往往存在糖耐量异常及胰岛素抵抗现象,若不能及时给予预防和治疗,则很可能发展成为肝源性糖尿病。因此,对于病毒性肝炎的预防和肝功能代偿期的治疗是降低肝源性糖尿病发生率的关键。
[1] 张忆敬,卢颖,李聪龙. 重组人胰岛素治疗对肝硬化并发肝源性糖尿病的双重效应[J]. 中国实用医药,2014,15(3):149-150
[2] 1995年5月北京第5次全国传染病、寄生虫病学术会议讨论修订.病毒性肝炎防治方案(试行)[J]. 中华传染病杂志,1995,13(4):241-243
[3] 鲍顺忠. 糖尿病诊断和治疗[M]. 上海:上海科学技术文献出版社,1999:72-73
[4] 丁义涛. 肝功能衰竭现代治疗学[M]. 南京:江苏科学技术出版社,2008:64-68
[5] 郎江明. 糖尿病强化治疗学——智能胰岛素泵动态血糖监测临床研究[M]. 广州:广东科技出版社,2011:227-229
[6] 钟辉. 恩替卡韦治疗乙肝肝硬化合并肝源性糖尿病的临床疗效[J]. 中国现代药物应用,2014,8(3):20-21
[7] 罗欣. 肝硬化严重程度与甲状腺素水平、肝纤维化指标及血清糖链抗原125相关性分析[J]. 临床内科杂志,2014,15(2):95-98
[8] Sibley SD,Palmer JP,Hirseh IB,et al. Visceral obesity,hepatic lipase activity,and dyslipidemia in type 1 diabetes[J]. J Clin Endoerinol Metab,2003,88(3):3379-3384
[9] 卓苏铵,韦峭峰. 综合疗法治疗肝源性糖尿病疗效观察[J]. 现代中西医结合杂志,2013,22(31):3509-3510
[10] 马燕妮. 恩替卡韦治疗乙型肝炎肝硬化合并肝源性糖尿病的疗效分析[J]. 当代医学,2014,20(7):38-39
[11] 倪正平,陆玲玲,袁佳平,等. 肝癌及乙肝患者近5年空腹高血糖发病状况对照研究[J]. 医学理论与实践,2014,27(3):298-300
[12] 陈杰,张玉林,张宏伟,等. 2型糖尿病对肝硬化合并自发性细菌性腹膜炎患者血清细胞因子水平的影响[J]. 解放军医药杂志,2014,26(1):43-45
[13] 刘园园,郭晓林,金晶兰,等. 激素联合聚乙二醇干扰素α-2b治疗肾病综合征合并失代偿期丙型肝炎肝硬化1例报告[J]. 临床肝胆病杂志,2014,30(1):72-73
[14] 李寒春,马双余,李宗芳,等. 肝硬化门脉高压症患者胰腺内分泌细胞的变化及其对糖代谢的影响[J]. 西部医学,2013,25(12):1808-1813
唐科江,E-mail:tttkkj@163.com
10.3969/j.issn.1008-8849.2015.21.017
R657.31
B
1008-8849(2015)21-2329-03
2014-08-02

