大肠癌局部微环境中细胞免疫功能状况与预后的关系
冯国光,陈 峰,丁新德,朱松明,高 铭,顾志相
(上海交通大学医学院附属新华医院崇明分院,上海 202150)
大肠癌局部微环境中细胞免疫功能状况与预后的关系
冯国光,陈 峰,丁新德,朱松明,高 铭,顾志相
(上海交通大学医学院附属新华医院崇明分院,上海 202150)

目的 探讨大肠癌根治术后患者细胞免疫功能状况与预后的关系。方法 取146例大肠癌患者手术切除标本石蜡块。采用免疫组织化学染色技术检测肿瘤、瘤旁1 cm和瘤旁8~10 cm肠壁组织(正常肠壁组织)中CD3+、CD4+、CD8+、B细胞、自然杀伤细胞(NK细胞)、树突状细胞(DC细胞)和转录因子叉头框蛋白P3+调节性T细胞(Foxp3+Tregs)水平,采用Kaplan-Meier和Cox回归分析评估这些指标对预后的影响。结果 肿瘤组织中CD3+、CD4+、CD8+、NK细胞、DC细胞和Foxp3+Tregs表达量显著高于瘤旁1 cm组织及正常肠壁组织(P均<0.05); 肿瘤组织中CD8+、NK细胞和DC细胞高表达组T3、T4期和区域淋巴结转移例数均显著低于低表达组(P均<0.05);肿瘤组织中Foxp3+Tregs高表达组高TNM分期、术后肿瘤复发转移和死亡例数均显著高于低表达组(P均<0.05);肿瘤组织内Foxp3+Tregs高表达与TNM高分期和差的预后有显著关系(P均<0.05),并且是术后的一个独立预后因素。结论 肿瘤组织中Foxp3+Tregs表达量与大肠癌根治术后患者预后密切相关,肿瘤组织中Foxp3+Tregs高表达是大肠癌根治术患者预后的一个独立危险因素。
大肠癌;细胞免疫;Foxp3+Tregs;预后
正常情况下,在肿瘤形成前机体免疫系统可通过细胞免疫特异性杀灭引发肿瘤的突变细胞,而免疫系统缺陷、宿主对肿瘤抗原缺乏反应是恶性肿瘤发生和发展的重要因素。大肠癌是临床常见肿瘤,多采取根治术治疗,但根治术后复发和转移是造成患者死亡的重要原因。恶性肿瘤局部免疫微环境与预后有着密切的关系,其中肿瘤浸润调节性T细胞(tumor-infiltrating regulatory T cells,Tregs)可能起着重要作用。本研究探讨了大肠癌局部免疫微环境与预后的关系。
1 临床资料
1.1 一般资料 收集2007年1月—2008年12月在上海新华医院崇明分院经病理证实的146例首次大肠癌根治手术患者标本,其中男79例,女67例;年龄42~81岁,平均65岁。患者资料完整,无自身免疫性疾病史,无化疗、放疗、生物及免疫治疗史。所有手术基本由同一个手术团队完成,保证手术质量的一致性。肿瘤部位:结肠94例(盲肠12例,升结肠及肝曲18例,横结肠例9例,降结肠及脾曲13例,乙结肠42例),直肠52例。肿瘤直径1.5~12 cm,平均2.7 cm。手术方式:右半结肠切除30例,横结肠切除9例,左半结肠切除13例,乙状结肠切除42例,直肠经腹切除47例,经腹会阴联合切除5例。组织病理学分类、肿瘤浸润深度、区域淋巴结转移情况、TNM分期见表1。生存期从手术日计算,终止日期为死亡日或末次随访日,所有病例随访截止日期为2013年12月31日。随访结果:局部复发8例(5.5%),远处转移28例(19.2%),与术后肿瘤复发转移相关的死亡36例,总的5年生存率为75.3%(110/146)。
1.2 研究方法 分别用不同的单克隆抗体对CD3+、CD4+、CD8+、B细胞、自然杀伤细胞(NK细胞)、树突状细胞(DC细胞)和转录因子叉头框蛋白P3+Tregs(Foxp3+Tregs)进行免疫组化染色,采用免疫组织化学染色技术检测各种免疫细胞在大肠癌患者肿瘤、瘤旁1 cm和瘤旁8~10 cm肠壁组织(正常肠壁组织)中的表达量,分析各种免疫细胞间的关系及与患者临床病理和预后的关系。免疫细胞参数变量按中位数分为高表达组和低表达组。鼠抗人CD3(MAB-0030,克隆号:PS1)、鼠抗人CD4(MAB-0251,克隆号:4B12)、兔抗人CD8(RMA-0514,克隆号:SP16)、B细胞鼠抗人CD20 (MAB-0020,克隆号:L26)、NK细胞鼠抗人CD57(MAB-0257,克隆号:NK1)、DC细胞兔抗人S-100(RAB-0150) 来自Maixin-Bio(迈新生物)。Foxp3+Treg抗体:affinity purified anti human Foxp3(目录号:85-14-4776-80,克隆号:PCH101)来自eBioscience公司(Foxp3是人Treg特异性抗体),二抗均来自Leica的标准试剂——Leica二抗套装试剂,包括抗原修复液、脱蜡溶液、洗涤溶液等。采用Leica公司的全自动免疫组化染色一体机,免疫组化的所有步骤包括烤片、脱蜡、抗原修复、阻断、标记一炕、标记二抗、显色直到复染都由Bond-Max自动完成。

表1 146例大肠癌病理组织学分类、肿瘤浸润深度、区域淋巴结转移及TNM分期 例
1.3 免疫细胞计数 在400倍显微镜下观察阳性细胞,判定标准为细胞膜或细胞核呈红色或棕色颗粒。利用电脑图像采集系统,随机选取5个高倍视野拍照,再用图像分析软件(NIH Image 1.46 bundled with 64-bit Java)计算阳性细胞数。由2位高年资病理科医生双盲交叉读片,取平均值。
1.4 统计学方法 采用SPSS 12.0统计软件包进行数据处理,用t检验或四格表2检验进行组间数据比较;用Kaplan-Meier做各免疫参数变量与预后的关系分析;用Cox回归模型做单因素和多因素与预后关系分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各种免疫细胞在大肠癌局部微环境中的分布 大肠癌肿瘤组织中CD3+、CD4+、CD8+、NK细胞、DC细胞和Foxp3+Tregs表达量显著高于瘤旁1 cm组织及正常大肠壁组织(P均<0.05),而瘤旁1 cm组织与正常大肠壁组织间表达量比较差异均无统计学意义(P均>0.05)。肿瘤组织中B细胞表达量与瘤旁1 cm组织及正常大肠壁组织表达量比较差异均无统计学意义(P均>0.05)。见表2。

表2 大肠癌局部微环境各组织中免疫细胞检测结果
注:①与肿瘤组织比较,P<0.05。
2.2 大肠癌肿瘤组织中CD8+、NK细胞和DC细胞与临床病理特点的关系 大肠癌肿瘤组织中CD8+、NK细胞和DC细胞高表达组的T3、T4期和区域淋巴结转移例数均显著低于低表达组(P均<0.05),但与患者术后生存情况无直接相关性。见表3。
2.3 大肠癌局部微环境各组织中Foxp3+Tregs细胞与临床病理特点的关系 肿瘤组织中Foxp3+Tregs高表达组TNM分期、术后肿瘤复发转移和死亡例数均显著高于低表达组(P均<0.05);肿瘤旁1 cm 和正常肠壁组织中Foxp3+Tregs表达与患者临床病理特点无相关性,见表4。
2.4 大肠癌肿瘤组织中Foxp3+Tregs表达与预后的关系对患者的年龄、性别、肿瘤大小、肿瘤分化程度、TNM分期以及肿瘤局部各免疫参数做Cox单因素生存分析,结果显示肿瘤组织中Foxp3+Tregs高表达与TNM高分期和差预后显著相关(P均<0.05),癌旁1 cm和正常肠壁组织内各种免疫细胞表达量与大肠癌预后无显著相关性,见表5。多因素分析亦显示肿瘤组织中Foxp3+Tregs表达差异和TNM分期高低是大肠癌患者根治术后独立预后因素,见表6。

表3 大肠癌肿瘤组织中CD8+、NK细胞和DC细胞与临床病理特点的关系 例
注:①与低表达组比较,P<0.05。
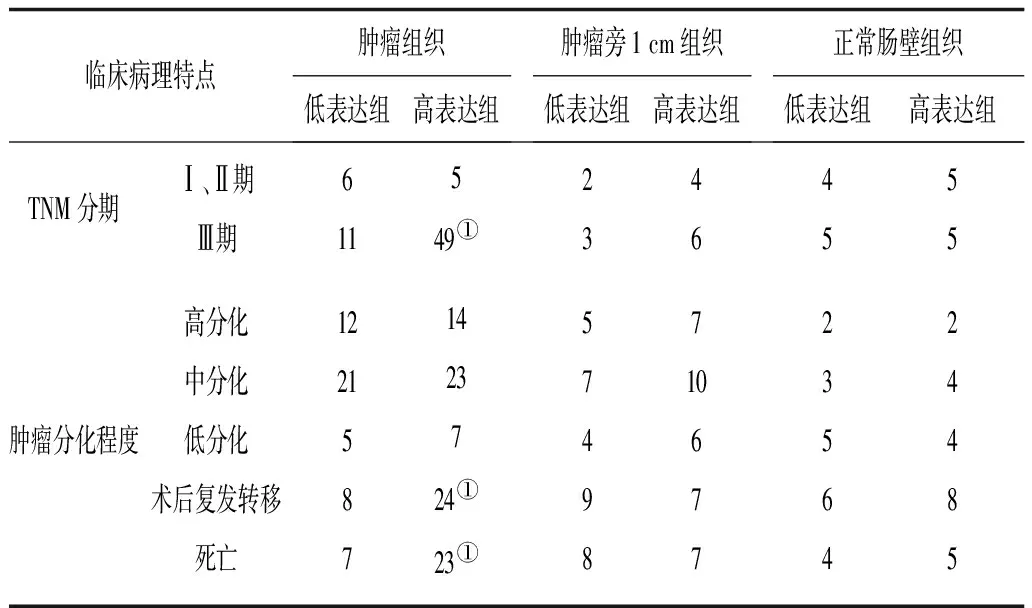
表4 大肠癌局部微环境各组织中Foxp3+Tregs细胞与临床病理特点的关系 例
注:①与肿瘤组织组中低表达组比较,P<0.05。
3 讨 论
恶性肿瘤的发生、发展和术后局部复发、远处转移与机体免疫功能低下、肿瘤细胞逃逸了机体的免疫监控有重要关系。而众多免疫细胞在肿瘤局部聚集反映了全身免疫系统对局部肿瘤的免疫应答。浸润在肿瘤周围的淋巴细胞不仅有效应性CD8+T细胞或CD4+T细胞,而且还有大量的Tregs,主要是CD4+、CD25+T细胞。通常认为肿瘤组织内Tregs异常增高有以下3种机制:①肿瘤相关抗原(TAAs)的刺激引起Tregs的活化、增殖;②肿瘤细胞分泌的趋化因子诱导Tregs聚集到肿瘤局部;③一些细胞因子的分泌和诱导。因此Tregs在肿瘤局部集聚是其发挥免疫抑制作用的基础,而随着抑制功能的发挥又进一步促进了Tregs的聚集。
本研究结果显示,大肠癌肿瘤组织中CD8+、NK细胞和DC细胞表达量与肿瘤浸润深度和区域淋巴结转移呈负相关,但是与患者预后无显著相关性,提示它们具有降低肿瘤浸润深度及减少淋巴结转移作用。其机制在于:首先恶性肿瘤转移的潜在能力在于克隆大量异常蛋白,这些异常蛋白有助于转移,但这些异常蛋白作为肿瘤相关抗原容易被免疫微环境内原位免疫反应破坏;其次高密度的肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs)通常意味着一个健康的免疫系统。在淋巴结内发生的免疫反应也可能发挥应有的功能,对抗肿瘤细胞并将其排入淋巴结内,而淋巴结内转移灶的肿瘤负荷小于原发灶。因此,转移灶更容易受到免疫反应完全破坏[1]。既往的研究认为,肿瘤局部TILs高浸润预示着良好的预后[2-3],但近年来随着对TILs深入研究,尤其是发现大量具有免疫抑制和调节功能的Treg后,人们对TILs在肿瘤微环境的作用有了新的认识。

表5 Cox单因素生存分析
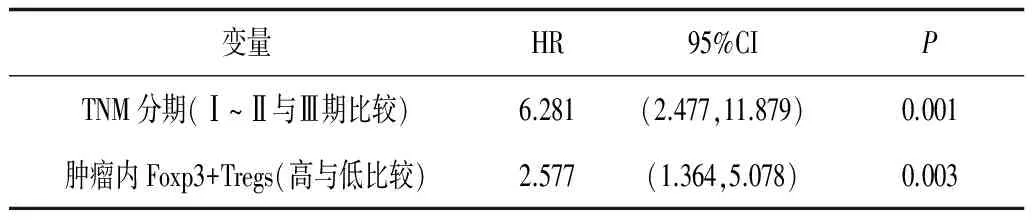
表6 Cox多因素生存分析
Kim等[4]认为,大肠癌肿瘤组织中Foxp3的表达与患者疾病的进展相关,而不是Tregs;但是大肠癌Foxp3表达与临床相关性还没有获得详细的评估。以往对一些实体肿瘤包括胰腺癌、肝癌的研究发现,高密度Foxp3+Tregs浸润患者预后差[5-6]。本研究显示,大肠癌肿瘤组织中Foxp3+Tregs表达量较正常肠壁组织显著增多,它反映了在肿瘤位点,宿主与肿瘤之间的免疫状况改变,而Foxp3+Tregs高表达者TNM分期较晚,预后也明显差于低表达者,与文献[7-11]报道的结果相同。
Xu等[10]对90例结肠腺癌的研究结果提示,Foxp3阳性癌细胞的出现与更差的预后相关,认为癌巢中出现Tregs是结肠癌总生存率的一个独立危险因素,而Foxp3阳性癌细胞也可能是影响预后的一个危险因素。但是也有研究认为Foxp3+Tregs的绝对数量和大肠癌患者预后之间无显著相关性[5]。甚至有研究认为,高频率的Foxp3+Tregs事实上可能与一个良好的而不是糟糕的预后相关[12]。本研究发现,肿瘤组织中Foxp3+Tregs表达量是大肠癌患者根治术后的一个独立预后因素,与Grimmig等[11]观点相同。通常有效的抗肿瘤免疫反应能抑制肿瘤细胞的潜在侵袭性,具有免疫抑制功能的Foxp3+Tregs则可能放任肿瘤侵袭转移,这或许就是肿瘤内Foxp3+Tregs高表达者根治术后易发生复发转移和预后差的原因。笔者认为Foxp3+Tregs主导了不良的免疫环境,在肿瘤进展时抵消了抗肿瘤的免疫反应。此外,肿瘤细胞本身的Foxp3 表达也可能使它们逃避效应T细胞的反应,导致肿瘤生长发展[4],因而对患者预后造成不良影响。Foxp3+Tregs作用机制主要是通过抑制效应T细胞的增殖和活化,导致免疫抑制细胞因子如IL-10和TGF-β分泌到肿瘤微环境[11],抑制CD8+T细胞和NK细胞对肿瘤的杀伤作用[13],引起DC细胞的凋亡[14]等途径影响效应T细胞对肿瘤的免疫应答。
本研究结果提示,大肠癌组织内Foxp3+Tregs的表达状况是大肠癌患者的独立预后因素,为临床提供了一条极具价值的思路:①术后肿瘤组织免疫组化检测Foxp3+Tregs可辅助判断大肠癌根治术后患者的预后。②通过利用和激发机体的免疫反应来对抗、抑制和杀灭肿瘤细胞(即大肠癌的免疫治疗)以改善患者的预后。目前对于肿瘤的免疫治疗探索动物实验居多,临床研究正在加速开展。近年来在美国,树突状细胞治疗性疫苗在恶性淋巴瘤、前列腺癌、胃癌等多个肿瘤的治疗研究已进入最后的临床试验。在我国,大肠癌树突状细胞治疗性疫苗已进入二期临床研究。但是如何精确调控患者机体的免疫功能达到最大限度的治疗效果,而又不会增加患者自身免疫性疾病的风险,需要对Treg这类T淋巴细胞亚群的结构、功能、调控机制做进一步深入研究。
[1] Lee HE,Chae SW,Lee YJ,et al. Prognostic implications of type and density of tumour-infiltrating lymphocytes in gastric cancer[J]. Br J Cancer,2008,99(10):1704-1711
[2] Zou W. Regulatory T cells, tumour immunity and immunotherapy[J]. Nat Rev Immunol,2006,6(4):295-307
[3] Wada Y,Nakashima O,Kutami R,et al. Clinicopathological study on hepatocellular carcinoma with lymphocytic infiltration[J]. Hepatology,1998,27(2):407-414
[4] Kim M,Grimming T,Grimm M,et al. Expression of Foxp3 in colorectal cancer but not in Treg cells correlates with disease progression in patients with colorectal cancer[J]. PLoS One,2013,8(1):e53630
[5] Hiraoka N,Onozato K,Kosuge T,et al. Prevalence of FOXP3+ regulatory T cells increases during the progression of pancreatic ductal adenocarcinoma and its premalignant lesions[J]. Clin Cancer Res,2006,12(18):5423-5434
[6] Gao Q,Qiu SJ,Fan J,et al. Intratumoral balance of regulatory and cytotoxic T cells is associated with prognosis of hepatocellular carcinoma after resection[J]. J Clin Oncol,2007,25(18):2586-2593
[7] Sinicrope FA,Rego RL,Ansell SM,et al. Intraepithelial effector (CD3+)/regulatory (Foxp3+) T-cell ratio predicts a clinical outcome of human colon arcinoma[J]. Gastroenterology,2009,137(4):1270-1279
[8] Chaput N,Louafi S,Bardier A,et al. Identification of CD8+CD25+Foxp3+suppressive T cells in colorectal cancer tissue[J]. Gut, 2009,58(4):520-529
[9] Gai XD,Song Y,Li C,et al. Potential role of plasmacytoid dendritic cells for FOXP3(+) regulatory T cell development in human colorectal cancer and tumor draining lymph node[J]. Pathol Res Pract,2013,209(12):774-778
[10] Xu W,Liu H,Song J,et al. The appearance of Tregs in cancer nest is a promising independent risk factor in colon cancer[J]. J Cancer Res Clin Oncol,2013,139(11):1845-1852
[11] Grimmig T,Kim M,Germer CT,et al. The role of FOXP3 in disease progression in colorectal cancer patients[J]. Oncoimmunology,2013,2(6):e24521
[12] Salama P, Phillips M,Grieu F,et al. Tumor-infiltrating FOXP3+ T regulatory cells show strong prognostic significance in colorectal cancer[J]. J Clin Oncol, 2009,27(2):186-192
[13] Strauss L,Bergmann C,Szczepanski M,et al. A unique subset of CD4+CD25highFoxp3+ T cells secreting interleukin-10 and transforming growth factor-beta1 mediates suppression in the tumor microenvironment[J]. Clin Cancer Res,2007,13(15/1):4345-4354
[14] Ji HB,Liao G,Faubion WA,et al. Cutting edge:the natural ligand for glucocorticoid-induced TNF receptor-related protein abrogates regulatory T cell suppression[J]. J Immunol,2004,172(10):5823-5827
The relationship between the status of cellular immune function in local microenvironment and prognosis in patients with colorectal cancer
FENG Guoguang, CHEN Feng, DING Xinde, ZHU Songming, GAO Ming, GU Zhixiang
(Chongming Branch of Xin Hua Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 202150, China)
Objective It is to approach the relationship between the status of cellular immune function in local microenvironment and prognosis in patients with colorectal cancer. Methods Paraffin blocks of operation resection of colorectal cancer were obtained from 146 patients. The levels of CD3+, CD4+, CD8+, B cells, natural kill cells (NK), dendritic cells (DC) and the transcription factor forkhead box protein P3+ regulatory T cells (Foxp3+Tregs) in the tissues of tumor and the intestine wall adjacent to tumor tissues of 1 cm and 8 to 10 cm were detected by immunohistochemistry staining technique to evaluate the relationship on prognostic effects by Kaplan-Meier and Cox regression analysis. Results The intratumoral CD3+, CD4+, CD8+, NK cells, DC cells and Foxp3+ Tregs counts were significantly higher than those in peritumoral 1 cm tissue and normal intestinal tissue (allP<0.05); The cases of T3, T4stage and regional lymph node metastasis in the intratumoral CD8+, NK and DC cells high counts group were significantly lower than those in the intratumoral CD8+, NK and DC cells low counts group (allP<0.05); the cases of T3, T4stage, recurrence and metastasis of tumor and deaths after operation in the intratumoral Foxp3+ Tregs high counts group were significantly higher than those in the intratumoral Foxp3+ Tregs low counts group (all P<0.05); the increased intratumoral Foxp3+ Tregs counts were associated with higher TNM stage and worse prognosis and was an independent prognostic factor for overall survival (allP< 0.05). Conclusion The intratumoral Foxp3+ Tregs counts are closely associated with the prognosis in patients with colorectal cancer after radical resection. The higher intratumoral Foxp3+ Tregs counts is an independent prognostic risk factor in patients with colorectal cancer after radical resection.
colorectal cancer; cellular immunity; Foxp3+ Tregs; prognosis
冯国光,男,主任医师,研究方向为大肠癌的防治。
10.3969/j.issn.1008-8849.2015.21.007
R0735.34
A
1008-8849(2015)21-2299-04
2015-02-28

