重症肌无力、糖尿病、Graves病、胸腺增生共存1例报告☆
郭叶群陈云玉陈丹霞董大伟杨万勇张玉生
·病例报告·
重症肌无力、糖尿病、Graves病、胸腺增生共存1例报告☆
郭叶群*陈云玉*陈丹霞*董大伟*杨万勇*张玉生*
重症肌无力 糖尿病 Graves病 胸腺增生
重症肌无力(myasthenia gravis,MG)是一种神经—肌肉接头处传递功能障碍的获得性自身免疫病,可伴Graves病、甲状腺炎、胸腺瘤/胸腺增生、系统性红斑狼疮、类风湿关节炎和天疱疮等其他自身免疫病,但MG同时合并2种或以上自身免疫病临床较少见。本文报道1例罕见MG患者合并3种自身免疫病(1型糖尿病、Graves病和胸腺增生),并进行文献复习,旨在引起对自身免疫病多病共存的重视。
1 资料
患者女,32岁,未婚。因“眼睑下垂、四肢无力23 d,构音不清、吞咽困难1 d”,于2014年3月5日入院。患者于2014年2月10日无明显诱因出现右眼睑下垂,4 d之后双眼睑下垂伴复视。2月21日四肢对称性无力。3月4日病情加重,不能梳头,平地行走不足100 m,构音不清,吞咽困难,饮水呛咳,病情呈波动性,劳累后加重,休息后缓解,晨轻暮重。3月5日到我院急诊科就诊,以“MG?”收入神经内科住院。起病来,患者神志清楚,无胸闷、气促、心悸、肢体麻木等,无发热,大小便正常,体重无明显改变。既往史:2007年因多饮、多尿、多食数月后神志不清在外院住院诊断为“1型糖尿病并酮症酸中毒”,经降糖等治疗后恢复良好,后一直用胰岛素降糖(门冬胰岛素早8~10 U,中12~15 U,晚12~15 U,睡前重组甘精胰岛素14~18 U),血糖控制尚可。2012年因焦躁易怒、怕热多汗、颈部变粗等在外院诊断为“Graves病”,不规律服用“丙硫氧嘧啶”。否认肝炎、结核、系统性红斑狼疮等病史。否认外伤、手术及输血史。患者外婆有“糖尿病”;母亲有“Graves病”;父亲有“高血压病”。有1弟弟,体健。入院体检:体温:37.2°C,脉搏:76次/min,呼吸16次/min,血压132/86 mm Hg。发育正常,营养中等。皮肤、粘膜、淋巴结均无异常。双眼球轻度突出。双侧甲状腺对称性II°肿大(见图1,A、B),质软,无结节,可闻及吹风样血管杂音。心、肺、腹查体无异常。神经系统体检:神清,精神和智能正常。双侧眼裂小(左3 mm,右6 mm)。双眼球内收正常,外展及向上、下均明显受限,无眼震。双瞳等大等圆,直径约4 mm,光反射灵敏。双侧咬肌肌力差。双额纹和鼻唇沟对称,双眼闭目稍差。构音不清,悬雍垂居中,双软腭运动差,咽部感觉正常,咽反射减弱。余脑神经无异常。四肢肌肉无萎缩或假性肥大,肌力4级。四肢肌张力、深浅感觉及腱反射均正常。病理征和脑膜刺激征阴性。
辅助检查:三大常规、肝肾功能、电解质、血脂、心肌酶谱均正常。血糖:空腹8.0 mmol/L,餐后2 h 11.8 mmol/L。糖化血红蛋白:6.9%(正常值:4.0%~6.1%)。血清C肽:空腹、餐后0.5 h、1 h、2 h及3 h分别为0.11 ng/mL、0.08 ng/ mL、0.08 ng/mL、0.06 ng/mL、小于0.05 ng/mL(空腹正常值:0.81~3.85 ng/mL)。肝炎病毒全套、风湿十二项、类风湿三项、梅毒抗体、人类免疫缺陷病毒抗体、肿瘤五项均阴性。红细胞沉降率、免疫球蛋白IgG、IgA、IgM和补体C3、补体C4均正常。甲状腺功能:游离三碘甲状腺原氨酸15.8 pmol/L(正常值:3.5~6.5 pmol/L),游离甲状腺素38.0 pmol/L(正常值:10.5~24.6 pmol/L),促甲状腺素0.01 mIU/ L(正常值:0.55~4.78 mIU/L),甲状腺球蛋白抗体275.5 IU/mL(正常值:0~115.0 IU/mL)。心电图:窦性心律,左心室高电压。甲状腺彩超:双侧甲状腺弥漫性增大,其内回声及血流改变符合甲状腺机能亢进改变。心脏彩超:正常。胸部电子计算机X射线断层扫描(computed tomogra⁃phy,CT)平扫+增强:前上纵隔见一不规则软组织影,上至胸廓入口,下至右心房水平,病灶呈浅分叶状,边界清,增强扫描轻度均匀强化,考虑为胸腺瘤(见图1,C、D)。疲劳试验和新斯的明试验均阳性(见图1,A、B)。重复电刺激:左眼轮匝肌/提上睑肌和右拇短展肌衰减试验阳性。入院完善以上相关检查,并请胸外科和内分泌科会诊,给予溴吡斯的明片60 mg 4次/d;胰岛素皮下注射;丙硫氧嘧啶片100 mg 3次/d;并给予丙种球蛋白冲击治疗(20 g静脉滴注,1次/d,连用5d)。病情渐好转,2个月后症状基本消失,血糖控制良好,甲状腺功能复查正常,故于2014年5月15日在全麻下行胸腺切除术,顺利切除一大小约为13.0 cm×8.0 cm×1.8 cm灰红组织(见图1,E),术后恢复良好,未发生MG危象、感染等并发症。病理诊断:胸腺增生(见图
1,F-L)。5月27日带药出院,出院时患者无明显不适,神经系统无明显阳性体征。出院诊断:①MG(II B型);②胸腺增生并切除术后;③1型糖尿病;④Graves病。出院后继用溴吡斯的明片60 mg 4次/d,丙硫氧嘧啶片100 mg 3次/ d、胰岛素皮下注射控制血糖(按血糖水平调整用量)。已随访半年,患者病情稳定,能从事日常工作,生活完全自理。
2 讨论
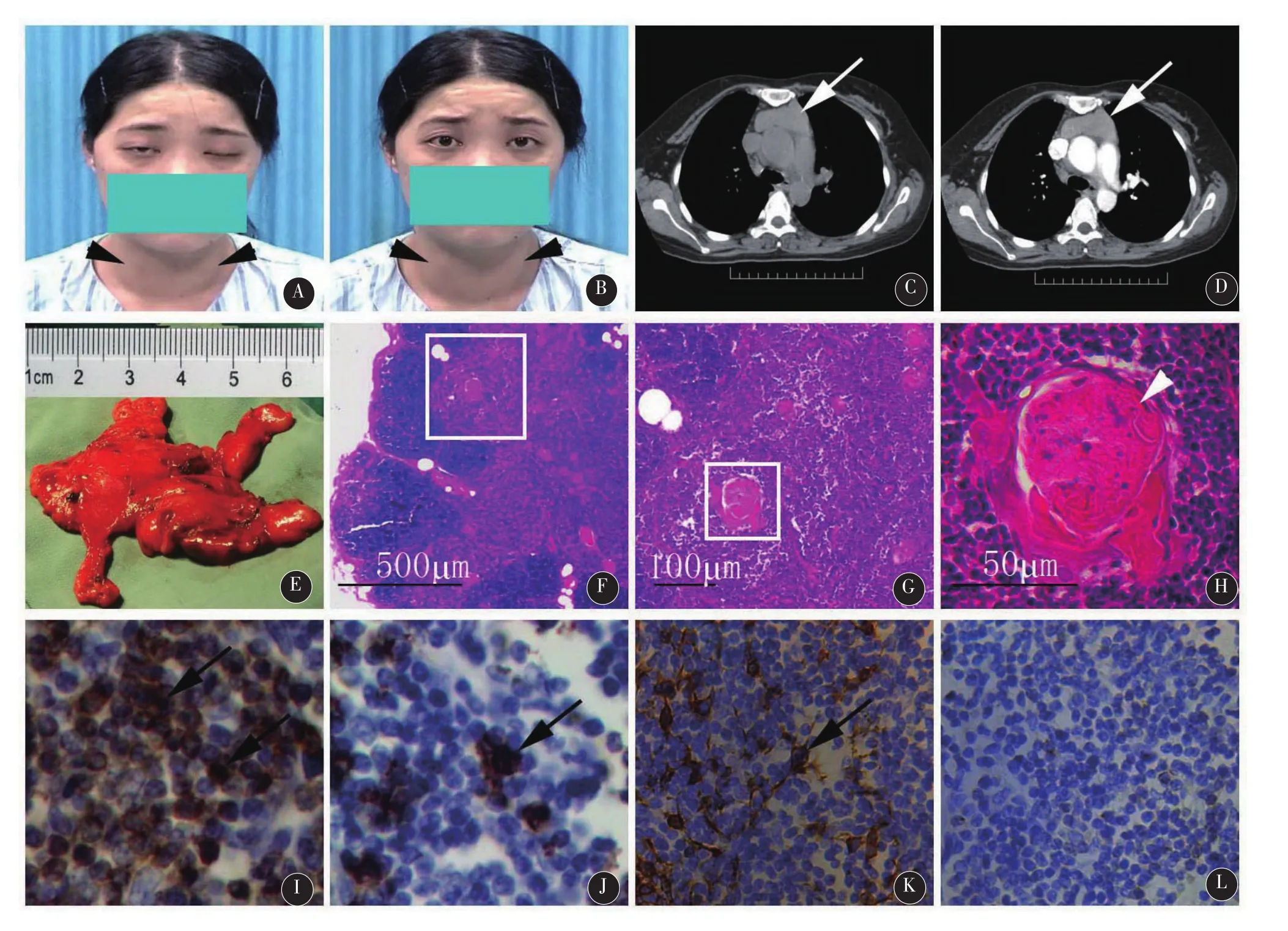
图1 患者资料。甲状腺II°肿大(A、B,箭头所指),新斯的明试验前眼睑下垂(A);新斯的明后眼裂明显增大(B)。肺部CT平扫见前上纵隔不规则软组织影(C,箭头所指),增强后病灶轻度均匀强化(D,箭头所指)。切除胸腺组织(E)。病理:苏木素—伊红染色(E-H)示胸腺组织分化良好,皮、髓质明显增生,以淋巴组织滤泡为主,部分淋巴组织中可见大的生发中心(H,箭头所指),数量较正常明显多,上皮组织未见明显瘤样增生。G为E中方框放大图;H为G中方框放大图。I—L分别是CD3、CD20、角蛋白和CD99免疫组织化学染色,分别标志T细胞、B细胞、上皮细胞和软组织肿瘤抗原。黑色箭头所指为免疫阳性细胞。H中比例尺适用于H—L
本例青年女性,亚急性起病,有眼外、面、口咽和四肢肌肉易疲劳现象,晨轻暮重,结合疲劳试验、新斯的明试验和重复神经电刺激结果MG诊断明确。另血糖高,需长期胰岛素降糖,血清C肽明显低,故1型糖尿病诊断明确。此外,有焦躁易怒、怕热多汗、甲状腺肿大,血清游离三碘甲状腺原氨酸和游离甲状腺素增高而促甲状腺素降低,故Graves病诊断明确。胸部CT示前上纵隔一不规则软组织影,边界清,增强扫描后轻度均匀强化,怀疑“胸腺瘤”,但术中发现病灶包膜完整,病理结果示胸腺组织分化良好,皮质和髓质明显增生,以淋巴组织滤泡为主,部分淋巴组织中可见大的生发中心,无明显异型细胞及周围组织浸润,可排除胸腺瘤和胸腺癌等恶性病变,确诊为胸腺增生。
MG是神经内科常见自身免疫病,可合并Graves病、胸腺瘤/胸腺增生、系统性红斑狼疮等其他自身免疫病,1种较常见(约13%[1]),其中以Graves病最常见(5%~7%)[1-2],但2种较少见,3种或以上则临床非常罕见。龚太乾等[3]报道过1例41岁MG患者同时合并糖尿病、甲状腺功能亢进
症和胸腺瘤。本例为更年轻的患者在不足十年时间内先后确诊为1型糖尿病、Graves病、MG和胸腺增生,以后是否合并其他自身免疫病需长期随访。1型和2型糖尿病目前均被认为是自身免疫病,其中1型与自身免疫异常关系更为密切。MG既可合并1型也可合并2型糖尿病。MG合并糖尿病的发生率在晚发型中(年龄≥50岁)是早发型(年龄<50岁)的5倍多[4]。值得重视的是MG使用糖皮质激素治疗可明显增加糖尿病的发生[5]。本例糖尿病发生在MG之前,且排除药物等其他继发因素影响,故提示其发病主要自身免疫功能异常有关。
MG发病机制复杂,目前认为是抗乙酰胆碱受体抗体介导为主、细胞免疫依赖和补体参与,主要累及神经肌肉接头处的获得性自身免疫病。Graves病[6]和1型糖尿病[7]发病与免疫功能异常也密切相关。胸腺是重要免疫器官,是T细胞分化、发育和成熟场所,可诱导自身免疫耐受以防自身免疫病发生,但当胸腺发生病理改变时,包括胸腺增生和胸腺瘤,则可破坏这种自身耐受机制,导致自身免疫病如MG发生。本例MG患者合并胸腺增生等多种自身免疫病的发病机制,笔者推测可能这四种自身免疫病具有共同免疫环节异常,例如:非特异性抗体、共同抗体/抗原,以及T细胞调节紊乱等,其中胸腺增生可能是导致免疫异常的始发部位或核心环节,但其确切机制有待深入研究。
MG合并胸腺增生且年龄超过18岁时,国内外[8-9]均推荐胸腺切除术。本例有胸腺切除手术指征,但因合并糖尿病和Graves病,高血糖可增加继发感染风险,而甲状腺功能异常是影响MG预后的重要危险因素[10],使病情复杂化,处理较棘手,手术时机选择尤为重要,如仓促手术很可能诱发MG危象、甲状腺功能亢进危象、糖尿病酮症酸中毒等危重症情况,甚至危及生命。本例在多学科合作下经充分术前准备,择期行胸腺切除术,取得优良疗效。
总之,MG可合并Graves病、胸腺增生等其他自身免疫病,临床医生应注意筛查,避免漏诊,其发病机制值得深入探讨。
[1]Mao ZF,Yang LX,Mo XA,et al.Frequency of autoimmune dis⁃eases in myasthenia gravis:a systematic review[J].Int J Neuro⁃sci,2011,121(3):121-129.
[2]吕婷,彭海.Graves眼病伴眼肌型重症肌无力[J].中国神经精神疾病杂志,2014,40(2):126-128.
[3]龚太乾,蒋耀光,王如文.急诊胸腺切除术治疗重症肌无力危象合并糖尿病和甲亢1例[J].第三军医大学学报,2004,26 (23):2101.
[4]Zivković SA,Clemens PR,Lacomis D.Characteristics of late-on⁃set myasthenia gravis[J].J Neurol,2012,259(10):2167-2171.
[5]Yeh JH,Chen HJ,Lin CC,et al.Risk of diabetes mellitus among patients with myasthenia gravis[J].Acta Neurol Scand,2015 Jan 28.doi:10.1111/ane.12374.
[6]Antonelli A,Ferrari SM,Corrado A,et al.Autoimmune thyroid disorders[J].Autoimmun Rev,2015,14(2):174-180..
[7]Roep BO,Tree TI.Immune modulation in humans:implications for type 1 diabetes mellitus[J].Nat Rev Endocrinol,2014,10(4): 229-242.
[8]Blissitt PA.Clinical practice guideline series update[J].J Neuro⁃sci Nurs,2013,45(5):317.
[9]中国免疫学神经免疫学分会,中华医学会神经病学分会神经免疫学组.重症肌无力诊断和治疗中国专家共识[J].中国神经免疫学和神经病学杂志,2012,19(6):401-408.
[10]王莉莉,谢琰臣,贺茂林.预测眼肌型重症肌无力预后的临床评分方法[J].中国神经精神疾病杂志,2014,40(2):83-86.
R746.1(
2014-12-08)
A(责任编辑:李立)
10.3936/j.issn.1002-0152.2015.04.013
☆ 国家自然科学基金(编号:81171084);广东省自然科学基金(编号:2014A030313384);广东省医学科研基金(编号:A201481)
* 暨南大学附属第一医院神经内科(广州510632)

