难治性癫痫患者外周血中生物学标记物的表达
于云莉史梦婷楚兰
·论 著·
难治性癫痫患者外周血中生物学标记物的表达
于云莉*史梦婷*楚兰*
目的通过对难治性癫痫(intractable epilepsy,IE)患者外周血中多耐药基因(multidrug resistance 1,MDR1)、P糖蛋白(p glycoprotein,P-gp)及谷胱甘肽转移酶(glutathione transferase π,GST-Pi)的检测来探讨IE的发病机制;探讨这3项指标作为患者外周血标志物对临床治疗的指导意义。方法本研究分为3组,IE患者31例,抗癫痫药物(antiepileptic drugs,AEDs)控制良好者33例,健康者37例。采用荧光定量聚合酶链反应技术检测患者外周血中MDR1及GST-Pi的mRNA、流式细胞术检测患者外周血中MDR1的表达产物P-gp的表达。结果在MDR1基因与GST-Pi基因相对表达量方面,IE组(1.36±0.14,0.585±0.257)显著高于AEDs治疗有效组(0.82±0.15,0.309±0.217),(P<0.05);而AEDs治疗有效组又显著高于正常组(0.27±0.07,0.134±0.223),(P<0.05)。在白细胞P-gp方面,IE组(0.104±0.084)显著高于AEDs治疗有效组(0.063±0.030),(P<0.05)。在用药方式上,GST-Pi基因相对表达量方面,给予3种(0.535±0.256)及2种(0.425±0.254)AEDs联合治疗均显著高于给单药(0.267±0.265)治疗,(P<0.05);在白细胞P-gp方面,3种(0.141±0.096)AEDs联合治疗显著高于2种(0.071±0.020)AEDs联合治疗与单药(0.050±0.020)治疗,(P<0.05)。结论癫痫患者外周血中的MDR1、P-gp及GST-Pi基因相对表达量或可作为IE的综合参考指标以及IE联合用药的耐药指标之一。
难治性癫痫 多耐药基因1 P糖蛋白 谷胱甘肽S转移酶
癫痫是神经科疾病中的一类常见病,大多数癫痫患者的发作经正规治疗得到有效控制,但仍有30%~40%的患者经适当的AEDs治疗无效,称为难治性癫痫[1]。国际抗癫痫联盟专项小组达成了对难治性癫痫的核心定义:2种正确选择、可耐受的抗癫痫药物(antiepileptic drugs,AEDs)经足够疗程及剂量的单药或联合用药仍未能控制发作的癫痫[2]。本研究选取了贵州地区散发性IE患者、AEDs有效癫痫患者和正常健康人进行外周血中MDR1、MDR1的表达产物P-gp及GST-Pi的检测,研究IE的发病机制及其相关性。并对比不同用药方式以上指标的表达变化。
1 研究方法
1.1 研究对象收集2012年3月~2013年3月贵阳医学院附属医院临床确诊的散发性的符合国际抗癫痫联盟难治性癫痫核心定义的难治性癫痫患者、AEDs治疗有效的癫痫患者及健康人的外周血。排除以下情况:①诊断错误;②发作分型不确切;③选药不当;④用药量不足;⑤患者依从性差等。难治性癫痫组31例,AEDs治疗有效组33例,健康对照组37例。男48例,女53例。其中,最小年龄3岁,最大74岁,平均为20岁。≤5岁共8例,>5岁<18岁共29例,≥18岁<60岁共32例,≥60岁共2例。3组年龄和性别无统计学差异。平均病程7.8年,病程范围为2年~37年。发作形式:主要表现为简单部分性发作、复杂部分性发作、部分性继发全面性强直-阵挛性发作、失神发作及肌阵挛发作。根据患者发作间期的V-EEG中癫痫样放电部位的不同,又分半球性、两侧对称性、局灶性、孤立多发性及广泛性分布。患者服用AEDs(苯妥英钠、丙戊酸钠、卡马西平、奥卡西平、拉莫三嗪、托吡酯以及左乙拉西坦等)的方式分单药治疗、2种或3种药物联合治疗,联合用药选用作用机制不同、很少或没有药物间相互作用的药物进行配伍。
1.2 荧光定量法检测外周血中MDR1、GST-Pi相对基因表达量的变化抽取受检者清晨空腹静脉血4 mL,于EDTA抗凝管中,置-70℃保存,以备用。提取 RNA。实验过程:GST-Pi上游引物:5’-GGACGGAGACCTCACCCTG-3’;GST-Pi下游引物:5’-TTGCCCGCCTCATAGTTGG-3’;扩增片段大小:177bp。MDR1上游引物:5’-TATTCAAC⁃TATCCCACCCGAC-3’;MDR1下游引物:5’-AT⁃GCCCAGGTGTGCTCGGA-3’;扩增片段大小:204 bp。目的基因Real Time PCR检测引物序列由康为世纪生物科技有限公司设计合成。用HiFi-MMLVcD⁃NA第一链合成试剂盒进行反转录,实验操作按产品说明书进行。用LC-480II型荧光定量PCR仪,采用2-△△CT法进行数据的相对定量分析。根据RealTime-PCR原始检测结果,按照2-△△ct相对定量计算公式,计算出各样品的目的基因相对定量结果。
1.3 流式细胞术检测患者外周血中MDR1的表达产物P-gp的表达在检测管和同型对照管中加入肝素抗凝血100 μL后,检测管中加入P-gp单克隆抗体CD243-PE20,对照管中加入lgG2a-PE20,混合后室温下避光孵育15 min。加入溶血素溶血10 min。磷酸缓冲液洗涤2次。用FACSCANTOⅡ型流式细胞仪以淋巴细胞设门,收集1万个白细胞,用CELL QUEST统计软件计算Pgp表达阳性的细胞百分数,特别是白细胞。
1.4 统计学方法采用SPSS17.0进行数据统计。根据上述各项实验结果计量资料采用(±s)的方式进行描述,计量资料采用单因素方差分析的统计方法,组间比较采用LSD的方法行两两比较,计数资料的比较采用χ2检验,检验水准α=0.05。
2 结果
2.1 外周血中MDR1相对基因表达量方差分析(见表1)AEDs治疗有效组、难治组与正常对照组的MDR1基因相对表达量F值为688.404,对应的P<0.01,具有显著统计学意义说明AEDs治疗有效组、难治组及正常对照组的MDR1基因相对表达水平具有统计学差异。
2.2 外周血中GSTP-i基因相对表达量方差分析(见表2)AEDs治疗有效组、难治组与正常对照组的GST-Pi基因相对表达量F值为16.364,对应的P<0.01,具有显著的统计学意义,说明AEDs治疗有效组、难治组及正常对照组的GST-Pi基因相对表达水平明具有统计学差异。
2.3 外周血中MDR1的表达产物P-gp的表达方差分析(见表3)AEDs治疗有效组、难治组与正常对照组的的白细胞P-gp比较的F值为5.091,对应的P<0.05,具有统计学差异。
2.4 LSD方法对三组的MDR1、GST-Pi基因相对表达量、白细胞P-gp值进行两两比较(见表4)在MDR1基因相对表达量方面,AEDs难治组显著高于治疗有效组(P=0.000);而AEDs治疗有效组又显著高于正常组(P=0.033)。在GST-Pi基因相对表达量方面,AEDs难治组显著高于治疗有效组(P=0.000);而AEDs治疗有效组又显著高于正常组(P=0.041)。在白细胞P-gp方面,AEDs难治组显著高于治疗有效组(P=0.008);而AEDs治疗有效组与正常组则没有显著差异(P=0.461)。
2.5 不同用药方式各指标的比较分析3种AEDs联合治疗、2种AEDs联合治疗与单药治疗组的MDR1基因相对表达量的(P>0.05),不具有统计学意义(见表5)。3种AEDs联合治疗、2种AEDs联合治疗与单药治疗组的GST-Pi基因相对表达量、白细胞P-gp比较的(P<0.05),具有显著的统计学意义(见表6)。
进一步使用LSD方法对不同用药方式的GST-Pi基因相对表达量和白细胞P-gp值进行两两比较:在GST-Pi基因相对表达量方面,3种与2种AEDs联合治疗组之间无显著差异(P>0.05);而给药3种、2种AEDs联合治疗均显著高于给单药治疗(P<0.05)。在白细胞P-gp方面,3种联合治疗显著高于2种AEDs联合治疗与单药治疗(P<0.05);而2种AEDs联合治疗与单药治疗则没有明显不同(P>0.05)。
3 讨论

表1 不同组MDR1基因相对表达量的比较分析

表2 不同组GST-pi的比较分析

表3 不同组P-gp的比较分析
MDR是20世纪70年代最早被Biedler等[3]发现,与IE有关的耐药基因。外周血中MDR1基因mRNA表达水平的监测可以作为评价癫痫耐药的一项指标[4-5]。P-gp[6]由MDR1编码,是一种细胞膜上固有的一类跨膜磷脂糖蛋白。P-gp是能量依赖性外排泵,可将亲脂性药物泵出细胞外,与细胞的分泌和出胞作用有关[7]。张玉琴等[8]通过流式细胞仪检测得出外周血P-gp在儿童IE中表达增强,可作为儿童IE耐药性的客观指标;P-gp表达阳性的初诊癫痫患儿多转为IE,P-gp可作为预测儿童IE的客观指标。P-gp蛋白阻滞剂,如OC144-093,可以在耐药性癫痫中增强抗癫痫药的疗效,也许我们可以假设P-gp将作为一项新型的未来临床治疗目标[9-10]。

表4 MDR1、GST-Pi、P-gp表达量的多重比较
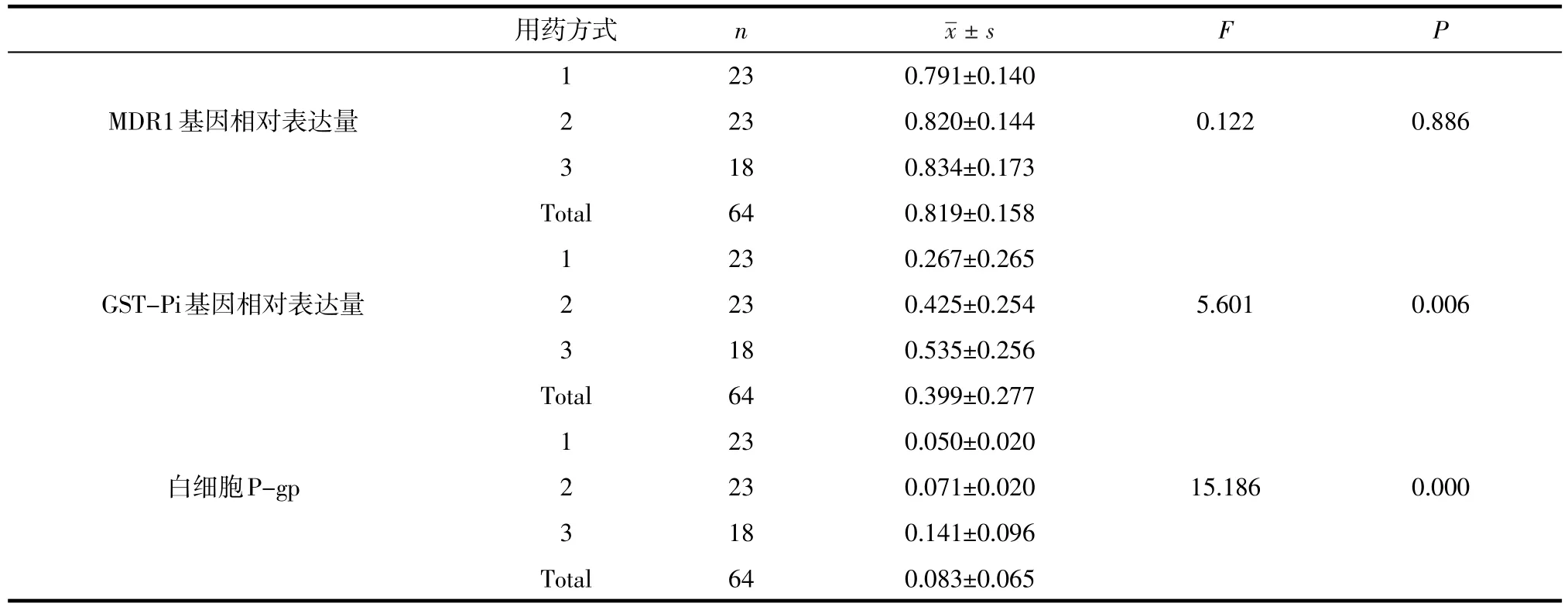
表5 不同用药方式各指标的比较分析
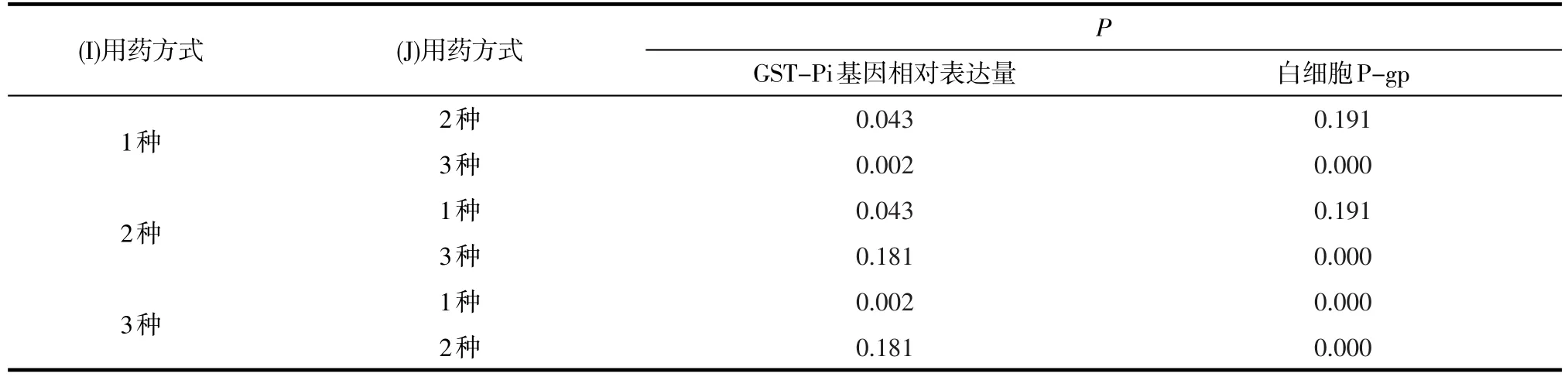
表6 不同用药方式的比较
GST-Pi上含有GSH结合结构域和底物结合域,能够催化还原型谷胱苷肽上的硫原子亲核攻击底物上的亲电子基团,通过促进亲电物质与还原型谷胱菅肽结合,降低细胞内有毒物质的水平。同时还可与多种亲脂性物质直接结合,转化为极性更高的亲水物质,以利排出体外,细胞内GST水平的升高或活性增强可大大增加细胞对药物的解毒功能,在保护机体的同时,也降低了药物的药理作用,导致耐药性的产生。国内研究发现GST-Pi蛋白表达增高会导致IE的发生,GST-Pi在组织和血清中都能检测到,且检测血清中的GST-Pi对机体没有侵袭性,大大方便临床的应用[11]。国内王学峰等[12]通过研究GST-Pi在IE患者术后脑组织的表达,发现其表达明显高于对照组。
我们在研究中发现IE患者与AEDs治疗有效组及健康组对比MDR1、P-gp以及GST-Pi在外周血中存在高表达的情况,从而证实以上指标可以作为癫痫患者预测IE的外周生物学指标,这与国内外学者的研究结果一致。当然,我们的研究还将持续进行,包括难治性癫痫患者术后一系列指标的追踪。通过本研究,更进一步证明难治性癫痫的形成机制并非单一因素引起,而是多因素导致的。如果将这几种指标有效结合起来,应用于难治性癫痫的检测,相比取用脑组织的有创检查以及费用较高,更容易被病人及家属接受,便于临床医生采集标本,这将对于未来难治性癫痫的防治、早期诊断、治疗以及预后产生重要价值及影响。但是能否作为不同用药方式的指导指标目前国内外尚未见到相关报道。
癫痫的药物治疗原则中很重要的一条就是首选单药治疗。但对于IE患者,癫痫专科医师会谨慎考虑联合用药。联合用药也同样有相应的原则:需选用不同作用机制的药物;选用很少或没有相互作用的药物;具有相对少的不良反应。联合用药的数量越多,药物之间的相互作用就越多也会越复杂,更多的不良反应也就随之而来,如果药物添加不当,甚至会造成IE的结局。我们通过比较AEDs的联合治疗与单药治疗,发现服用3种AEDs与服用2种AEDs治疗的癫痫患者外周血中的GST-Pi基因相对表达量均高于只服用1种AEDs治疗的癫痫患者。服用3种AEDs治疗的癫痫患者外周血中的白细胞P-gp高于服用2种AEDs治疗的癫痫患者,也高于只服用1种AEDs治疗的癫痫患者。针对IE患者常常是2种、2种以上的AEDs治疗,通过我们的研究得知,如果在联合用药过程中出现P-gp及GST-pi基因的高表达,需要及时调整用药方案,防止因为联合用药本身诱导的IE的产生。但是我们的研究结果存在样本量较小、没有将不同的AEDs分类,没有严格划分不同的用药时间等问题。所以日后还需继续改进,扩大标本量,按药物种类不同组合方式进行分组,可进一步检测哪种联合用药方式治疗更为合理,指导临床。
[1]Kwan P,Sander JW.The natural history of epilepsy:an epidemi⁃ological view[J].J Neurol Neurosurg Psychiatry,2004,75: 1376-1381.
[2]洪桢,洪震,周东.耐药性癫痫的定义:国际抗癫痫联盟治疗策略委员会专项工作组统一提案[J].中华神经科杂志, 2010,43(7):487-492.
[3]Biedler JL,Riehm H.Cellular resistance to actinomycin D in Chinese hamster cells in vitro:cross- resistance,radioauto⁃graphic,and cytogenetic studies[J].Cancer Res,1970,30: 1174-1184.
[4]郑雪平,谭兰,宋敬卉.难治性癫痫患者外周血中MDR1基因的表达及临床意义[J].中国神经精神疾病杂志,2006,32 (5):454-456.
[5]庞保东,董琰,张润春.难治性癫痫患儿多药耐药基因的表达及意义[J].临床儿科杂志,2009,27(11):1023-1025.
[6]Potschka H,Fedrowitz M,Loscher W.P-glycoprotein and mul⁃tidrug resistance associated protein are involved in the regula⁃tion of ext racellular levels of the major antiepileptic drug carba⁃mazepine in the brain[J].Neuroreport,2001,12:3557-3560.
[7]Loscher W,Potschka H.Role of multidrug transporters in phar⁃macoresistance to antiepileptic drugs[J].Pharmacol Exp Ther, 2002,301:7214.
[8]张玉琴,许俐,李东.儿童难治性癫痫外周血P糖蛋白的表达及药物干预[J].临床儿科杂志,2009,27(11):1026-1029
[9]Newman MJ,Dixon R,Toyonaga B.0C144—093,a novel P—glycopmtein inhabitor for the enhancement of anti-epileptic therapy[J].Novartis Found Symp,2002,243:213.
[10]Lazarowski A,Czornyj L.Potential role of multidrug resistant proteins in refractory epilepsy and antiepileptic drugs interac⁃tions[J].Drug Metabol Drug Interact,2011,26(1):21-26.
[11]Deng X,Jia H,Yang Z,et al.Correlation study on expression of GST-Pi protein in brain tissue and peripheral blood of epilepsy rats induced by pilocarpine[J].Huazhong Univ Sci Technolog Med Sci,2011,31(5):701-704.
[12]龚玉来,王学峰,龚云,等.谷胱苷肽硫转移酶在耐药性癫痫脑组织中的表达[J].中华神经外科杂志,2006,22(8):510-512.
The expression of MDR1,P-gp and GST-Pi biomarkers in peripheral blood from patients with refracto⁃ry epilepsy
.YU Yunli,SHI Mengting,CHU Lan.Department of Neurology,Guiyang medical college affiliated hospital,Guiyang 550004,China.Tel:0851-86855119.
ObjectiveThe pathogenesis of intractable epilepsy was explored by examining the expression of the P-gp,GST-Pi as well as MDR1 in peripheral blood of the patients with intractable epilepsy.The potential of the above mentioned three genes as the biomarkers for treatment of intractable epilepsy was investigated.MethodsThirty-one sub⁃jects with refractory epilepsy,33 subjects under good circumstances by antiepileptic drugs,and 37 healthy subjects were included in the present study.fluorescence quantitative polymerase chain reaction and flow cytometry were used to detect mRNA levels of MDR1 and GST-Pi and P-gp of MDR1 in the peripheral blood of the patients,respectively.Results The expression levels of MDR1 and GST-Pi were significantly higher in the AEDs intractable group(1.36±0.14,0.585±0.257)than in the treatment group(0.82±0.15,0.309±0.217,P<0.05)The expression levels of MDR1 and GST-Pi were signifi⁃cantly higher in the AEDs treatment group than in the normal group(0.27±0.07,0.134±0.223,P<0.05).The expression levels of P-gp were significantly higher in the AEDs of the intractable group(0.104±0.084)than in the treatment group(0.063±0.030,P<0.05).The GST-Pi gene expression levels were significantly higher in three(0.535±0.256)or two(0.425±0.254)kinds of antiepileptic drugs combination therapy than in single drug treatment(0.267±0.265,P<0.05).Leucocyte P-gp levels were significantly higher in combination therapy of three kinds of antiepileptic drugs(0.141± 0.096)than in combination therapy of two kinds of antiepileptic drugs(0.071±0.020)or in monotherapy(0.050±0.020, P<0.05).ConclusionMDR1 and GST-Pi gene expression levels of peripheral blood can be used as the reference in⁃dex for treatment of intractable epilepsy and the resistant index of combination treatment for intractable epilepsy.
Intractable epilepsy(IE) Multiple drug resistance genes1(MDR1)P glycoprotein(P-gp)Glutathi⁃one S transferase Pi(GST-Pi)
R742.1
A
2015-04-02)
(责任编辑:李立)
10.3969/j.issn.1002-0152.2015.08.004
☆ 贵州省科学技术基金资助项目(编号:黔科合J字[2009]2193号)
* 贵阳医学院附属医院神经内科(贵阳 550004)

