大气CO2升高和紫外辐射相互作用对羊栖菜生理特性的影响
刘树霞,徐军田,邹定辉
1 淮海工学院海洋学院, 连云港 222005 2 华南理工大学环境与能源学院,广州 510006
大气CO2升高和紫外辐射相互作用对羊栖菜生理特性的影响
刘树霞1,徐军田1,邹定辉2,*
1 淮海工学院海洋学院, 连云港 222005 2 华南理工大学环境与能源学院,广州 510006
为了研究经济海藻羊栖菜对大气CO2浓度增加与紫外辐射(UVR)相互作用的响应,设置两个CO2浓度(380μL/L和800μL/L)以及两种辐射处理,即PAR处理(滤除UV-A、UV-B, 藻体仅接受可见光,400—700nm)和PAB处理(全波长辐射280—700nm)培养海藻,探讨了羊栖菜生长、光合作用、呼吸作用、光合色素含量、可溶性糖和蛋白以及硝酸还原酶活性的变化情况。结果表明高浓度CO2显著提高羊栖菜藻体的相对生长速率,并且紫外辐射的负面效应在高CO2处理下表现不显著。高CO2降低了藻体的光合作用速率,而UVR的负面效应和生长体现为一致性,但是羊栖菜的呼吸作用没有受到环境变化的明显影响。羊栖菜的光合色素叶绿素a和类胡萝卜素在高浓度CO2处理下明显降低,而UVR没有明显影响。环境因子对羊栖菜的可溶性糖没有影响,但是在高CO2和全波长辐射处理下,藻体可溶性蛋白的含量显著增加。同时高CO2明显提高了硝酸还原酶的活性,并且仅在高浓度CO2处理下藻体中UVR对其活性有抑制作用。CO2和UVR对羊栖菜的大多数生理特性存在明显的交互作用,在未来CO2浓度进一步增加的情况下,UVR的负面效应将会得到一定程度的缓解,这样有利于羊栖菜在养殖海区获得更高的产量。
紫外辐射;CO2;羊栖菜;生长;光合作用
由于化石燃料的大量使用,大气CO2水平从工业革命前的280 mL/L剧增到现在的390μL/L[1]。并且根据IPCC预测模型(A1F1)的推测,在本世纪末大气中CO2浓度将达到800—1000μL/L。在以前很长一段时间里,科学家认为研究海洋酸化应该聚焦于外海水域,这是因为在这些区域浮游植物密度低,并且受陆源的影响小,pH水平在短时间尺度上,是比较稳定的;而在近海海域,因为生物量密度较高,且受陆源输入的影响,海洋酸化的效应不明显。但是在近期的研究发现,近岸海域海水也会受海洋酸化的影响,且因为海洋酸化与生物呼吸及低氧的耦合作用,pH下降的速度甚至要快于外海海域[2]。
近几年来大气CO2升高所导致的海洋酸化对海洋生态系统影响已成为全球气候变化中最为热门的问题,但是对于大型海藻对海洋酸化响应研究甚少[3- 7],并且多数是在实验室恒定光强下进行研究,忽略了自然界中光的变动以及太阳光中的紫外辐射(UVR)。而紫外辐射对藻体细胞的光合作用[8- 10]、一些关键酶甚至是遗传物质DNA产生明显的效应[11-12],进而影响到藻体的生长[13- 16]。因此在研究大气CO2升高对大型海藻影响的同时必须考虑紫外辐射在这个过程中的作用,因为在大型海藻真实的生长环境中,紫外辐射是不能够被单独分离出去的。
高光等[16]研究表明紫外辐射能够降低羊栖菜的光合作用速率和生长速率,并且随着光强的增加,抑制作用也更为显著,这种抑制作用在未来大气CO2升高,海水pH值下降的情况下将会表现为怎样的变化模式,本文同样以经济海藻羊栖菜为研究材料,探讨大气CO2升高与紫外辐射对藻体生理生化特性的耦合效应,从生长、光合作用、呼吸作用、硝酸还原酶活性、光合色素以及可溶性蛋白和多糖等方面探讨羊栖菜在未来大气CO2增加的情况下,紫外辐射的影响,为更好的估计海洋气候变化对近岸大型海藻的影响提供一定的实验基础。
1 材料和方法
1.1 实验材料
羊栖菜(Hizikiafusiformis)采自汕头南澳岛云澳湾,用低温箱在5h内运到实验室,在培养箱内暂养一段时间后再用于实验。暂养的条件是温度为20℃,光强为100 μmol m-2s-1,光周期为12h∶12h;培养液为过滤的自然海水,每2天更换1次。
1.2 实验设置
石英管(石英管一端开口,长度为400mm, 直径为59mm)外表面分别覆盖有不同滤光特性的滤膜,使羊栖菜能够接受到不同的太阳光辐射处理:① PAB处理,石英管外面包裹Ultraphan 295滤膜 (UVT 100, Digefra, Munich, Germany),使藻体接受全波段阳光辐射;② PAR处理,石英管外面包裹Ultraphan395滤膜(UV Opak, Digefra, Munich, Germany),滤掉紫外线,使藻体只接受可见光PAR。太阳辐射的强度通过光谱辐射仪(ELDONET Terrestrial Spectro-radiometer, 德国产)测定,本仪器可以连续监测太阳辐射的可见光、紫外线A和紫外线B,每分钟记录1次。
CO2处理为两个水平,一个是通入正常空气(CO2浓度约为380μL/L),另一个为正常水平的2倍(800μL/L)。通气的速率约为300mL/min, 高CO2来自植物CO2培养箱,通过箱体内的气泵泵到露天实验台上的培养管内。
1.3 pH值日变化测定
在藻体培养十几天以后,找一个典型的天气(晴朗),测定不同培养条件下藻体培养液的pH值的日变化情况。从8:00点到20:00点每2h测定1次。
1.4 生长测定
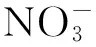
1.5 光合作用与呼吸作用的测定
光合放氧的测定采用液相氧电极(Hansatech oxy-lab,美国),通过LKB超级恒温箱(英国)水浴控制温度为20℃。光合反应介质初始为8mL过滤的自然海水(pH 8.2,盐度 31),光源为卤钨灯,光照强度用光量子计(英国)测定,本实验所用光强为饱和光强(600—800μmol m-2s-1),所用羊栖菜藻量为0.2 g FW(鲜重)左右。呼吸作用是通过用不透光的材料遮住反应槽测得氧气的消耗量得到。
1.6 有关生化组成含量的测定
藻体培养两个星期后,测定其叶绿素a (Chl a)、类胡萝卜素(Car)的含量。Chl a和类胡萝卜素的含量是根据100%甲醇提取后的扫描光谱,按照Wellburn提供的公式计算得到[17]。
可溶性糖含量采用酚—硫酸法测定[18]:取0.3g藻,用研钵研磨成匀浆,加水约15mL,于70—80℃的水浴中加热30min,冷却后离心(5000r/min,10min),将滤液定容至20mL,即为待测液。取0.5mL待测液加水至2mL,然后加50μl酚试剂,再加5mL H2SO4,混匀后用紫外分光光度计测其在485nm处的吸光值,再用标准曲线计算其可溶性糖含量(mg/g FW)。
可溶性蛋白含量参照Kochert的方法[18],用考马斯亮蓝法测定。取0.2g藻,加1mL水用研钵匀浆,然后再加4mL水离心(5000r/min,10min),取0.5mL上清液加5mL考马斯亮蓝G-250,用紫外分光光度计测其在595nm处的吸光值,再用标准曲线计算其可溶性蛋白含量(mg/g FW)。
1.7 硝酸还原酶(NRA)的测定

1.8 数据处理
实验数据采用Two-way ANOVA 或T-test分析,设置显著水平为P< 0.05, 本实验中所有的处理都设为3个重复。
2 结果

图1 生长实验期间日累积辐射量(可见光PAR, 紫外线A UV-A, 紫外线B UV-B)的变化 Fig.1 The change about daily dose of photosynthetically active radiation (PAR), ultra-violet A (UV-A) and ultra-violet B (UV-B) during experiment periods
在生长实验期间的两个星期内,最高的日累积辐射量分别为:PAR 7.7MJ/m2,UV-A 1.2MJ/m2和 UV-B 0.034MJ/m2;最低日累积辐射量分别为:PAR 2.1MJ/m2,UV-A 0.39MJ/m2和 UV-B 0.011MJ/m2。平均日辐射量为分布为PAR:5.7MJ/m2,UV-A:0.91MJ/m2和 UV-B:0.025MJ/m2(图1)。
在羊栖菜生长期间,其培养介质中pH值变化遵循一个明显的日变化模式(图2),在早上和晚上最低,在16:00达到最高。通入正常空气培养的羊栖菜藻体海水介质,其pH值要明显高于通入高浓度CO2培养藻体的海水。
高浓度CO2显著提高羊栖菜藻体的相对生长速率RGR(P< 0.05)。UVR显著抑制了正常空气CO2水平下藻体的生长速率(P< 0.05),但在高浓度CO2下这种作用不明显(P> 0.05)(图3)。CO2和UVR之间有明显的交互作用(P< 0.05)。
而对于藻体的光合作用来说,高CO2显著降低羊栖菜的最大净光合作用速率。但UVR对光合作用的影响在高低CO2处理下表现出和生长速率一样的趋势:在正常空气CO2水平下是明显的负面效应,但在高浓度CO2下作用不显著(P>0.05)。并且CO2和UVR之间没有明显的交互作用(P> 0.05)。羊栖菜的呼吸作用速率没有受到UVR和CO2的显著影响,在所有的处理下都表现为一致的水平(图4)。
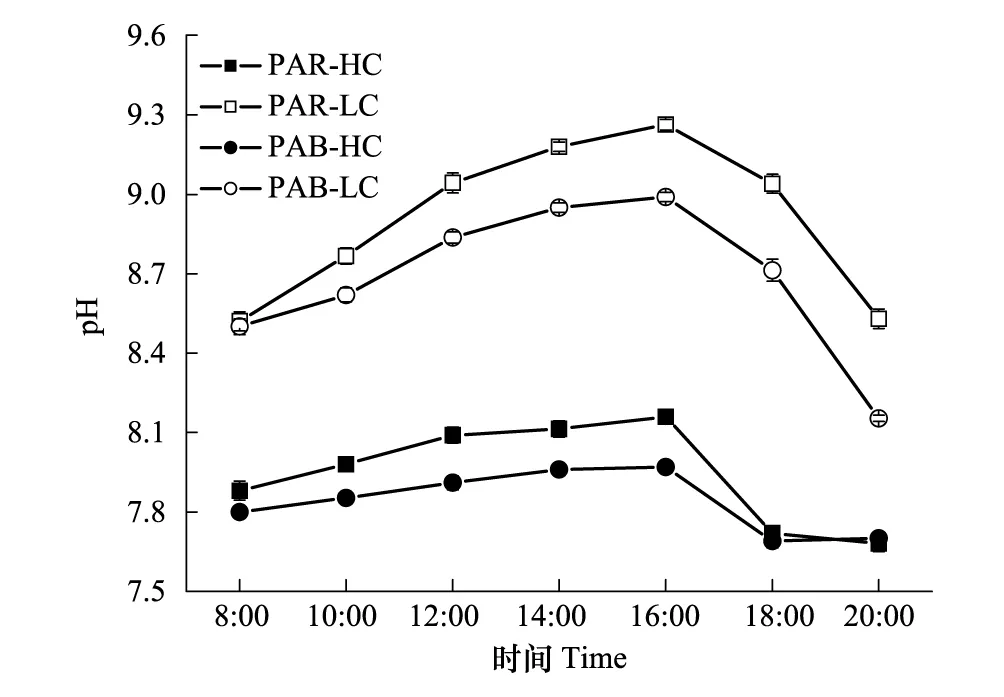
图2 在不同光辐射(可见光PAR和全波长辐射PAB)以及两种CO2水平(正常空气水平LC, 380 μL/L和高CO2水平HC, 800 μL/L)处理下羊栖菜培养介质中pH值的日变动 Fig.2 Daily fluctuations of seawater pH in the culture of Hizikia fusiformis grown under different CO2 concentrations (Ambient CO2 level: LC, 380 μL/L; High CO2 level: HC, 800 μL/L) and with exposure to photosynthetically active radiation (PAR) or full spectrum solar radiation (PAB)

图3 羊栖菜在可见光PAR和全阳光辐射PAB(PAR+UVR)及不同CO2浓度(正常空气水平LC, 380 μL/L和高CO2水平HC, 800 μL/L)培养条件下的相对生长速率(RGR)的变化不同的字母代表处理间的显著性差异(P<0.05)Fig.3 The relative growth rate (RGR)of Hizikia fusiformis grown under different CO2 concentrations (Ambient CO2 level: LC, 380 μL/L; High CO2 level: HC, 800 μL/L) and with exposure to photosynthetically active radiation (PAR) or full spectrum solar radiation (PAB)

图4 羊栖菜在可见光PAR和全阳光辐射PAB(PAR+UVR)及不同CO2浓度(正常空气水平LC, 380 μL/L和高CO2水平HC, 800 μL/L)培养条件下,其最大净光合作用速率和呼吸速率的变化情况Fig.4 The change about the maximal net photosynthetic rate and dark respiration rate of Hizikia fusiformis grown under different CO2 concentrations (Ambient CO2 level: LC, 380 μL/L; High CO2 level: HC, 800 μL/L) and with exposure to photosynthetically active radiation (PAR) or full spectrum solar radiation (PAB)不同的字母代表处理间的显著性差异(P<0.05)
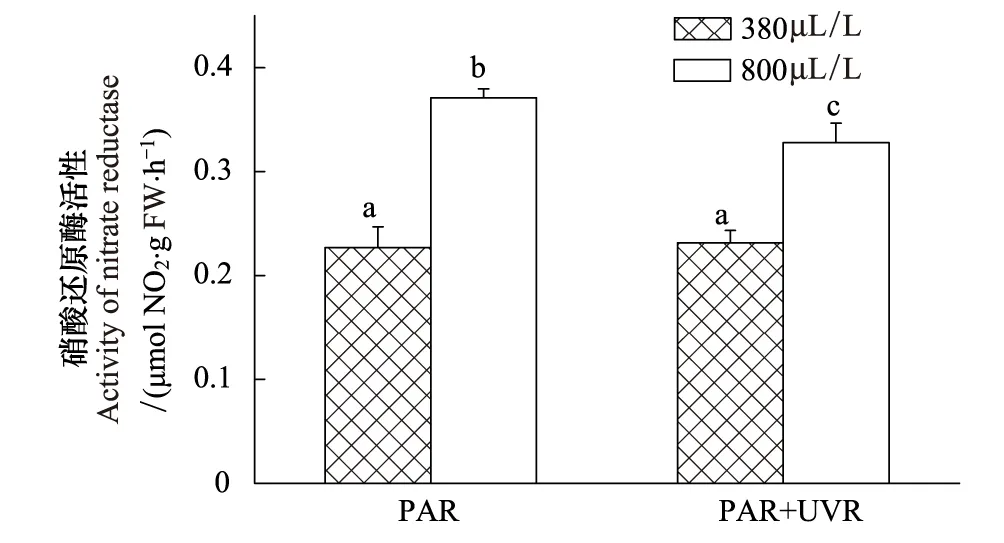
图5 羊栖菜在可见光PAR和全阳光辐射PAB(PAR+UVR)及不同CO2浓度(正常空气水平LC, 380 μL/L和高CO2水平HC, 800 μL/L)培养条件下,其硝酸还原酶活性的变化 Fig.5 The change about the activity of nitrate reductase (NRA) in Hizikia fusiformis grown under different CO2 concentrations (Ambient CO2 level: LC, 380 μL/L; High CO2 level: HC, 800 μL/L) and with exposure to photosynthetically active radiation (PAR) or full spectrum solar radiation (PAB) 不同的字母代表处理间的显著性差异(P<0.05)
高CO2显著提高了羊栖菜的硝酸还原酶活性,但UVR在正常空气CO2水平下作用不明显(P> 0.05),但在高浓度CO2下UVR起到明显的负面效应(P< 0.05)。CO2和UVR之间有明显的交互作用(P< 0.05)(图5)。
UVR和CO2对羊栖菜的可溶性糖没有显著的影响。对羊栖菜的可溶性蛋白来说,在仅有可见光存在的情况下,高低CO2处理下的藻体没有显著的差异。但在全波长辐射下,高CO2处理下的羊栖菜蛋白含量显著高于正常空气水平下的藻体。而UVR仅在高CO2处理下显著提高了藻体的可溶性蛋白含量,CO2和UVR之间有明显的交互作用(P< 0.05)(图6)。
对于羊栖菜的光合色素Chla和类胡萝卜素来说,随着培养时间的增加,高CO2显著降低了它们的含量,但是UVR没有明显的效应,并且CO2和UVR之间交互作用不显著(P> 0.05)(图7)。

图6 羊栖菜在可见光PAR和全阳光辐射PAB(PAR+UVR)及不同CO2浓度(正常空气水平LC, 380 μL/L和高CO2水平HC, 800 μL/L)培养条件下,其可溶性糖及可溶性蛋白含量的变化Fig.6 The change about soluble carbohydrates and soluble proteins contents of Hizikia fusiformis grown under different CO2 concentrations (Ambient CO2 level: LC, 380 μL/L; High CO2 level: HC, 800 μL/L) and with exposure to photosynthetically active radiation (PAR) or full spectrum solar radiation(PAB)不同的字母代表处理间的显著性差异(P<0.05)

图7 羊栖菜在可见光PAR和全阳光辐射PAB(PAR+UVR)及不同CO2浓度(正常空气水平LC, 380 μL/L和高CO2水平HC, 800 μL/L)培养条件下,其叶绿素a(Chla)和类胡萝卜素(Carotenoid)含量随时间的变化Fig.7 The changes of Chlorophyll a (Chla) and Carotenoid contents of Hizikia fusiformis grown under different CO2 concentrations (Ambient CO2 level: LC, 380 μL/L; High CO2 level: HC, 800 μL/L) and exposed to photosynthetically active radiation (PAR) or full spectrum solar radiation (PAB) with time
3 讨论
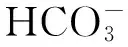
高CO2处理下的羊栖菜藻体光合作用能力显著下降,这种光合生理特性的下调在齿缘墨角藻、细基江蓠和浒苔中也得到验证[7, 23- 24]。这是因为高浓度的CO2为羊栖菜藻体提供了更为充足的碳源,藻体的Rubisco酶对CO2的亲和力会适应性地下降,从而节约了驱动无机碳利用的能量,这在光能不足的情况下会对藻体起到正面作用,但在高的光强水平下,节省的能量羊栖菜提供更强的光保护能力,如增加光呼吸等[7,25],这样有可能是导致藻体最大光合反应能力下降。在自然界中,藻体接受的光强水平一天内是不断变化的,在早上和下午,光强水平较弱,CO2会对羊栖菜的生长起到明显的促进作用,但是中午时刻光强水平很高,这对藻体的光合作用等产生明显的抑制,因此CO2的效应取决于一天内光强变动的水平。羊栖菜藻体通过下调他们本身的光合色素含量来适应高CO2处理,这是一种羊栖菜藻体采取的光保护机制,高CO2培养下的羊栖菜藻体通过下调天线色素的含量来有效地避免多余光能对藻体的损伤。另外藻体体内光合色素的下降也有可能是藻体为适应高浓度的CO2而做出的一种调整,如涉及到资源的再分配[26]。
在高CO2浓度下,羊栖菜的NR活性显著增加,这在一些大型海藻中也得到证实[6, 27]。羊栖菜藻体对UVR和CO2存在明显的交互作用,在高CO2浓度下UVR显著降低NR活性,但在正常CO2水平下却没有抑制作用。这有可能是由于在高CO2下,NR活性显著增加,但UVR在这个正面过程中存在负面效应。羊栖菜的生长是海藻各种生理特征的综合体现,虽然高CO2降低了羊栖菜最大光合作用速率,但是也同时促进了藻体对N的利用,而UVR对生长的影响体现为光合作用以及硝酸还原酶活性的一致性,这表明,紫外辐射通过影响羊栖菜的固碳和固氮进而影响到藻体的生长。
综上所述,在未来大气CO2含量急剧增加的情况下,羊栖菜的生长受到明显的促进,并且对自然界中的紫外辐射抵御能力也进一步加强,由于羊栖菜幼孢子体具有比成体更强抵御紫外线的能力[28],因此在未来羊栖菜将会比现在更具有生长优势,在养殖方面可以获得更高的产量。并且与实验室恒定光强的实验相比,本实验数据更能反映羊栖菜在自然界中的真实情况,为未来更好的估测海洋环境变化对羊栖菜养殖过程中的影响提供可靠的实验数据。
[1] Solomon S, Qin D, Manning M, Chen Z, Marquis M, Averyt K B, Tignor M, Miller H L. Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: University Press, 2007: 996- 996.
[2] Cai W J, Hu X P, Huang W J, Murrell M C, Lehrter J C, Lohrenz S E, Chou W C, Zhai W D, Hollibaugh J T, Wang Y C, Zhao P S, Guo X H, Gundersen K, Dai M H, Gong G C. Acidification of subsurface coastal waters enhanced by eutrophication. Nature Geoscience, 2011, 4(11): 766- 770.
[3] Hepburn C D, Pritchard D W, Cornwall C E, Mcleod R J, Beardall J, Raven J A, Hurd C L. Diversity of carbon use strategies in a kelp forest community: implications for a high CO2ocean. Global Change Biology, 2011, 17(7): 2488- 2497.
[4] Israel A, Hophy M. Growth, photosynthetic properties and Rubisco activities and amounts of marine macroalgae grown under current and elevated seawater CO2concentrations. Global Change Biology, 2002, 8(9): 831- 840.
[5] Porzio L, Buia M C, Hall-Spencer J M. Effects of ocean acidification on macroalgal communities. Journal of Experimental Marine Biology and Ecology, 2011, 400(1-2): 278- 287.
[6] Zou D H. Effects of elevated atmospheric CO2on growth, photosynthesis and nitrogen metabolism in the economic brown seaweed,Hizikiafusiforme(Sargassaceae, Phaeophyta). Aquaculture, 2005, 250(3-4): 726- 735.
[7] Xu J T, Gao K S. Future CO2-Induced ocean acidification mediates the physiological performance of a green tide alga. Plant Physiology, 2012, 160(4): 1762- 1769.
[8] Aguilera J, Karsten U, Lippert H, Vögele B, Philipp E, Hanelt D, Wiencke C. Effects of solar radiation on growth, photosynthesis and respiration of marine macroalgae from the Arctic. Marine Ecology. Progress Series, 1999, 191: 109- 119.
[9] Han T, Han Y S, Kain J M, Häder D P. Thallus differentiation of photosynthesis, growth, reproduction, and UV-B sensitivity in the green algaUlvapertusa(Chlorophyceae). Journal of Phycology, 2003, 39(4): 712- 721.
[10] Xu J T, Gao K S. Use of UV-A energy for photosynthesis in the red macroalgaGracilarialemaneiformis. Photochemistry and Photobiology, 2010, 86(3): 580- 585.
[11] Bischof K, Kräbs G, Wiencke C, Hanelt D. Solar ultraviolet radiation affects the activity of ribulose-1, 5-bisphosphate carboxylase-oxygenase and the composition of photosynthetic and xanthophyll cycle pigments in the intertidal green algaUlvalactucaL. Planta, 2002, 215(3): 502- 509.
[12] Buma A G J, De Boer M K, Boelen P. Depth distributions of DNA damage in Antarctic marine phyto- and bacterioplankton exposed to summertime UV radiation. Journal of Phycology, 2001, 37(2): 200- 208.
[13] Davison I R, Jordan T L, Fegley J C, Grobe C W. Response ofLaminariasaccharina(Phaeophyta) growth and photosynthesis to simultaneous ultraviolet radiation and nitrogen limitation. Journal of Phycology, 2007, 43(4): 636- 646.
[14] Henry B E, Van Alstyne K L. Effects of UV radiation on growth and phlorotannins inFucusgardneri(Phaeophyceae) juveniles and embryos. Journal of Phycology, 2004, 40(3): 527- 533.
[15] Michler T, Aguilera J, Hanelt D, Bischof K, Wiencke C. Long-term effects of ultraviolet radiation on growth and photosynthetic performance of polar and cold-temperate macroalgae. Marine Biology, 2002, 140(6): 1117- 1127.
[16] 高光, 吴红艳, 高坤山. 阳光紫外辐射对褐藻羊栖菜生长和光合作用的影响. 水生生物学报, 2009, 33(2):284- 288.
[17] Wellburn A R. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution. Journal of Plant Physiology, 1994, 144(3): 307- 313.
[18] Kochert G. Protein determination by dye binding // Hellebust J A, Craigie J S. Handbook of Phycological Methods: Physiological and Biochemical Methods. London, New York, Melbourne: Cambridge University Press, 1978: 92- 93.
[19] Corzo A, Niell F X. Determination of nitrate reductase activity inUlvarigidaC. Agardh by the in situ method. Journal of Experimental Marine Biology and Ecology, 1991, 146(2): 181- 191.
[20] Kübler J E, Johnston A M, Raven J A. The effects of reduced and elevated CO2and O2on the seaweedLomentariaarticulata. Plant, Cell and Environment, 1999, 22(10): 1303- 1310.
[21] Gordillo F J L, Figueroa F L, Niell F X. Photon- and carbon-use efficiency inUlvarigidaat different CO2and N levels. Planta, 2003, 218(2): 315- 322.
[22] 徐军田, 高坤山. CO2和阳光紫外辐射对经济红藻龙须菜的影响. 海洋学报, 2010, 32(5): 144- 151.
[23] Johnston A M, Raven J A. Effects of culture in high CO2on the photosynthetic physiology ofFucusserratus. British Phycological Journal, 1990, 25(1): 75- 82.
[25] Gao K S, Xu J T, Gao G, Li Y H, Hutchins D A, Huang B Q, Wang L, Zheng Y, Jin P, Cai X N, Häder D P, Li W, Xu K, Liu N N, Riebesell U. Rising CO2and increased light exposure synergistically reduce marine primary productivity. Nature Climate Change, 2012, 2(7): 519- 523.
[26] Andria J R, Vergara J J, Perez-Llorens J L. Biochemical responses and photosynthetic performance ofGracilariasp. (Rhodophyta) from Cádiz, Spain, cultured under different inorganic carbon and nitrogen levels. European Journal of Phycology, 1999, 34(5): 497- 504.
[27] Mercado J M, Javier F, Gordilio L, Niell X, Figueroa F L. Effects of different levels of CO2on photosynthesis and cell components of the red algaPorphyraleucosticta. Journal of Applied Phycology, 1999, 11(5): 455- 461.
[28] 刘树霞, 邹定辉, 徐军田. 羊栖菜幼孢子体对不同N水平生长条件和阳光紫外辐射的响应. 生态学报, 2010, 30(20): 5562- 5568.
Combined effects of increasing CO2concentrations and solar UV radiation on the physiological performance ofHizikiafusiformisOkamura (Sargassaceae,phaeophyta)
LIU Shuxia1, XU Juntian1, ZOU Dinghui2,*
1SchoolofMarineScienceandTechnology,HuaihaiInstituteofTechnology,Lianyungang222005,China
2CollegeofEnvironmentandEnergy,SouthChinaUniversityofTechnology,Guangzhou510006,China
Here, we investigated the physiological responses of the economically important brown macroalgal species,Hizikiafusiformis, to solar ultra-violet (UV) radiation and increasing CO2concentrations. Specifically, we cultured the alga under two different CO2concentrations (380μL/L and 800μL/L) and two different solar radiations (PAR: photosynthetically active radiation 400—700 nm; PAB: full spectrum solar radiation, 280—700 nm) outdoors. Two radiation treatments were established in the experiment: (1) thalli that received full spectrum solar radiation (PAB treatment) in quartz tubes covered with Ultraphan 295, and (2) thalli that only received PAR (P treatment) in quartz tubes covered with Ultraphan film 395. CO2was supplied to the different treatments by bubbling (300 mL/min) ambient air (390μL/L) or air enriched with CO2(800μL/L CO2in the air) with a plant CO2incubator that automatically controlled CO2concentrations, with less than 5% variation. For all treatments, algae were grown at 20℃, which was regulated by a cooling unit. The growth rate, photosynthesis, dark respiration, photosynthetic pigment contents, soluble carbohydrates, proteins, and nitrate reductase activity were measured after three weeks of culture. Our results showed that elevated CO2significantly enhanced the relative growth rate ofH.fusiformis. UV radiation appeared to have no negative effects on thalli grown under high CO2conditions. High CO2and UV culture conditions both reduced the net photosynthetic rate ofH.fusiformis. However, no significant difference was found in the dark respiration ofH.fusiformisamong all treatments. Chlorophyll a and carotenoid contents declined whenH.fusiformiswas cultured under high CO2conditions, whereas UV had no significant effect on the content of the two pigments. There was no difference in soluble carbohydrates among all treatments; however, compared to all other treatments, soluble protein content significantly increased in thalli grown at high CO2and full spectrum solar radiation. Nitrate reductase activity was enhanced by high CO2treatment, but was inhibited in thalli grown under both UV and high CO2conditions. Overall, the physiological performance ofH.fusiformiswas most significantly influenced by CO2and UVR, with increasing CO2concentrations potentially alleviating the negative effects of UVR on thalli performance. This information is expected to help enhance the production ofH.fusiformisgrown in sea areas designated for future culturing.
UV radiation; CO2;Hizikiafusiformis; growth; photosynthesis
国家自然科学基金(41276148, 41106093); 江苏省海洋生物技术重点实验室课题(2010HS08); 江苏省“青蓝工程”人才基金; 江苏高校优势学科建设工程资助项目
2013- 05- 26;
日期:2015- 04- 14
10.5846/stxb201305261184
*通讯作者Corresponding author.E-mail:dhzou@scut.edu.cn
刘树霞,徐军田,邹定辉.大气CO2升高和紫外辐射相互作用对羊栖菜生理特性的影响.生态学报,2015,35(21):7089- 7096.
Liu S X, Xu J T, Zou D H.Combined effects of increasing CO2concentrations and solar UV radiation on the physiological performance ofHizikiafusiformisOkamura (Sargassaceae, phaeophyta).Acta Ecologica Sinica,2015,35(21):7089- 7096.

