结肠腺癌患者术后组织中NQO-1、Cath-D和Ki-67的表达及意义
屈中玉 (南阳市中心医院肿瘤内科一病区,河南 南阳 473009)
结肠腺癌患者术后组织中NQO-1、Cath-D和Ki-67的表达及意义
屈中玉 (南阳市中心医院肿瘤内科一病区,河南 南阳 473009)
目的 应用免疫组化方法检测结肠腺癌中NADPH:醌氧化还原酶(NQO)-1、组织蛋白酶(Cath)-D和Ki-67增殖指数(Ki-67)的表达,分析其关系及临床意义。方法 经病理确诊的124例结肠腺癌术后组织及临床资料作为观察组,80例上皮内瘤变的结肠黏膜组织作为对照组,80例正常结肠黏膜组织作为正常对照组,应用免疫组化方法检测三组中NQO-1、Cath-D和Ki-67的表达。结果 三组中NQO-1、Cath-D和Ki-67表达的阳性率差别有统计学意义,观察组中NQO-1、Cath-D和Ki-67的表达与肿瘤的分化程度、浸润深度、TNM分期、脉管浸润、淋巴结转移密切相关。相关性分析显示NQO-1和Ki-67、Cath-D和Ki-67的表达均具有正相关性。结论 结肠腺癌术后组织中NQO-1、Cath-D和Ki-67均高表达,NQO-1和Cath-D均与Ki-67的表达具有协同作用,对促进肿瘤的发生、进展和增殖有一定作用。
结肠腺癌;NQO-1;Cath-D;Ki-67;免疫组化
结肠腺癌病变形成及发展过程中多种蛋白表达失调,并对肿瘤的微环境有重要影响。NADPH:醌氧化还原酶(NQO)-1是一种黄素酶,在多种肿瘤中高表达,也是促进肿瘤进展的重要蛋白〔1,2〕。组织蛋白酶(Cath)-D是与肿瘤生长、增殖和侵袭相关的蛋白,在多种肿瘤中高表达,可以加速肿瘤恶变和浸润,同时参与胚胎发育、肿瘤形成及血管生成过程〔3,4〕。Ki-67增殖指数与肿瘤细胞增殖状态相关,标记肿瘤细胞增殖的特异性强〔5〕。本文应用免疫组化方法检测结肠腺癌术后组织中NQO-1、Cath-D和Ki-67的表达,探讨其关系及临床价值。
1 资料与方法
1.1 一般资料 2010年1月至2012年12月在我院行结肠腺癌根治的手术患者共124例作为观察组,统计患者临床资料并留取术后的蜡块组织。完全符合WHO中的具体诊断标准。其中男70例,女54例;年龄54~78岁,平均67.6岁。高分化60例,中分化30例,低分化34例。术前均未进行放、化疗。80例上皮内瘤变的结肠黏膜组织作为对照组,其中男40例,女40例,年龄56~77岁,平均66.8岁。选取观察组中距离肿瘤边缘>3 cm的正常结肠黏膜组织80例作为对照组,其中男41例,女39例;年龄55~76岁,平均66.5岁。三组一般资料无明显差别。
1.2 NQO-1、Cath-D和 Ki-67表达的检测 NQO-1、Cath-D和Ki-67抗体均为浓缩液,依不同比例进行稀释后应用免疫组化SP法、DAB染色进行预实验,并设阳性对照和阴性对照。选择最理想的配比浓度进行正式实验。正式实验应用免疫组化SP法。严格按说明书操作,严格质控。
1.3 NQO-1、Cath-D和Ki-67阳性的判定方法 NQO-1、Cath-D的阳性表达均位于细胞质中(少数表达于细胞核中的均不计数),Ki-67阳性表达均位于细胞核中,以染成棕黄色颗粒为阳性细胞,计数10个400倍视野,取阳性细胞的平均值,NQO-1、Cath-D以阳性率≥5%为阳性,以阳性率<5%为阴性。Ki-67以阳性率≥25%为阳性,以阳性率<25%为阴性。
1.4 统计学方法 应用SAS6.12软件进行χ2检验。
2 结果
2.1 3 组中NQO-1、Cath-D和Ki-67表达阳性率的比较 正常对照组、对照组和观察组中NQO-1、Cath-D和Ki-67表达的阳性率有增高趋势。见表1。
2.2 观察组不同临床特征中NQO-1、Cath-D和Ki-67表达阳性率的比较 观察组中NQO-1、Cath-D和Ki-67的表达与肿瘤的分化程度、浸润深度、TNM分期、脉管浸润、淋巴结转移密切相关。见表2。
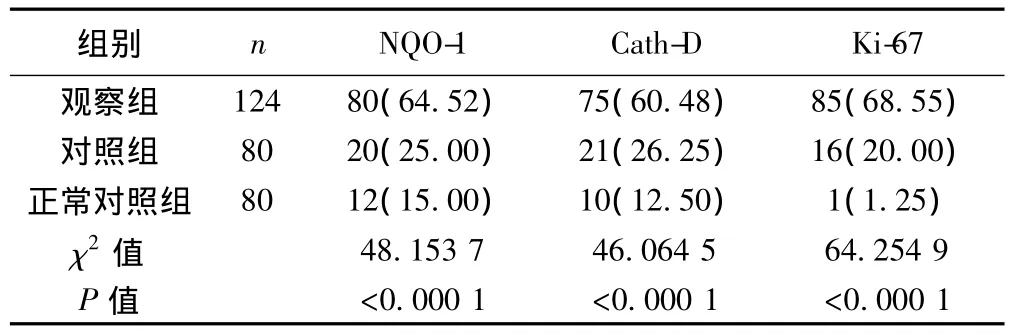
表1NQO-1、Cath-D和Ki-67在3组中表达的比较〔n(%)〕
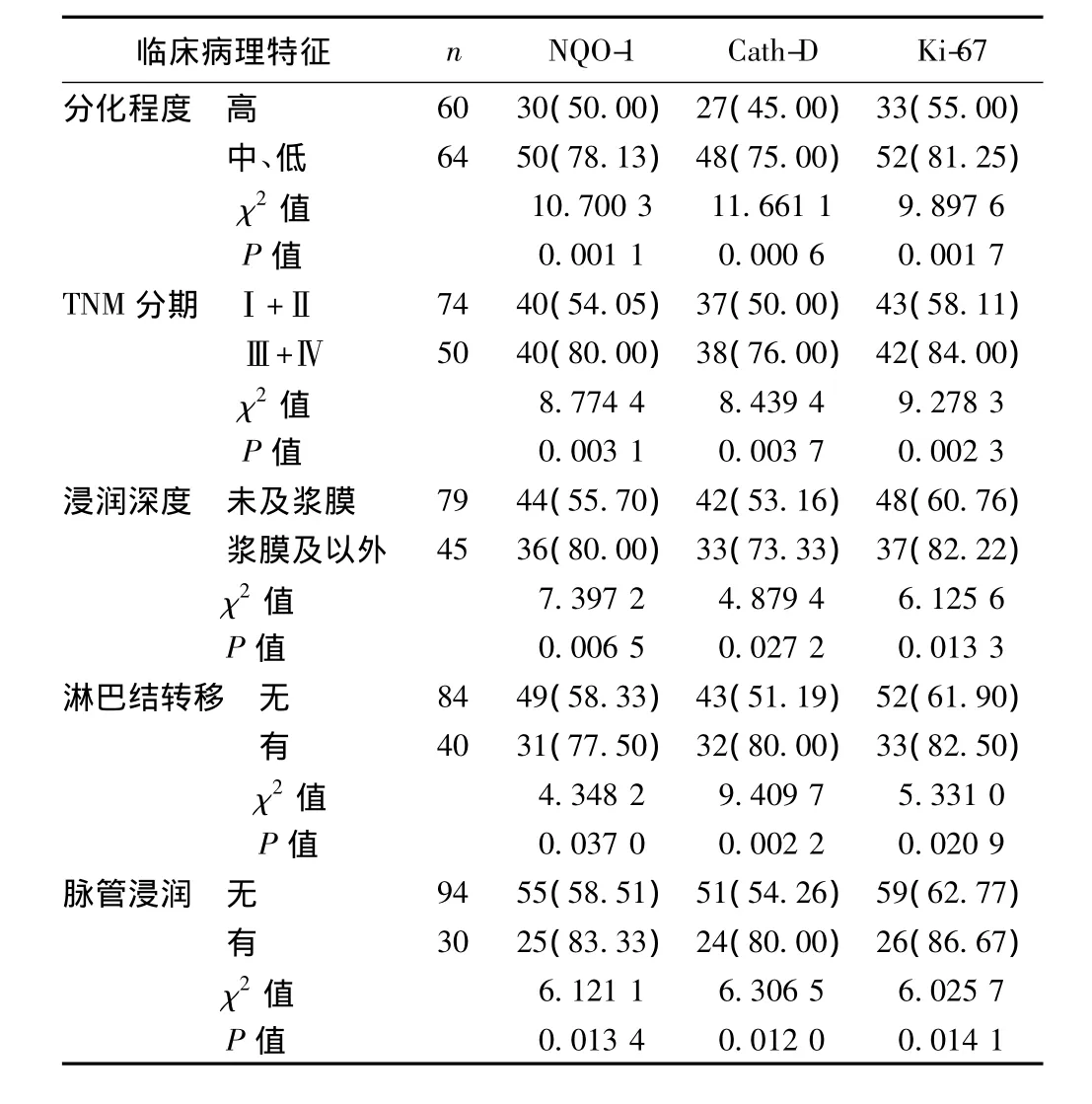
表2 观察组不同临床特征中NQO-1、Cath-D和Ki-67表达阳性率的比较〔n(%)〕
2.3 观察组中NQO-1、Cath-D和Ki-67表达的相关性 观察组中 NQO-1和 Ki-67(r=0.49,P=0.011 3)、Cath-D 和 Ki-67(r=0.48,P=0.020 9)的表达具有正相关性,而NQO-1和Cath-D的表达未见明显相关性(P>0.05)。
3 讨论
结肠腺癌是一种上皮性肿瘤,居男性肿瘤的第四位,女性肿瘤的第三位,其发病涉及多种因素,如遗传易感性、基因突变、增生失调等。多种肿瘤相关基因异常表达是促进肿瘤进展的重要因素。NQO-1蛋白是一种胞质黄素酶,其基因定位于16q22染色体,在正常组织中有微量表达〔6,7〕。有研究认为不同NQO-1基因亚型编码的酶类呈现不同的活性〔8〕。如由TT纯合子诱导的NQO-1活性失调,可以引起肝细胞对外源性致肿瘤物质的解毒功能下降〔9〕。也有研究则认为NQO-1可以作为一个氧化应激反应调节因子,对恶性肿瘤的进展起一定的调节作用〔8〕。李琰等〔10〕认为 NQO-1的表达变化,可以使机体对环境致癌因素的解毒功能降低,使细胞易受到氧化损伤,增加对化学致癌物引起肿瘤的易感性。Cath-D是一种溶酶体天冬氨酸蛋白酶,参与肿瘤的发生、侵袭和转移〔11,12〕,Cath-D还可以作为雌激素调节的溶酶体蛋白酶〔13〕,调节肿瘤细胞的增殖和细胞间的黏附作用〔14,15〕。NQO-1、Cath-D 均可能对肿瘤的恶变有一定影响。
本实验结果提示NQO-1、Cath-D、Ki-67三种蛋白在肿瘤发生过程中起重要的促进作用,NQO-1、Cath-D可能通过促进Ki67增殖发挥重要的促进肿瘤进展作用。三种蛋白参与肿瘤由幼稚到成熟的内在过程,也显示出三种蛋白在细胞恶变起始过程中起的作用。三种蛋白参与肿瘤的生长及侵袭全过程,即当NQO-1、Cath-D和KI-67高表达时,引起肿瘤细胞呈蟹足样生长,对周围的破坏能力增强,对局部微环境的影响大。三种蛋白参与肿瘤的进展,尤其是参与肿瘤的淋巴道播散和远处播散的过程中。TNM分期是临床判断肿瘤生物学行为和预后的重要指标,因此联合检测NQO-1、Cath-D和Ki-67高表达可能预示着肿瘤的不良预后,后续实验将关注患者生存,以证实此观点。NQO-1、Cath-D在对肿瘤影响过程中,全程参与了细胞的增殖过程,尤其是失控性增殖反应过程〔16,17〕。近来也有研究显示NQO-1激活后,凋亡信号传导受到影响,正常细胞的不断增生繁殖,而凋亡受到阻滞,细胞逐渐恶变〔18〕。因此NQO-1也可能是调节凋亡的重要因子。有学者认为NQO-1具有癌基因的许多特征,如诱导非锚定依赖性细胞周期进展等生物学行为过程〔19〕。
1 Wang Y,Zhang G,Luo Y.Association between NQO1 C609T polymorphism and colorectal cancer risk〔J〕.Tumour Biol,2013;34(6):4027-32.
2 Hamachi T,Tajima O,Uezono K,et al.CYP1A1,GSTM1,GSTT1 and NQO1 polymorphisms and colorectal adenomas in Japanese men〔J〕.World J Gastroenterol,2013;19(25):4023-30.
3 Kepka A,Waszkiewicz M,Roszkowska-Jakimiec W,et al.Lysosomal exoglycosidases and cathepsin D in colon adenocarcinoma〔J〕.Pol Arch Med Wewn,2012;122(11):551-6.
4 Nicotra G,Castino R,Follo C,et al.The dilemma:does tissue expression of cathepsin D reflect tumor malignancy?The question:does the assay truly mirror cathepsin D mis-function in the tumor〔J〕?Cancer Biomark,2010;7(1):47-64.
5 李胜水,许 华,李秀清,等.原发性胆囊癌中ILK、E-cad和KI67的表达及意义〔J〕.实用医学杂志,2013;9(19):3204-6.
6 Zhu CL,Huang Q,Liu CH,et al.NAD(P)H:quinone oxidoreductase 1(NQO1)C609T gene polymorphism association with digestive tract cancer:a meta-analysis〔J〕.Asian Pac J Cancer Prev,2013;14(4):2349-54.
7 Chen J,Lin Y,Zhang R,et al.Contribution of NAD(P)H quinone oxidoreductase 1(NQO1)Pro187Ser polymorphism and risk of colorectal adenoma and colorectal cancer in Caucasians:a meta-analysis〔J〕.Arch Med Res,2012;43(1):58-66.
8 桂文波,肖开银.NQO1蛋白在家族聚集性肝癌中的表达及临床意义〔J〕.中国癌症防治杂志,2010;2(4):279-81.
9 Sameer AS,Shah ZA,Syeed N,et al.NAD(P)H:quinone oxidoreductase 1(NQO1)Pro187Ser polymorphism and colorectal cancer predisposition in the ethnic Kashmiri population〔J〕.Asian Pac J Cancer Prev,2010;11(1):209-13.
10 李 琰,张健慧,郭 炜,等.NAD(P)H:醌氧化还原酶1 C609T多态性与贲门癌发病风险〔J〕.中华流行病学杂志,2004;25(8):731-2.
11 Dian D,Heublein S,Wiest I,et al.Significance of the tumor protease cathepsin D for the biology of breast cancer〔J〕.Histol Histopathol,2014;29(4):433-8.
12 Markicevic M,Kanjer K,Mandusic V,et al.Cathepsin D as an indicator of clinical outcome in early breast carcinoma during the first 3 years of follow-up〔J〕.Biomark Med,2013;7(5):747-58.
13 肖华亮,王 东,李增鹏,等.骨肉瘤组织蛋白酶D表达及其预后的关系〔J〕.第三军医大学学报,1999;21(2):109-12.
14 Shin IY,Sung NY,Lee YS,et al.The expression of multiple proteins as prognostic factors in colorectal cancer:cathepsin D,p53,COX-2,epidermal growth factor receptor,C-erbB-2,and Ki-67〔J〕.Gut Liver,2014;8(1):13-23.
15 Kim YR,Kim HS,An CH,et al.Mutational and expressional analysis of cathepsin D in gastric and colorectal cancers with microsatellite instability〔J〕.APMIS,2010;118(8):617-9.
16 Szajda SD,Snarska J,Jankowska A,et al.Cathepsin D and carcino-embryonic antigen in serum,urine and tissues of colon adenocarcinoma patients〔J〕.Hepatogastroenterology,2008;55(82-83):388-93.
17 陈晓艺,张白凌,陈少杰.组织蛋白酶D与基质金属蛋白酶-9在口腔鳞癌的表达〔J〕.福建医科大学学报,2006;40(6):560-1.
18 Chiu MM,Ko YJ,Tsou AP,et al.Analysis of NQO1 polymorphisms and p53 protein expression in patients with hepatocellularcarcinoma〔J〕.Histol Histopathol,2009;24(10):1223-32.
19 Awadallah NS,Dehn D,Shah RJ,et al.NQO1 expression in pancreatic cancer and its potential use as a biomarker〔J〕.Appl Immunohistochem Mol Morphol,2008;16(1):24-31.
R735.3
A
1005-9202(2015)09-2435-03;
10.3969/j.issn.1005-9202.2015.09.057
屈中玉(1972-),男,硕士,副主任医师,主要从事恶性肿瘤基因靶向及综合治疗研究。
〔2013-11-21修回〕
(编辑 苑云杰)

