常压室温等离子体诱变技术选育高产Monacolin K紫色红曲霉突变株
祁田甜,张 婵,,*,胡济美,郎天丹,王成涛,,*,赵吉兴
(1.北京工商大学 北京市食品添加剂工程技术研究中心,北京 100048;2.北京工商大学 食品质量与安全北京实验室,北京 100048;3.中国国际工程咨询公司,北京 100048;4.山东中惠食品有限公司,山东 滨州 251706)
红曲类产品在我国的生产和使用已有1 000多年历史,广泛用于酿酒、食品着色、医药等方面[1]。紫色红曲霉(Monascus purpureus Went.)属于真菌门子囊菌纲真子囊菌亚纲红曲霉属,能够产生多种对人体有益的次级代谢产物,如胆固醇合成抑制剂Monacolin K、红曲色素、麦角固醇、γ-氨基丁酸等。1979年日本学者Endo[2]首次从红色红曲霉(Monascus ruber)的培养液中分离出能有效抑制胆固醇合成关键酶——羟甲基戊二酸单酰辅酶A(3-hydroxy-3-methylglutaryl-coenzyme A,HMG-CoA)还原酶的化合物Monacolin K。Monacolin K(又称洛伐他汀,lovastatin)是一种曲霉菌属合成的次级代谢产物,因其结构与HMG-CoA的结构相类似,可竞争性地抑制胆固醇合成途径中HMG-CoA还原酶的活性,因此具有抑制人体胆固醇合成、降血脂的作用[3-4],且具有高效、低毒、安全等特点[5]。
清华大学与北京思清源公司合作研发出新型常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变系统,通过发射均匀且粒子丰富的等离子体射流,使活性粒子透过细胞膜作用于DNA物质,引起DNA的多样性损伤,细胞中的DNA不完全修复形成遗传稳定的突变株。ARTP具有射流温度低(25~35℃)、活性粒子分布均匀、对人体和环境无危害的特点,与真空条件下运作的常规低压离子束植入操作系统相比,由于除去了复杂和昂贵的真空系统,常压室温等离子技术可以在一个非常小的环境内以惰性气体为基础的等离子体射流区域中进行,并且可以提高操作的安全性,同时控制不同的剂量[6-7]。研究结果表明,ARTP诱变使黑曲霉产脂肪酶的比活力比出发菌株提高约37%,获得产油酵母突变株表现出比野生型更高的生长速率和更高的油脂产量,且正突变率超过30%,构建高产琥珀酸的大肠杆菌工程菌产量达到0.87 g/g[8-10]。由于其独特的功能和潜在的应用价值,ARTP诱变系统被应用于许多领域,如生物、化学净化剂和热敏感性医疗仪器消毒方面[11],已然成为生物诱变育种领域的一个研究热点。本实验将ARTP诱变技术应用于红曲霉菌株育种,期望能筛选得到一株高产Monacolin K的突变株,为Monacolin K及降胆固醇药物的生产提供支持。
1 材料与方法
1.1 菌种、培养基与试剂
紫色红曲霉Monascus purpureus M-1,由本实验室筛选、保存。
斜面培养基:葡萄糖20 g/L、酵母提取物4 g/L、蛋白胨3 g/L、麦芽浸粉20 g/L、KH2PO42 g/L、琼脂15 g/L,自然pH值。
平板活化培养基:葡萄糖20 g/L、酵母提取物4 g/L、蛋白胨3 g/L、麦芽浸粉20 g/L、KH2PO42 g/L、琼脂15 g/L,自然pH值。
种子培养基:葡萄糖30 g/L、黄豆粉15 g/L、MgSO41 g/L、甘油70 mL/L、蛋白胨10 g/L、NaNO32 g/L、KH2PO42 g/L,自然pH值。
发酵培养基:甘油90 mL/L、大米粉水解液20 mL/L、蛋白胨10 g/L、NaNO35 g/L、MgSO41 g/L、ZnSO42 g/L、KH2PO42.5 g/L,乳酸调pH 4.5。
Monacolin K标准品 美国Sigma公司;NaCl、NaH2PO4、Na2HPO4、NaNO3、KH2PO4、MgSO4、ZnSO4、25%戊二醛、醋酸异戊酯、乙醇、六甲基二硅胺(hexamethyldisilazane,HMDS) 国药集团化学试剂有限公司;酵母提取物、蛋白胨、麦芽浸粉、甘油北京奥博星生物技术有限公司;甲醇(色谱纯) 美国Fisher公司。
1.2 仪器与设备
LC-20AT高效液相色谱仪、WondaSilTMC18柱(4.6 mm×150 mm,5 μm) 日本岛津公司;VEGA 3LMU/LMH扫描电子显微镜 捷克Tescan公司;GT10-1高速离心机 上海安亭科学仪器厂;BPH-9082恒温培养箱 德国Eppendorf New Brunswick公司;OBY-H160-SE1恒温恒湿培养箱 常州欧邦电子有限公司;DL-CJ-1NDII 2NDI 2NDII超净工作台 北京东联哈尔仪器制造有限公司;DHG-9620B智能电热恒温鼓风干燥箱 上海琅玕实验设备有限公司;DSX-280B立式压力蒸汽灭菌器上海申安医疗器械厂;M-pact AX124分析天平 上海欢奥科技公司;常压室温等离子体诱变育种机 北京思清源生物科技有限公司;Eiko IB-3型离子溅射仪 日本EIKO公司。
1.3 方法
1.3.1 ARTP诱变处理[12]
将试管斜面30℃活化7 d的紫色红曲霉菌体用无菌生理盐水冲洗、过滤,孢子悬液浓度调节至106~107个/mL,添加甘油至体积分数为5%。将菌悬液均匀涂抹在金属载片表面,用镊子将菌物载片转移到载物台,设定参数在工作气流量为10 L/min,等离子体发射源与样品距离为2 mm,操作温度23.0~35.0℃的条件下,分别照射0、30、60、75、90、120、150、180 s,处理后将载片转移到装有1 mL生理盐水的EP管中,振荡洗脱形成新的菌悬液,不同梯度稀释后涂布平板,培养48 h后观察菌落形态特征。采用平板活菌计数法(CFU法)来计算ARTP处理的致死率,获得致死曲线。
1.3.2 突变菌株筛选
将ARTP诱变处理的菌悬液稀释涂布平板,30℃恒温培养3 d。选取单个菌落接入试管种子培养基,于30℃、200 r/min条件下培养48 h,接种后于30℃、150 r/min摇床培养13 d,取发酵液用高效液相色谱(high performance liquid chromatography,HPLC)法检测Monacolin K产量。
1.3.3 分析检测方法
1.3.3.1 平板活菌计数法测定菌体浓度
诱变后菌悬液稀释至10-1、10-2、10-33个梯度,每个梯度3~5个涂布平板,30℃培养2 d后计数,根据存活菌体数,按照公式(1)计算致死率[4]。
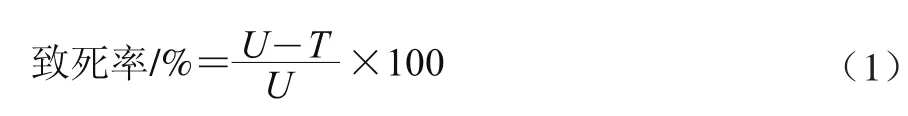
式中:U为未经ARTP处理的平板菌落数/(CFU/μL);T为ARTP处理后的平板菌落数/(CFU/μL)。
诱变菌株突变率计算:以Monacolin K的产量为标准,将产量降低或提高20%以上的诱变菌株定义为突变株[13],按照公式(2)、(3)计算菌株突变率和正突变率。

1.3.3.2 Monacolin K产量及菌体生物量测定
标准品预处理:准确称量Monacolin K标准品溶于75%甲醇配制成200 mg/L标准溶液,0.45 μm有机微孔滤膜过滤,进样检测。
发酵液预处理:取培养13 d的发酵液5 mL加入15 mL 75%甲醇,200 W超声波辅助萃取30 min,静置过夜,10 000 r/min离心,0.45 μm有机微孔滤膜过滤,取滤液用HPLC法检测Monacolin K含量。
HPLC检测条件[14-15]:WondaSilTMC18色谱柱(4.6 mm×150 mm,5 μm);流动相:甲醇-0.1%磷酸(3∶1,V/V),流速l mL/min,紫外检测器检测波长238 nm,柱温箱30℃,进样量10 μL。
[16],采用菌丝体干质量法测定发酵1~10 d的菌体生物量。
1.3.3.3 扫描电子显微镜检测菌体形态
培养8 d的红曲霉菌体,体积分数2.5%戊二醛溶液固定12 h后用0.1 mol/L pH 7.2磷酸盐缓冲液漂洗2次,依次用30%、50%、70%、80%、90%和100%乙醇梯度脱水,醋酸异戊酯置换乙醇,置于HMDS中60℃烘箱干燥。离子溅射仪喷金,扫描电子显微镜观察菌体微结构形态(20 kV)[17-18]。
2 结果与分析
2.1 初始菌株紫色红曲霉M-1发酵产Monacolin K能力
配制0~200 mg/L的Monacolin K标准溶液,进行HPLC检测。由图1可知,Monacolin K出峰时间为12.5 min左右;以峰面积(y)对Monacolin K质量浓度(x)进行线性回归,其回归方程为y=31 104x+58 597(R2=0.999),Monacolin K质量浓度在10~200 mg/L范围内线性关系良好。根据Monacolin K标准曲线计算发酵13 d后初始菌株紫色红曲霉M.purpureus M-1发酵液中Monacolin K产量为202.9 mg/L。
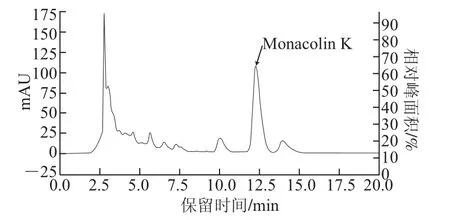
图1 紫色红曲霉M-1发酵液的HPLC图Fig.1 HPLC chromatogram of the fermented broth of M.purpureus M-1 on the 13th day
2.2 紫色红曲霉M-1诱变致死率的选择
采用平板活菌计数法绘制紫色红曲霉菌株的致死率曲线。由图2可知,ARTP对紫色红曲霉M-1菌株具有很强的致死效应,ARTP处理30 s紫色红曲霉菌株诱变致死率达到84%,处理60 s后致死率基本稳定在90%以上,处理180 s致死率接近100%。为获得较高的正突变率以方便筛选,选取ARTP处理90 s(致死率约92.6%)作为后续处理的条件,经计算得到突变率为42.9%,而正突变率较高,达到23.8%。
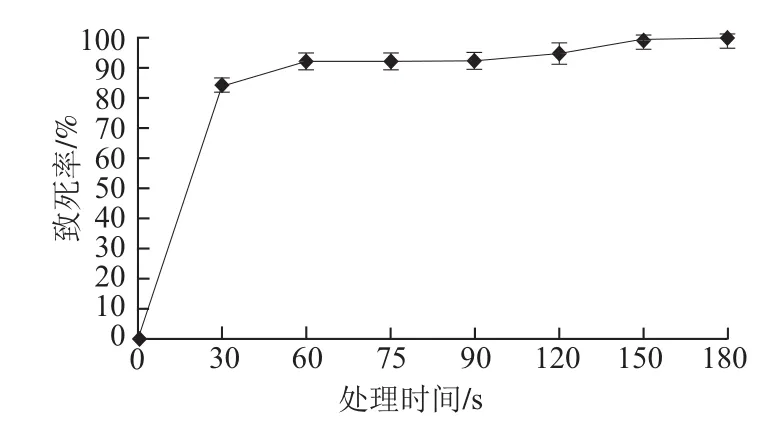
图2 紫色红曲霉M-1的致死率曲线Fig.2 Lethal rate curve of M.purpureus M-1
2.3 ARTP处理对紫色红曲霉及其突变株的诱变效应
研究探讨ARTP处理对紫色红曲霉诱变效应,通过比较初始菌株与突变株的形态、孢子大小和菌丝体状态分析其诱变机制。
2.3.1 ARTP诱变处理引起紫色红曲霉菌落形态、色泽变化

图3 紫色红曲霉M-1经ARTP诱变前(a)后(b)的菌落形态变化Fig.3 Colony changes before (a) and after (b) M-1 mutation
图3a为初始菌株M-1的孢子悬液(稀释100倍)涂布平板培养48 h后生长菌落,图3b为初始菌株M-1经ARTP诱变30 s后稀释相同倍数涂布平板得到的菌落(稀释100倍),可以看出经诱变处理后菌落数明显降低,且菌落形态发生了改变。紫色红曲霉M-1菌落初期为白色,成熟后渐变为淡红至红色,背面深红;诱变后部分菌落直径发生一定改变,色泽更白,中心有一些红点,且继续培养菌体状态不再发生改变。
2.3.2 ARTP诱变处理引起菌体细胞的形态特征变化
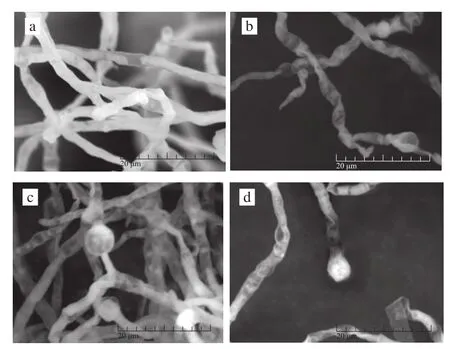
图4 紫色红曲霉M-1经ARTP诱变前后菌丝体及孢子形态变化Fig.4 Scanning electron micrographs of mycelia and spores ofM.purpureus M-1 before and after mutagenesis
图4a、4b为诱变前后菌株M-1菌丝体形态比对结果,可以看出未经ARTP处理的菌丝体茂盛饱满,菌丝体有大量分枝,较少皱缩断裂,菌丝体直径为2~7 μm,菌丝由横隔膜分隔成为成串多细胞,细胞幼时含有颗粒,老后含空泡及油滴,上述特征与俞艳玲等[19]的报道一致。且可观察到不同时期闭囊壳和分生孢子的生长状况(图4a);诱变处理后菌丝体存在形态学损伤,其皱缩、弯曲的程度都较未经诱变的菌株更严重(图4b),经ARTP等离子体诱变处理150 s后,菌丝体表面出现明显膨大或断裂现象,形成多种形态的奇形菌丝,且孢子数目明显减少。未经诱变处理的菌丝体分枝顶端有单个或多个成链状的分生孢子(图4c),孢子呈球形或椭球形,直径为4~10 μm;紫色红曲霉的闭囊壳在生长期呈近球形,表面呈现粗网纹,直径为25~75 μm,具柄且柄的长短不一,闭囊壳内散生有多数子囊,成熟后子囊壁解体呈伞状,孢子剩留在薄壁的子囊壳内,子囊孢子卵形或椭球形,直径为2~7.5 μm。诱变处理后(图4d),紫色红曲霉的分生孢子和闭囊壳在大小、形状、直径等方面均有明显变化,表明ARTP产生的活性粒子透过细胞膜作用于DNA 物质,引起DNA发生多样性损伤,细胞DNA不完全修复突变,形成遗传稳定的突变株。
2.4 突变菌株筛选结果
2.4.1 诱变突变株的初筛
取诱变时间为90 s的菌悬液,稀释、涂布平板、培养,根据ARTP诱变后菌落的大小、色泽、圆整度等生长状态,初步筛选平板培养基上菌落形态与原菌株有明显差异或生长较快的单菌落;淘汰菌落明显偏小、生长速率慢、菌丝稀薄和易老化的菌落,上述特征与邱雯雯[20]、李滔滔[21]等的研究结果类似。摇瓶培养比较获得的42株突变株产生Monacolin K的能力,其中突变株6、23、24、36菌株产生Monacolin K的能力较初始菌株M-1有明显提高(图5)。
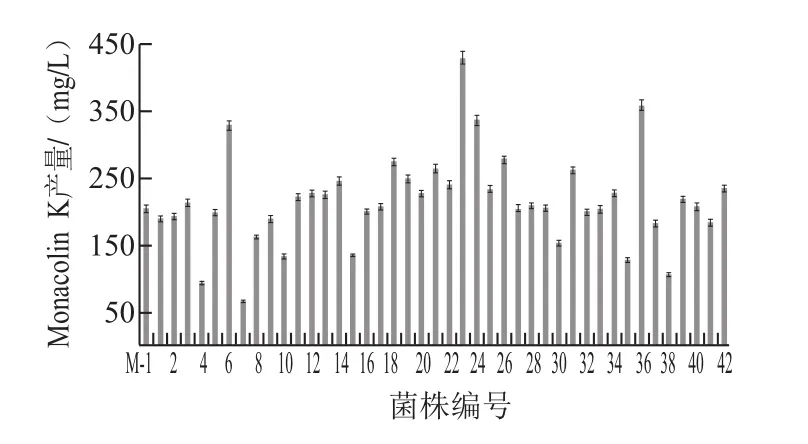
图5 初始菌株M-1及42株突变株产Monacolin K能力(摇瓶培养13 d)Fig.5 Monacolin K production of 42 mutants and the original strain during 13 days of shake flask cultivation
2.4.2 诱变突变株的复筛
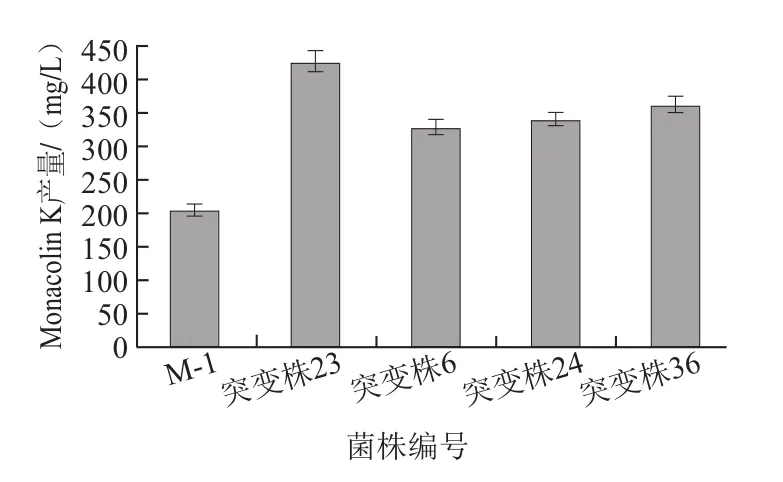
图6 初始菌株M-1与4株突变株Monacolin K产量的比较Fig.6 Comparison of monacolin K yields produced from four highyield mutants and the original strain

图7 突变株23的菌体生物量及Monacolin K产量Fig.7 Biomass and monacolin K yield of mutant strain 23
将初始菌株M-1及其4株突变株进行摇瓶发酵复筛(5株菌株培养条件相同),突变株23的Monacolin K产量达到428.14 mg/L,较初始菌株M-1提高了111%(图6)。如图7所示,在发酵过程中,突变株23的菌体生物量较初始菌株M-1有一定提高;突变株23和初始菌株M-1的Monacolin K在2~3 d时开始积累,第6天后突变株23产生Monacolin K的速率明显加强,表明紫色红曲霉产生Monacolin K主要发生在菌体生长的稳定期,此时次级代谢产物积累明显增强,且突变株较原始菌株的菌体生物量明显升高,因突变株23具有较强的产Monacolin K能力,故菌体细胞对于次级代谢产物Monacolin K的耐受性较高,在利用发酵液不断合成Monacolin K的过程中延迟到达细胞成熟期,菌体生物量进一步积累也是Monacolin K产量提高的关键。到达第14天时,Monacolin K的合成量趋于稳定,此时部分细胞发生裂解死亡,从而引起产量的细微波动。王兰等[22]经过紫外辐射、氯化锂、亚硝酸和硫酸二乙酯等诱变条件处理红曲霉菌株,最终得到具有较高产Monacolin K能力的诱变菌株W283,其Monacolin K的产量为402.1 mg/L,与出发菌株相比提高了53.1%,本研究所得结果与其持平。
3 结 论
本研究探讨了ARTP射流诱变技术处理紫色红曲霉菌株M-1,选育高产Monacolin K突变株的效果。结果表明,ARTP对紫色红曲霉菌株具有较强致死和致突变效应,ARTP处理90 s时其致死率约为92.6%;突变率为42.9%,正突变率达到23.8%,筛选获得的突变株23的Monacolin K产量达到428.14 mg/L,较初始菌株M-1提高了111%。ARTP作用于紫色红曲霉不仅可引起其形态学特征发生改变,突变株的菌落色泽、菌丝体和孢子形态等超微结构特征也均有一定变化;ARTP产生的活性粒子可透过细胞膜作用于DNA 物质,引起DNA发生多样性损伤,造成细胞DNA不完全修复突变,导致合成Monacolin K的部分调控基因发生碱基错配重排等情况继而高效表达,形成遗传稳定的突变株。
参考文献:
[1]纪远中.红曲及红曲霉的研究现状及进展[J].天津药学, 2005,17(2): 65-67.
[2]ENDO A.Monacolin K, a new hypocholesterolemic agent produced by a Monascus species[J].The Journal of Antibiotics, 1979, 32(8):852-854.
[3]BARRIOS-GONZÁLEZ J, MIRANDA R U.Biotechnological production and applications of statins[J].Applied Microbiology and Biotechnology, 2010, 85(4): 869-883.
[4]ENDO A.Chemistry, biochemistry, and pharmacology of HMG-CoA reductase inhibitors[J].Klinische Wochenschrift, 1988, 66(10): 421-427.
[5]KLAWITTER J, SHOKATI T, MOLL V, et al.Effects of lovastatin on breast cancer cells: a proteo-metabonomic study[J].Breast Cancer Research, 2010, 12(2): R16.doi: 10.1186/bcr2485.
[6]蔡友华, 李文锋, 卢伟宁, 等.新型常压室温等离子体(ARTP)快速诱变高产苏氨酸的突变株[J].现代食品科技, 2013, 29(8): 1888-1892.
[7]LU Yuan, WANG Liyan, MA Kun, et al.Characteristics of hydrogen production of an Enterobacter aerogenes mutant generated by a new atmospheric and room temperature plasma (ARTP)[J].Biochemical Engineering Journal, 2011, 55(1): 17-22.
[8]陈婧, 王斌, 李德明, 等.疏棉状嗜热丝孢菌耐热脂肪酶在无孢黑曲霉中的高效表达[J].食品工业科技, 2012, 33(20): 160-163.
[9]金丽华, 方明月, 张翀, 等.常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J].生物工程学报, 2011, 27(3): 461-467.
[10]LIU Rongming, LIANG Liya, MA Jiangfeng, et al.An engineering Escherichia coli mutant with high succinic acid production in the defined medium obtained by the atmospheric and room temperature plasma[J].Process Biochemistry, 2013, 48(11): 1603-1609.
[11]LAROUSSI M.Nonthermal decontamination of biological media by atmospheric-pressure plasmas: review, analysis, and prospects[J].IEEE Transactions on Plasma Science, 2002, 30(4): 1409-1415.
[12]王方方, 孙沛勇, 银会娟, 等.常压室温等离子体快速诱变酒精酵母及其突变株的特性研究[J].中国酿造, 2013, 32(10): 117-119.
[13]金丽华, 方明月, 张翀, 等.常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J].生物工程学报, 2011, 27(3): 461-467.
[14]胡文效, 魏彦锋, 蒋锡龙, 等.高产Monacolin K红曲霉菌种的诱变选育及液态发酵工艺优化[J].食品工业科技, 2013, 34(24): 296-301.
[15]LEE C L, WANG J J, PAN T M.Synchronous analysis method for detection of citrinin and the lactone and acid forms of monacolin K in red mold rice[J].Journal of AOAC International, 2006, 89(3): 669-677.
[16]刘德华, 刘代喜, 丁海洋, 等.红曲霉JR液体发酵产红曲色素的工艺研究[J].中国酿造, 2010, 29(5): 59-61.
[17]LÜ Fei, LIANG Hao, YUAN Qipeng, et al.in vitro antimicrobial effects and mechanism of action of selected plant essential oil combinations against four food-related microorganisms[J].Food Research International, 2011, 44(9): 3057-3064.
[18]马原辉, 陈学广, 刘哲.扫描电镜粉末样品的制备方法[J].实验室科学, 2011, 14(1): 148-150.
[19]俞艳玲, 邢旺兴, 陈士景.7种红曲霉的扫描电镜观察[J].浙江中医学院学报, 2005, 29(1): 78-79.
[20]邱雯雯, 任雅琳, 陈存社, 等.常压室温等离子体诱变筛选高乳糖酶活力酵母的研究[J].中国食品学报, 2014, 14(2): 132-137.
[21]李滔滔, 李小龙, 张凤琴.高产洛伐他汀红曲菌株的诱变选育[J].食品工业科技, 2012, 33(24): 246-248.
[22]王兰, 周立平, 陈强.高产Monacolin K红曲菌株的诱变选育[J].酿酒科技, 2008(6): 55-58.

